呈递预测的小鼠OX40胞外域抗原表位重组病毒样颗粒的制备
2021-08-19袁明翠张启书李维冉叶超谢航航黄惟巍马雁冰
袁明翠,张启书,李维冉,叶超,谢航航,黄惟巍,马雁冰
1.昆明医科大学,云南 昆明 650500;2.中国医学科学院 北京协和医学院医学生物学研究所,云南 昆明 650118
OX40(也被称作CD134/TNFRSF4)是第二代免疫检查点的代表性靶点之一。相比于CTLA-4及PD-1等共抑制分子,OX40属于T细胞表面的共刺激分子,广泛表达于炎症及肿瘤部位[1]。OX40是一种Ⅰ型跨膜糖蛋白,包括膜外区、跨膜区和膜内区3部分,其胞外段含有4个NGFR样结构,为半胱氨酸富集区,通过二硫键形成便于与配体结合的三维结构域[2]。小鼠和人OX40主要在活化的T细胞上表达,也包括自然杀伤细胞、自然杀伤T细胞及中性粒细胞,其配体OX40L(也被称作CD252)则表达于活化的抗原呈递细胞及血管内皮细胞等[3]。通过传递协同刺激信号,OX40使得活化的效应T细胞增殖及存活,同时有助于记忆T细胞的生成[4-6]。另外,OX40在肿瘤中可降低Treg细胞的活性,进而维持效应T细胞的功能[7-8]。在一些小鼠模型中,激动型OX40特异性单克隆抗体可消耗Treg细胞[9-10]。联合使用OX40特异性激动型抗体和抑制信号通路的阻断剂,可活化CD8+T细胞并分泌高水平IFNγ和颗粒酶B,进而抑制Treg细胞[11-14]。OX40激动型抗体对Treg细胞和效应T细胞的不同调节作用,有助于机体免疫系统发挥抗肿瘤效应[4,15-16]。
本研究旨在构建呈现小鼠OX40抗原表位的病毒样颗粒(virus-like particles,VLPs),为进一步以主动免疫方式靶向OX40调控T细胞免疫功能,进行疾病干预的研究奠定基础。
1 材料与方法
1.1 质粒及菌株 大肠埃希菌(E.coli)DH5α及表达修饰的乙型肝炎核心抗原(hepatitis B core antigen,HBcAg)的质粒pHBcAg为中国医学科学院医学生物学研究所分子免疫室保存,pHBcAg在对应HBcAg第78与79位氨基酸的核苷酸序列之间引入了BamHⅠ与EcoRⅠ位点,允许编码抗原的寡核苷酸片段插入。
1.2 实验动物 SPF级BALB/c雌性小鼠,6~8周龄,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCK(京)2016-0006,实验动物使用许可证:SYXK(京)2017-0033。饲养于清洁级动物房。
1.3 主要试剂及仪器 质粒提取试剂盒、胶回收试剂盒及纯化试剂盒购自天根生化科技(北京)有限公司;EcoRⅠ、BamHⅠ、NdeⅠ、PstⅠ、T4 DNA连接酶、蛋白质marker、DNA marker购自宝生物工程(大连)有限公司(TaKaRa);改良型Bradford蛋白浓度检测试剂盒购自生工生物工程(上海)股份有限公司,OX40蛋白由该公司合成;IPTG购自美仑生物技术有限公司;蔗糖购自鼎国生物技术有限公司;Alum佐剂、HRP标记的羊抗小鼠IgG及酶标仪购自赛默飞世尔科技公司;Sephadex G25填料、Sepharose 4 Fast Flow凝胶购自美国GE公司。
1.4 小鼠OX 40胞外段抗原表位预测 按GenBank中登录的小鼠氨基酸序列(P47741),利用网站进行抗原表位分析。其原理是基于对已知抗原表位统计获得的各种氨基酸出现的频率数据对待测蛋白进行分析,根据肽段中氨基酸频率大小预测出具有抗原性潜能的肽段,分析网站(http://imed.med.ucm.es/Tools/antigenic.pl)。主要靶向区域为OX40胞外区结构域,编码抗原肽的寡核苷酸序列由生工生物工程(上海)股份有限公司合成。
1.5 重组质粒的构建 用TE Buffer将合成的寡核苷酸溶解后,将正负链(50μmol/L)等量混合,置95℃热水中缓慢冷却至室温,形成编码抗原肽的双链DNA片段,并有BamHⅠ和EcoRⅠ的黏性末端暴露于两端。将质粒pHBcAg用限制性内切酶BamHⅠ和EcoRⅠ双酶切,胶回收载体片段,与编码抗原肽的双链DNA片段混合,经T4 DNA连接酶16℃连接过夜;连接产物转化E.coli DH5α感受态细胞,0.1%氨苄西林筛选阳性克隆,质粒小提试剂盒提取质粒,经双酶切(NdeⅠ/EcoRⅠ)鉴定正确后,送生工生物工程(上海)股份有限公司测序。
1.6 重组质粒的诱导表达 将测序正确的质粒转化E.coli DH5α感受态细胞,涂布含0.1%氨苄西林的LB平板,37℃培养;挑取单菌落接种至5mLLB(Amp+)液体培养基,37℃,180 r/min培养过夜;按1∶50比例转接至新鲜LB(Amp+)培养基中,恒温摇床37℃,220 r/min培养4 h;至A600约0.6时,调节摇床温度至28℃,加入IPTG至终浓度为1 mmol/L,继续培养4~5 h;4℃,8 000×g离心10 min,收集菌体,进行15%SDS-PAGE分析。
1.7 重组蛋白的纯化 每1 L菌液收集的菌体用10 mL PBS(20 mmol/L PB,150 mmol/L NaCl,pH 7.2)缓冲液重悬,冰水浴下进行超声破碎,超声总时间10 min,每次5 s,间隔10 s;4℃,17 000×g离心15 min,分别收集上清和沉淀,进行15%SDS-PAGE分析。
1.7.1 超声裂解上清中目的蛋白的纯化 收集上清加入硫酸铵至饱和度为40%,室温放置30 min;20℃,17 000×g离心20 min;弃上清,沉淀用饱和度20%的硫酸铵溶液洗涤5次,每次均20℃,17 000×g离心10 min;弃上清,沉淀用PBS重悬,蔗糖密度梯度离心(蔗糖梯度溶液从上至下依次为10%、20%、30%、40%和50%)后,用Sepharose 4 Fast Flow凝胶层析分离(2.5 cm×100 cm,流速为0.5 mL/min,缓冲液为PBS),收集样品进行15%SDS-PAGE分析。Bradford法测定蛋白浓度,0.22μm滤器过滤除菌后,于-80℃保存。
1.7.2 超声裂解沉淀中目的蛋白的纯化 收集沉淀,用低浓度变性剂(0.5、1、2 mol/L尿素以及2%Triton X-100)分别洗涤3次,考察对杂蛋白的洗涤效果及目的蛋白损失;以4、6、8 mol/L尿素分别溶解沉淀,考察目的蛋白溶解情况;用PBS分别进行2、4、8倍稀释,室温20℃静置2 h,考察尿素浓度降低沉淀产生情况;27 000×g离心20 min,收集上清,经0.45μm滤器过滤,用Sephadex G25凝胶层析脱盐,Bradford法测定蛋白浓度,0.22μm滤器过滤除菌,于-80℃保存。
1.8 VLP s形态观察 将纯化的嵌合蛋白样品经2%磷钨酸染色后,透射电镜下观察VLPs形态。
1.9 小鼠免疫 将VLPs与Alum佐剂在旋转混合仪上混合,4℃,360度缓慢旋转1 h后,每只小鼠背部皮下免疫100μL(含50μg抗原蛋白及4 mg Alum),2周1次,共3次,每剂接种后1周腿静脉采血,分离血清。
1.10 小鼠血清抗体水平检测 采用ELISA法。将OX40蛋白包被96孔板,100μL/孔,4℃过夜;PBST洗涤3次,2%BSA 37℃封闭2 h;PBST洗涤3次,加入小鼠免疫血清(1∶5 000稀释),37℃孵育1 h;PBST洗涤3次,加入HRP标记的羊抗小鼠IgG(1∶5 000稀释),37℃孵育1 h;PBST洗涤5次,TMB显色,37℃孵育15~30 min;酶标仪检测A450和A620,结果为A450-A620值。
2 结果
2.1 预测的抗原表位 经预测共获得7个潜在的抗原表位,为P1~P7。
2.2 重组质粒的鉴定 质粒的双酶切产物经1%琼脂糖电泳分析,获得的重组质粒目的条带略大于载体质粒。pHBcAg(NP)对应条带,产物大小为分别为297和276 bp,与预期相符,见图1(以P6为例),测序结果证明构建正确。
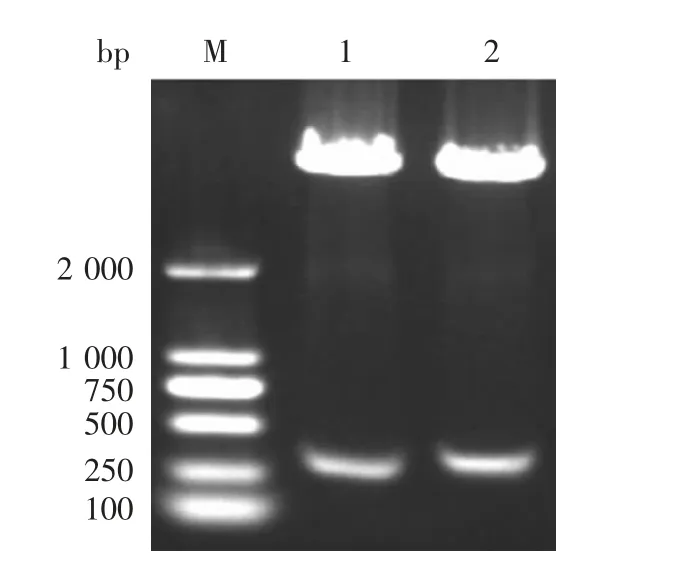
图1 重组质粒的双酶切(NdeⅠ/EcoRⅠ)鉴定Fig.1 Restriction map of recombinant plasmids(NdeⅠ/EcoRⅠ)
2.3 表达产物的鉴定 15%SDS-PAGE分析显示,重组菌均有效表达了目的蛋白(P1~P7),其理论相对分子质量分别约为19 000、18 900、18 600、19 000、18 700、19 000和18 600,由于抗原肽的插入而略大于NP编码的蛋白HBcAg(理论相对分子质量约为17 500),见图2。
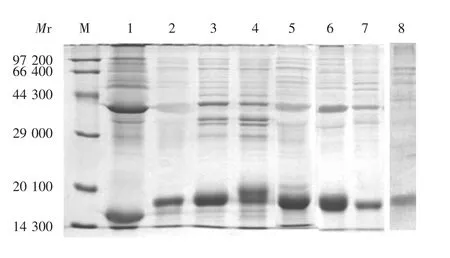
图2 表达的重组P1~P7蛋白的SDS-PAGE鉴定Fig.2 SDS-PAGE profile of expressed recombinant P1~P7 proteins
2.4 纯化产物的鉴定
2.4.1 超声裂解上清中重组蛋白的纯化 重组蛋白P3、P6和P7存在于可溶性上清中,经硫酸铵沉淀及洗涤步骤可去除部分杂蛋白。经蔗糖密度梯度离心后,SDS-PAGE分析表明,目的蛋白得到进一步纯化并主要存在于8~10层,见图3(以P6为例),与天然形式的HBcAg一致,表明可能以HBcAg VLPs形式存在;取7~11层蛋白经Sepharose 4 Fast Flow凝胶层析纯化后(见图4,以P6为例),取峰2进行SDS-PAGE分析,目的蛋白条带大小与预期相符,见图5(以P6为例)。

图3 裂解上清中纯化产物的SDS-PAGE分析Fig.3 SDS-PAGE profile of purified protein in supernatant

图4 7~11层蛋白Sepharose 4 Fast Flow凝胶层析纯化图谱Fig.4 Purification of proteins in layers 7~11 of sucrose density gradient centrifugation by Sepharose 4 Fast Flow gel chromatography
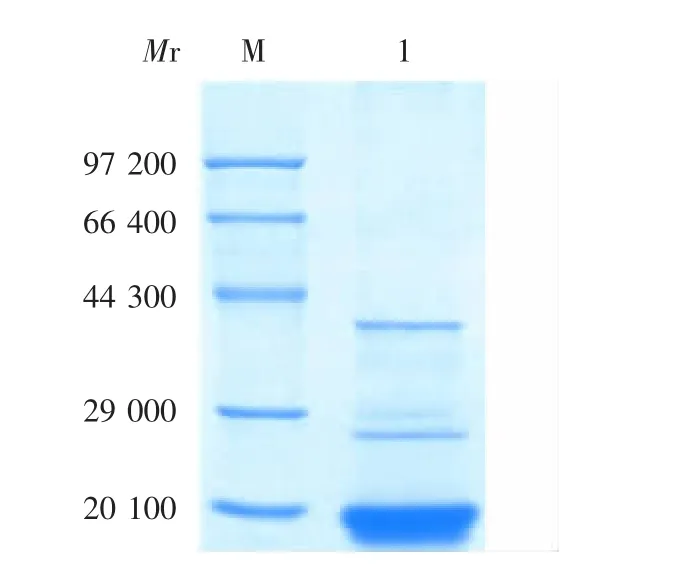
图5 Sepharose 4 Fast Flow凝胶层析纯化产物的SDSPAGE分析Fig.5 SDS-PAGE profile of protein purified by Sepharose 4 Fast Flow gel chromatography
2.4.2 超声裂解沉淀中重组蛋白的纯化 重组蛋白P1、P2、P4和P5存在于沉淀中,经低浓度的变性剂洗涤后可去除部分杂蛋白,见图6(以P5为例)。但以尿素洗涤杂蛋白,目的蛋白损失较大,而以2%Triton X-100洗涤杂蛋白去除效果明显且目的蛋白损失少。沉淀经4 mol/L尿素溶解,即可达到有效溶解的目的,而稀释至0.5 mol/L尿素也未产生明显沉淀。离心上清经15%SDS-PAGE分析,在相对分子质量约18 000处可见与目的蛋白相符的条带,见图7(以P5为例)。进一步的电镜观察显示,4 mol/L尿素溶解沉淀后样品可见大量VLPs存在。因此,确定后续VLPs制备条件为:经2%Triton X-100洗涤沉淀,以4 mol/L尿素溶解,并以PBS进行8倍稀释。

图6 沉淀经低浓度去垢剂洗涤纯化后产物的SDS-PAGE分析Fig.6 SDS-PAGE profile of purified protein washed with low concentration detergent
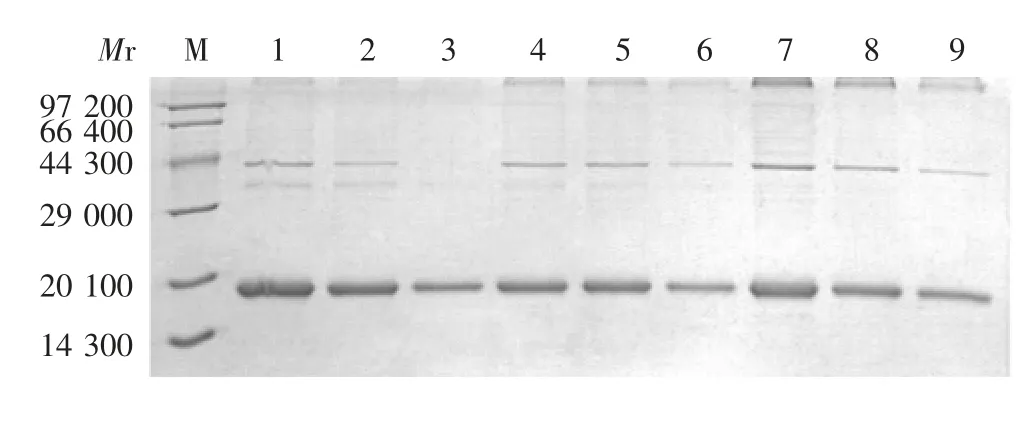
图7 沉淀经2%Triton X-100洗涤、尿素溶解、PBS稀释后产物的SDS-PAGE分析Fig.7 SDS-PAGE profile of precipitate washed with 2%TritonX-100,dissolved in urea and diluted with PBS
2.5 VLPs的电镜观察 结果显示,重组蛋白P1~P7均形成直径约30 nm的VLPs,且形态、大小与原始HBcAg VLPs相似。见图8。

图8 VLPs的透射电子显微镜观察Fig.8 Transmission electron microscopy of VLPs
2.6 小鼠血清OX 40特异性抗体水平 ELISA结果显示,重组蛋白免疫后的小鼠抗血清可与OX40蛋白发生不同程度的特异性反应,见图9,抗体动态应答图见图10(以P6为例),抗体滴度可达128 000,见图11(以P6为例)。

图9 血清特异性抗体应答分析Fig.9 Serum specific antibody responses induced by recombinant proteins in mice
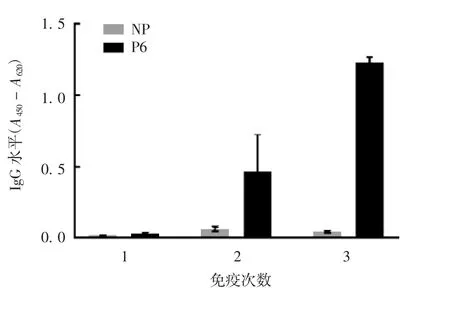
图10 P6 3次免疫血清特异抗体应答动力学Fig.10 Kinetics of serum specific antibody response induced by immunization with P6 for 3 times

图11 重组蛋白免疫后的小鼠血清抗体滴度Fig.11 Serum antibody titers of mice immunized with recombinant proteins
3 讨论
B细胞抗原表位可被B细胞表面受体(B-cell receptor,BCR)或抗体Fab部分特异性识别并结合,是体液免疫的物质基础。多肽表位的大小一般为5~15个氨基酸。随着线性B细胞表位预测方法的不断增加,节约了大量的实验室工作,避免了传统表位研究的盲目性,为免疫诊断和免疫治疗提供了便利[17]。本实验是基于氨基酸在抗原中出现的频率对待测蛋白进行预测,准确率可达60%~70%,结合肽段的亲水性、疏水性分析以及蛋白三维结构数据,可达到更高的效率。
本实验通过基因重组将预测得到的OX40抗原表位插入至HBcAg VLPs,利用VLPs独特的结构及免疫学特点,赋予肽表位强免疫原性,为抗原表位的快速分析鉴定提供了一个平台。旨在利用主动免疫策略激发特异抗体应答,为靶向调控OX40提供有效手段。与之相比,单克隆抗体、可溶性受体等被动免疫制剂由于半衰期短,需要反复给药,且价格昂贵等,在研究及临床应用中具有局限性。本文利用重组HBcAg VLPs作为疫苗载体,具有以下优势:可在大肠埃希菌中高效表达,并自我组装成VLPs;易于纯化、制备;纳米颗粒结构及抗原表位在颗粒表面的高度有序重复排列,高效刺激了抗原递呈细胞对抗原肽的摄取、加工及呈递,从而赋予肽表位强免疫原性,即使不用常规佐剂也能激发强烈的免疫应答。
靶向检查点分子的免疫治疗药物并不直接作用于癌细胞,而是通过作用于免疫细胞,促进对癌细胞的杀伤效应;而且,免疫治疗药物并不是针对癌细胞表面的某些特定物质,而是系统性地增强了全身的抗肿瘤免疫应答。OX40是极有希望的新一代检查点疗法靶向分子,其是表达于细胞毒性T细胞和Treg细胞的活化受体,激动型的OX40抗体为CD8+T杀伤细胞和CD4+T辅助细胞的增殖及扩增提供了刺激信号,同时也对Treg产生抑制[11]。OX40主要在CD8+T细胞、NK细胞、NKT细胞或中性粒细胞中表达,而OX40L在树突细胞、B细胞、巨噬细胞表达。早期临床前研究显示,OX40能刺激包括肉瘤、黑色素瘤、乳腺癌等肿瘤免疫原性模型,激起抗肿瘤作用[4-5,18-20],但单药对弱免疫原性模型效果一般。后续研究将利用构建的VLPs激发OX40特异抗体,鉴定其对OX40信号通路及靶细胞的作用,并考察其在肿瘤生长及肿瘤免疫应答中的调控作用,还将重点考察其对肿瘤疫苗作用的协同性,为肿瘤免疫治疗提供新的手段及策略。
