拉曼光谱在胚胎质量评估中的应用价值
2021-08-19黄静姜宏刘颖刘迎春倪丰
黄静,姜宏,刘颖,刘迎春,倪丰
(中国人民解放军联勤保障部队第九○一医院生殖中心,合肥 230031)
人类辅助生殖技术(ART)是不孕症治疗的重要手段之一,在全球范围内的临床应用不断增加。胚胎质量是影响体外受精(IVF)结局的重要影响因素。传统的胚胎形态学评估因其快速简单、对胚胎无创等特点是目前最常用的胚胎评估方法。然而,该法依赖于观察者的经验和水平,评价标准相对主观,需多次在培养箱以外的环境中对胚胎进行观察,且并不能完全准确预测胚胎的发育潜能和种植能力[1-3]。
近年,随着各种组学技术的发展,新的非侵入性胚胎评估策略受到众多学者的关注。其中,代谢组学是关于生物体内源性代谢物质种类、数量及变化规律的科学,是研究生物整体、系统、器官或细胞的内源性代谢物质及内在或外在因素相互作用的科学[4],其研究的目标为细胞活动过程的最终产物,更接近生物的功能表型,可提供较转录组学和蛋白质组学更多的信息。
拉曼光谱作为代谢组学最常用的分析技术之一,是在印度物理学家拉曼发现的拉曼散射效应基础上发展起来的,研究分子振动、转动信息的一种光谱技术[5],而分子的振动和转动信息能够反映其结构特征,即每一种物质都有其各自特征的拉曼光谱。因此,通过检测样品的拉曼散射并绘制成光谱,分析拉曼光谱的峰位信息便可以鉴定样品,并推导出有关样品的结构和化学等相关信息[6]。由于拉曼光谱具有非侵入、检测迅速、信息丰富、敏感度高、无需样本制备等优点,更重要的是受水的干扰小,特别适用于IVF领域胚胎培养液代谢组学的检测。本研究通过拉曼光谱结合传统的化学计量学方法中的主成分分析(PCA)和先进的机器学习方法对优质胚胎和非优质胚胎进行分析,以期在传统的胚胎形态学评估基础上,寻找快速、无创以及更客观可靠的胚胎质量评估方法,为选择性单胚胎移植提供具有最佳发育潜能的胚胎。
资料与方法
一、研究对象
收集2018年5月至2019年1月在我院生殖中心行卵胞浆内单精子注射(ICSI)治疗患者的D3胚胎培养液。纳入标准:(1)女方年龄<38岁;(2)促排卵方案为拮抗剂方案;(3)受精方式为ICSI。排除女方多囊卵巢综合征、男方无精子症、夫妻双方染色体异常或有严重的全身代谢性或免疫性疾病者。本研究经医院生殖医学伦理委员会审议批准,所有患者均签署知情同意书。
本研究共纳入16例患者的D3胚胎培养液共122份。根据D3胚胎形态学评分,将其对应的胚胎培养液分为优质胚胎组(66份)和非优质胚胎组(56份),另选择无胚胎的D3胚胎培养液作为空白对照组(20份)用于拉曼光谱测定的均一化预处理。
二、研究方法
1.控制性促排卵(COS):所有患者均采用促性腺激素释放激素拮抗剂(GnRH-ant)灵活方案进行COS。根据患者的年龄、体质量指数(BMI)、基础性激素、窦卵泡数及抗苗勒管激素(AMH)水平于月经周期第2或第3天给予100~300 U的促卵泡生长激素(FSH)(果纳芬,默克雪兰诺,瑞士)皮下注射或肌肉注射,根据阴道超声和性激素水平监测卵泡生长并调整用药量,当最大卵泡≥12~14 mm或E2>1 100 pmol/L,予GnRH-ant(醋酸西曲瑞克,思则凯,默克雪兰诺,瑞士)0.25 mg/d皮下注射。当1个主导卵泡≥18 mm或3个以上主导卵泡≥17 mm时,予重组人绒毛膜促性腺激素(rHCG,艾泽,默克雪兰诺,瑞士)250 μg皮下注射,36 h后行经阴道超声取卵术。将所获的卵冠丘复合物放入预平衡的G-IVF培养液(Vitrolife,瑞典)中,置入5%CO2、37℃培养箱中培养待用。
2.ICSI:采用透明质酸酶80 U/ml(hyaluronidase,SAGE,美国)消化卵冠丘复合物,毛细管轻柔去除包绕卵母细胞的颗粒细胞后,将卵母细胞置入5%CO2、37℃培养箱中待用。选择具有第一极体的成熟卵母细胞置入ICSI皿中,7%聚乙烯吡咯烷酮(PVP,SAGE,美国)微滴中精子制动,并注入卵胞浆内,注射后的卵母细胞移入G-1 plus培养液(Vitrolife,瑞典)中继续培养。
3.受精及胚胎评分:ICSI后16~18 h观察受精情况,出现2原核(PN)认为是正常受精,将正常受精单个胚胎置于G-1 plus培养液中培养,受精后D3由同一名实验室人员对胚胎进行观察和评分,以确保一致性。
胚胎形态评分:D3胚胎评估参数主要有卵裂球的数量、大小、形状、对称性、胞质的形态、有无碎片和空泡等。参照既往文献[7],将胚胎分为4个等级:I级(优质)胚胎:卵裂球大小均匀,形状规则,透明带完整,胞质均匀无颗粒现象,碎片极少(碎片≤5%);Ⅱ级胚胎:卵裂球大小稍不均匀,形状稍不规则,胞质有颗粒现象,碎片比例6%~20%;Ⅲ级胚胎:卵裂球不均匀,形状不规则,胞质有明显颗粒现象,碎片比例20%~50%;Ⅳ级:卵裂球严重不均匀,形状严重不规则,胞质有严重颗粒现象,碎片>50%。D3卵裂球数目7~10个的Ⅰ、Ⅱ级胚胎定义为优质胚胎,D3卵裂球数目7~10个的Ⅲ级胚胎及卵裂球数5~6个的Ⅰ、Ⅱ级胚胎定义为非优质胚胎。
4.样本收集及保存:将优质胚胎组和非优质胚胎组的D3培养液,各吸取15~20 μl 转入已标记的Eppendorf管中,-80℃冰箱冷冻保存,待用。
5.拉曼光谱测定:冷冻胚胎培养液在25℃室温下复温30 min,吸取10 μl样品置于BaseRaman拉曼分析仪(苏州贝康医疗器械有限公司)自带的显微镜下进行拉曼光谱分析,激光器波长为785 nm,激光输出功率300 mW,激光焦点100 μm,半导体制冷阵列CCD(-26℃),单次积分时间为20 s,取单个样本3次重复测试的平均值作为最终结果。
6.数据处理与分析数据:分析流程:(1)原始数据格式转化;(2)转化后的数据预处理;(3)预处理数据PCA可视化;(4)使用机器学习构建模型并评估。详见图1。
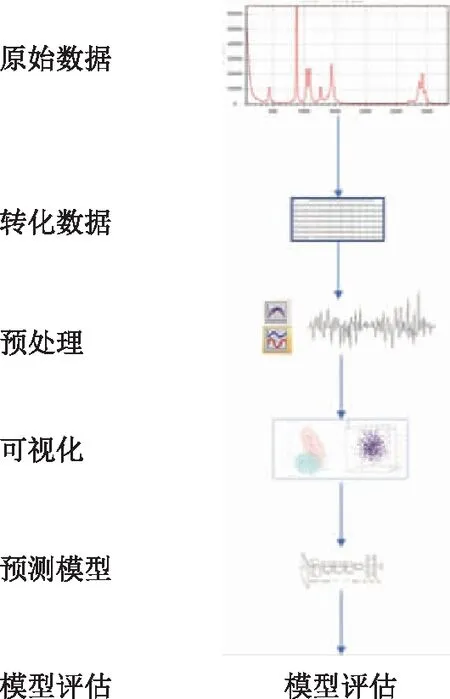
图1 数据分析流程
具体方法如下:获得培养液检测数据后,需要对原始检测数据进行数据处理以得到标准数据用于后续模型构建及预测。首先提取300~2 000 cm-1范围内的数据用于下一步的标准化处理;对上一步得到的数据采用向量均一化方法进行数据均一化处理,并选择600~1 800 cm-1范围内的数据,以消除拉曼光谱整体信号强度差异造成的影响;然后分别使用Haar及Daubechies 4小波变换方法将处理后的拉曼信号进行降噪处理,生成两组变换后的拉曼信号。将小波变换后的两组信号作为样本的两个特征向量,构建后续预测模型所使用的输入数据。最后使用卷积神经网络模型(CNN)算法对所有样本的拉曼数据进行模型构建及结果预测。CNN模型包括512个卷积核心,以relu为激活函数,其预测主要指标为:敏感性(Sensitity)、特异性(Specificity)和准确度(Accurary)。真阳性数(True positives,TP)、真阴性数(True negatives,TN)、假阳性数(False positive,FP)、假阴性数(False negative,FN),计算公式:敏感性=TP/(TP+TN);特异性=TP/(TP+FP);准确度=(TP+TN)/(TP+FP+TN+FN)。
结 果
一、PCA可视化结果
如图2所示,优质胚胎组与非优质胚胎组的PCA可视化结果部分数据重叠,大部分数据可见明显的聚类,优质胚胎组与非优质胚胎组的拉曼光谱明显不同。
二、PCA的载荷向量(loadings)结果
PCA计算的loadings结果显示,优质胚胎组与非优质胚胎组间第一维主成分(PC1)存在显著性差异(P<0.05),第二维主成分(PC2)和第三维主成分(PC3)无显著性差异(P>0.05),表明优质胚胎组与非优质胚胎组的拉曼光谱有统计学差异(P<0.05)。通过对PCA的loadings分析,发现差异主要由第一维主成分的1 050~1 150 cm-1、1 250~1 350 cm-1和1 400~1 500 cm-1三个拉曼位移区段贡献(图3)。

A:二维PCA,黄色表示优质胚胎样本,蓝色表示非优质胚胎样本;B:三维PCA,蓝色表示优质胚胎样本,红色表示非优质胚胎样本图2 二维及三维PCA结果

红色表示非优质胚胎组,蓝色表示优质胚胎组。与优质组比较,*P<0.05图3 PCA聚类分析与载荷向量
三、CNN预测结果
采用机器学习算法构建模型,拉曼光谱预测优质胚胎的特异性为71.21%,敏感性为73.21%,准确性为72.13%。具体检测情况见表1。

表1 CNN模型预测胚胎质量评估结果(n=122)
讨 论
代谢组学是继基因组学、转录组学、蛋白质组学之后兴起的一个新的组学研究热点,是系统生物学的重要组成部分。因其检测技术多样、操作简单、信息丰富全面,已广泛应用于生物医学的基础研究和临床实践。
目前ART领域代谢组学的主要研究对象为卵母细胞、精子和胚胎,目标代谢物主要为乳酸、丙酮酸、葡萄糖和氨基酸等。夏兰等[8]应用气相色谱-质谱联用技术(GC-MS)对13例反复失败IVF患者和15例首个周期成功妊娠患者的卵泡液代谢物进行比较分析,发现反复失败组卵泡液中部分氨基酸含量显著升高,二元羧酸、胆固醇及部分有机酸含量显著降低。Gupta等[9]对125例不育男性和60例正常男性的精液样本进行核磁共振波谱(NMR)检测,发现不育男性与正常男性的丙氨酸、柠檬酸、酪氨酸和苯丙氨酸含量有显著差异。另有研究显示,胚胎的丙酮酸摄取范围波动较大,但在可种植胚胎,其波动范围缩小[10]。Brison等[11]使用高效液相色谱(HPLC)对培养24 h后培养液中的氨基酸浓度进行检测,发现天冬氨酸、甘氨酸浓度的降低及亮氨酸浓度的升高与IVF妊娠结局相关。Seli等[12]采用质子核磁共振(1HNMR)技术发现D3胚胎培养液中谷氨酸水平的升高与临床妊娠和活产之间具有相关性,其预测种植胚胎的敏感性为88.2%,特异性为88.2%。上述研究结果均证实,卵泡液、精液和胚胎培养液中代谢物的变化与人类卵母细胞、精子和胚胎的质量及临床结局密切相关。但单独的代谢物变化较大,尚不能作为配子/胚胎质量评估的可靠生物标志物。代谢组学可更全面、准确地反映配子/胚胎细胞代谢过程的最终产物概况。有学者发现卵泡液中部分代谢物与卵母细胞的发育潜能有关,并可预测IVF结局[13]。Vergouw等[14]进一步证实,采用近红外光谱(NIR)分析胚胎培养液的代谢组学可以区分着床胚胎和未着床胚胎,并与冷冻周期单胚胎移植的活产率相关[15]。
培养液为胚胎体外生长发育提供营养物质和代谢微环境,培养液中代谢物的变化可直接反应胚胎发育和代谢状态,与胚胎质量密切相关,因此对培养液进行代谢组学分析可作为一种无创、客观的评估胚胎质量的方法。在代谢组学的众多分析技术中,拉曼光谱因具有非侵入、敏感度高、无需样本制备及受水的干扰小等优点,被广泛应用于胚胎培养液的检测。Seli等[16]利用拉曼光谱对已知妊娠结局的D3胚胎培养液进行分析,发现妊娠组与非妊娠组的硫氢键-SH、碳氢键-CH、氮氢键-NH存在差异,其敏感性为86%,特异性为76.5%,并在随后的研究中,将预测阴性结果的特异性进一步提高到80%[17]。董梅等[18]利用拉曼光谱检测D3胚胎培养液,发现妊娠组丙酮酸/白蛋白比值显著高于非妊娠组,并且联合丙酮酸和形态学预测妊娠成功的敏感度为72%,特异度84%。Liang等[19]的近期研究发现,胚胎培养液中的代谢组学与胚胎的染色体整倍性相关,胚胎染色体异常可导致培养液中代谢足迹的变化,并可通过拉曼光谱检出,其中整倍体胚胎与非整倍体胚胎的差异位于967~1 015 cm-1、1 229~1 295 cm-1和1 400~1 430 cm-1三个拉曼位移区。Ding等[20]研究结果显示,D3胚胎培养液的拉曼光谱与传统形态学评分结果一致,优质胚胎与非优质胚胎在拉曼位移峰值755 cm-1处有显著差异。本研究的结果也证实,优质胚胎组与非优质胚胎组的D3胚胎培养液具有不同的拉曼光谱,其预测敏感性为73.21%,特异性为71.21%,提示胚胎培养液的代谢组学与胚胎质量相关;但本研究差异主要由第一维主成分1 050~1 150 cm-1、1 250~1 350 cm-1和1 400~1 500 cm-1三个拉曼位移区段贡献,推测可能是由于本研究与上述研究所采用的培养液不同。培养液成分的不同导致代谢组学的特征光谱不同,查阅相关分子键产生拉曼峰的特性为:1 096 cm-1特征峰体现的是DNA分子中 PO2的伸展模式,1 300 cm-1、1 420 cm-1及1 463 cm-1特征峰体现的分别是脂类CH2扭转、CH2振动以及CH3/CH2变形模式[21-23]。
综上所述,优质胚胎与非优质胚胎其拉曼光谱显著不同,采用拉曼光谱结合PCA分析及CNN算法,可以区分优质胚胎与非优质胚胎,对胚胎质量评估有一定的参考价值。但本研究预测特异性、敏感性和准确度仍有待提高,推测可能与样本量相关。
