以反复吞咽困难为主要症状的系统性硬化症一例
2021-08-19黄雪芳龙辉李欢
黄雪芳 龙辉 李欢
患者,男,75岁,因“反复吞咽困难半年,呕血2天”于2018年6月2日入院。患者半年前无明显诱因出现吞咽困难,反复发作,进食固体及液体食物均可引起,无进行性加重,伴消瘦,偶有反酸、烧心及胸骨后疼痛,无咳嗽、咳痰,无低热、盗汗等,未予重视。2天前患者无诱因出现呕血,呈鲜红色,量约10ml,无头昏、心慌。起病以来,患者精神、食欲一般,睡眠、大小便尚可。否认高血压、糖尿病等慢性病史;否认结核、肝炎等传染病病史;有饮酒史,否认吸烟史;无肿瘤及遗传疾病家族史。入院体格检查:T 36.5 ℃,P 70次/分,R 19次/分,Bp 110/60 mmHg。神志清楚,贫血貌,颜面部及前胸壁毛细血管扩张,巩膜无黄染,心肺体格检查未见明显异常。腹平软,剑突下轻压痛,无反跳痛,肝脾肋下未触及,腹水征阴性,肠鸣音正常。四肢活动自如。病理征阴性。辅助检查:血常规:Hb 79 g/L(130~175 g/L,括号内为正常参考值范围,以下相同),红细胞比容(HCT)27.9%(40.0%~50.0%),平均红细胞体积(MCV)59.6 fl(82.0~100.0 fl),平均红细胞血红蛋白含量(MCH)17 pg(27~34 pg),平均红细胞血红蛋白浓度(MCHC)285 g/L(316~354 g/L),PLT计数443×109/L(125~350×109/L);肝功能:血清总蛋白(TP)63 g/L(65~85 g/L);凝血功能、D-二聚体、甲胎蛋白、癌胚抗原、糖类抗原CA19-9、红细胞沉降率、C反应蛋白均正常。电子胃镜检查示:1.反流性食管炎D级;2.食管下段溃疡性质待病检;3.慢性萎缩性胃炎(图1)。食管组织病理检查结果示:慢性炎症改变伴急性活动,少数鳞状上皮细胞轻度不典型增生,另见较多炎性坏死物,符合溃疡改变。肝胆胰脾门脉超声检查结果示:1.肝实质回声改变(肝硬化?);2.肝内多发囊肿;3.门脉高压(门脉内径1.6 cm);4.脾大、脾静脉增宽。结合病史及辅助检查结果,初步诊断:1.反流性食管炎并食管溃疡、出血;2.酒精性肝病?肝硬化?拟行胸部CT及食管测压等相关检查,患者拒绝。给予抑酸及对症支持治疗后,患者未再呕血,吞咽困难症状好转后出院。虽食管组织病理结果未见异型细胞,但该患者为老年患者,有消瘦、贫血等报警症状,不能排除食管恶性肿瘤性病变,建议其1个月后复查内镜。患者于出院1个月后再发吞咽困难,复查血常规:Hb 80 g/L,HCT 28%,MCV 59.3 fL,MCH 16.8 pg,MCHC 283 g/L,PLT计数461×109/L;肝功能:白蛋白(Alb)38.5 g/L;胸部+上腹部CT平扫检查结果示:1.食管下段管壁增厚,食管扩张;2.左上肺结节灶,左下肺纤维灶;3.双侧胸腔少量积液伴左下肺部分组织膨胀不全,双侧胸膜肥厚、粘连;4.心脏增大,冠状动脉及主动脉粥样硬化;5.心包积液(少量);6.肝脏及左肾低密度灶;7.脾大、少量腹水。食管造影检查结果示:食管下段(约T11椎体)水平见充盈缺损区,管腔呈向心性狭窄,狭窄段长约2.7 cm,宽约0.9 cm,食管下段癌可能(图2)。再次复查胃镜结果示:1.反流性食管炎、食管下段溃疡(较前好转);2.食管下段管腔稍狭窄。病理检查结果示:(食管前壁、后壁及下段)黏膜组织呈慢性炎症改变伴急性活动及鳞状上皮增生,少数腺体呈轻度不典型增生。由于两次病理检查均未发现恶性肿瘤细胞,患者食管溃疡需鉴别其他疾病的可能性,如食管结核、系统性硬化症、克罗恩病、白塞病等。再次仔细询问病史及体格检查,发现患者双手指端僵硬,有雷诺现象3年。进一步完善相关检查:结核菌感染T细胞斑点试验(T-SPOT)、乙肝表面抗原(HBsAg)、人类免疫缺陷病毒(HIV)、丙型肝炎病毒(HCV)均为阴性;甲状腺功能及肠镜检查均未见异常;抗中性粒细胞胞浆抗体(ANCA)阴性;抗核抗体(ANA):1∶3 200,抗着丝点抗体(ACA)阳性;抗链球菌溶血素O、类风湿因子(RF)无异常。食道测压结果示:食管体部平滑肌表现为失蠕动;食管体部节段性同步收缩,收缩波未达胃食管连接部(EGJ);食管下括约肌(LES)可见松弛;结论:食管体部收缩障碍。结合患者双手指端僵硬、雷诺现象、ANA及ACA阳性、食管体部收缩障碍等特点,且暂无关节、肺脏、心脏、肾脏等其他器官受累表现,根据指南最终诊断为系统性硬化症(SSc,局限性皮肤型)。给予羟氯喹、硫唑嘌呤、白芍总苷及艾司奥美拉唑镁肠溶片等治疗,患者吞咽困难症状好转后出院。出院随访至2019年10月,患者未再出现明显的吞咽困难症状,复查胃镜结果示食管下段溃疡愈合,管腔稍狭窄(图3)。超声胃镜检查示局部肌层增厚,腹部、心脏彩超提示腹腔积液、心包积液较前明显减少。
讨 论
SSc是一种病因及发病机制尚未完全明确的慢性自身免疫性疾病,具有独特的致病特点,包括血管病变、免疫系统激活、组织纤维化等[1-2]。临床上主要以局限性或弥漫性皮肤增厚和纤维化为特征,亦可影响内脏[3]。多数发病年龄在30~50岁,女性多见[3]。根据患者皮肤受累的情况将SSc分为5种亚型[4]:(1)局限性皮肤型SSc;(2)CREST综合征(局限性皮肤型SSc的一个亚型);(3)弥漫性皮肤型SSc;(4)无皮肤硬化的SSc;(5)重叠综合征。约80% SSc患者以雷诺现象为首发症状,少数患者因累及肺脏、心脏、肾脏及消化道系统等内脏疾病起病[4]。消化道受累为SSc的常见表现,仅次于皮肤受累和雷诺现象,其中食管受累最为常见,发生率高达70%~90%[1],但一半以上患者早期无明显临床症状[5]。
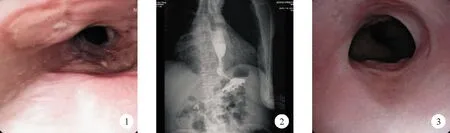
图1 患者治疗前胃镜检查结果 图2 患者治疗前食管造影检查结果 图3 患者治疗后胃镜检查结果
本例患者就诊时以反复吞咽困难为主要症状,结合病史及内镜表现,考虑为食管源性吞咽困难,病因主要包括:(1)内源性管腔狭窄,如食管炎、食管良恶性肿瘤、食管结核等;(2)外压性管腔狭窄,如纵隔肿瘤或淋巴结肿大等;(3)食管动力功能障碍,如系统性硬化症、贲门失弛缓、重症肌无力、皮肌炎、弥漫性食管痉挛等。该患者起初考虑诊断为食管恶性肿瘤,但两次病理检查均未找到肿瘤异型细胞,且不具有进行性吞咽困难这一特征性临床症状,食管癌依据不充分。其次,患者无食管结核、克罗恩病的典型临床表现,T-SPOT及ANCA等相关检查结果亦可协助鉴别。白塞病虽可导致食管溃疡,但较少引起食管狭窄及吞咽困难,且食管白塞病常伴有口腔、皮肤及生殖器溃疡,内镜检查可见食管中下段多形性溃疡,病理常伴有小血管炎[6],质子泵抑制剂(PPI)治疗无效,与该患者不符。因此,考虑患者吞咽困难由食管动力功能障碍引起。经过再次仔细询问病史及体格检查,发现患者具有指端硬化、雷诺现象多年,结合ANA、ACA阳性,高度怀疑SSc继发的食管动力障碍,进一步行食管测压提示食管体部收缩障碍,根据指南最终确诊为局限性皮肤型SSc。据报道,近90%的SSc患者表现为食管下端括约肌张力降低和(或)食管蠕动显著降低[4]。随着病程进展,可出现胸骨后灼热感、反酸、吞咽困难及吞咽痛,长期可引起糜烂性食管炎、食管溃疡及出血,甚至出现食管下段狭窄、营养不良等并发症[4]。因此,该患者所表现的吞咽困难、食管溃疡及食管狭窄等均考虑为SSc的消化系统食管受累表现,是最常发生的皮肤外表现[5],与受累组织的血管病变、胶原增殖及纤维化等所导致的食管运动功能障碍、胃食管反流相关。在临床工作中,SSc相关反流引起的食管炎症和溃疡因缺乏典型内镜表现及诊断标准,常难以与其他疾病相鉴别。但由于SSc累及食管时主要表现为食管运动功能障碍,因此食管测压对相关疾病的鉴别有一定帮助。本例患者食管测压结果也证实了这一点。此外,该患者虽然以吞咽困难为主要症状来我院就诊,但早已出现指端硬化和雷诺现象多年,符合SSc一般以皮肤损害和雷诺现象为首发症状这一临床特点。因此,除了需要加强对全身系统性疾病的认识,临床医生更应重视病史采集及体格检查,以鉴别每个疾病的特点,提高早诊断率。
目前,针对SSc的治疗仍缺乏特效药物。SSc是一种异质性疾病,临床表现多样,因此,早期识别及分型、分期对疾病的整体评估和治疗尤为重要[7]。目前的治疗措施包括免疫抑制治疗、血管活性治疗、抗纤药物治疗、细胞移植治疗、特殊受累器官的治疗等[1]。而针对SSc引起的消化道症状多以对症治疗为主。建议使用PPI或H2受体拮抗剂联合促胃动力药物改善患者的胃食管反流及吞咽困难症状[8]。胃食管反流是SSc患者肺间质性疾病的一项重要危险因素,多项研究证实,PPI是最有效的治疗药物,早期给予PPI治疗可减少胃食管反流相关间质性肺病的发生[9],因此建议在所有SSc患者病程早期即给予PPI治疗。当患者病程进展合并严重的食管狭窄致吞咽困难时,可行内镜下扩张治疗。而对于是否需使用糖皮质激素目前尚无定论。本例患者除了给予羟氯喹、硫唑嘌呤、白芍总苷等免疫调节剂治疗外,同时予以双倍剂量PPI治疗,经随访观察,患者吞咽困难症状明显好转,内镜下食管溃疡基本愈合。
综上所述,SSc起病隐匿,临床表现多样,多系统累及,若发现不及时,可严重影响患者的生活质量和预后。因此,早期诊断和治疗尤为关键。在临床工作中,我们应加强对全身系统性疾病的认识,避免思维局限,同时应仔细询问病史及查体,寻找一切的蛛丝马迹,避免漏诊及误诊,为患者的早期治疗赢得宝贵的时间。
