心脏移植后并发弥漫大B细胞淋巴瘤6例临床分析
2021-08-19商臻明茜吴佳颖袁宏艳肖毅
商臻 明茜 吴佳颖 袁宏艳 肖毅
移植后淋巴组织增殖性疾病(PTLD)为在器官移植患者中因长期免疫抑制引起的一组由淋巴系统增生性到肿瘤性的异质性疾病,其发病率约为2%~6%,死亡率为50%~70%[1]。其中,弥漫大B细胞淋巴瘤(DLBCL)是PTLD中恶性程度较高的一种疾病,也最常见,其发生与移植后患者免疫抑制剂使用和病毒感染有明显关系[2]。该类疾病虽然病理类型一致,但异质性较大,其预后及治疗结局也不尽相同。本文通过报道本院收治的2例心脏移植后并发DLBCL的患者临床资料,并综合分析文献共6例心脏移植合并DLBCL的患者,讨论该类疾病的病因、临床特征、治疗及预防方法。
资料与方法
1.资料:收集我院2例心脏移植后并发DLBCL患者的临床资料;以“心脏移植”、“弥漫大B细胞淋巴瘤”、“移植后淋巴组织增殖性疾病”为检索词,查询年限为1990~2020年,通过查阅原始文献,获取临床病例资料进行分析。纳入标准:(1)诊断为心脏移植后合并DLBCL;(2)均来自中国内地及中国香港地区;(3)研究文献类型为涉及心脏移植后并发DLBCL的病例报告、病例或疗效分析研究。排除标准:重复文献及资料不完整病例。
2.方法:提取患者的性别、年龄、移植后发生PTLD的时间、临床表现、发病部位、症状、治疗方法、生存时间等病史资料进行分析。
3.统计学处理:计数资料以例表示。
结 果
1.本院2例患者临床资料:病例1,男,66岁,既往史:高血压病史20余年,口服络活喜治疗,否认病毒性肝炎、结核、血吸虫等传染病史,无食物、药物过敏史。患者于2005年因“扩张性心肌病”行心脏移植手术,术后口服骁悉1 g每12小时1次、环孢素胶囊100 mg每12小时1次;术后第7年因声音嘶哑发现右侧甲状腺肿物,行甲状腺肿物切除术,术后病理组织检查结果示:右侧甲状腺非霍奇金淋巴瘤,DLBCL(生发中心细胞来源)。遂减停免疫抑制剂,间断放疗后症状缓解。2018年10月患者出现全身淋巴结肿大,无发热,无明显消瘦等症状,血常规、肝肾功能、凝血常规、C反应蛋白,乳酸脱氢酶检查结果均在正常范围内。外周血单个核细胞EB病毒DNA 3.80×103copies/ml。腹股沟区淋巴结病理组织活检结果:DLBCL生发中心型(图1),CD20(+),CD10(+),BCL-2(约70%+),BCL-6(约50%+),C-myc(约50%+),Mum-1(+),Ki-67 LI约80%,原位杂交(EBER)(+)。正电子发射计算机断层现象(PET-CT)检查结果示:全身多发淋巴结(左腮腺区、双侧腋窝、纵隔左侧椎旁、腹膜后、双侧盆壁、右侧腹股沟区)代谢增高,考虑淋巴瘤复发(图2)。后给予患者375 mg/m2利妥昔单抗4个周期治疗后,症状消失。
病例2,男,45岁,既往史:否认肝炎、结核、血吸虫等传染病史,无食物及药物过敏史。患者因“扩张型心肌病终末期”于2012年行心脏移植,口服FK506 1.0 mg每12小时1次。2019年7月患者出现持续高热(39~40 ℃),乳酸脱氢酶及尿酸明显增高,外周血单个核细胞EB病毒DNA(-),血浆EB病毒DNA(-)。PET-CT检查结果提示胃底增厚并摄取增强(1.64×0.85 cm/SUVmax=9.19)。胃底部组织病理活检结果:PTLD,DLBCL生发中心型,CD20(+),C-myc(约70%+),BCL-6(+),CD10(+),Mum-1(-),EBER(-)。心内膜组织病理活检结果:无急性细胞排斥反应的证据。遂停用FK506,换用依维莫司0.75 mg每日2次,给于含R-CHOP方案多次化疗共10次,疾病进展,2020年9月患者全身疼痛加重,骨髓流式细胞学检查结果:0.04%细胞(占有核细胞)CD19(+),CD22(+),CD10(+),CD20(-),Ki-67 LI(66%),考虑DLBCL(图3)。给于伊布替尼(BTK抑制剂)560 mg每日1次治疗无效,于当年10月死亡。
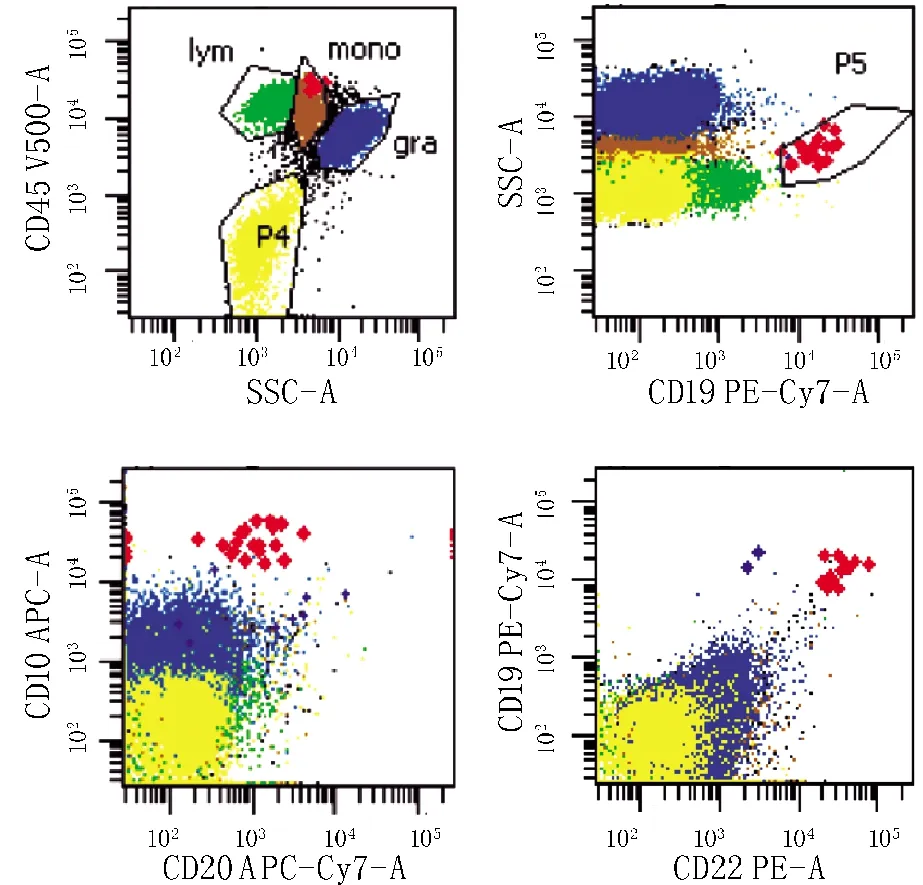
图3 患者2的骨髓流式细胞学检查结果:0.04%细胞(占有核细胞)CD19(+),CD22(+),CD10(+),CD20(-),考虑DLBCL
2.6例患者的临床资料:纳入3篇文献[3-5],共4例患者,包括本中心病例2例共6例进行分析,均为男性,确诊PTLD时年龄为38~66岁。从心脏移植后到DLBCL发生的时间为17个月~10年,淋巴瘤发病部位不尽相同,1例初发时在甲状腺,复发时在全身多发淋巴结;1例在胃肠道及肠系膜淋巴结,2例在颈部淋巴结,2例在中枢神经系统。其临床症状分别为声嘶、淋巴结肿大、头疼、嗜睡。2例EB病毒为阳性,2例为阴性,2例无对应的统计资料。抗排斥反应使用药物各不相同,其中4例以环孢素为主,2例以他克莫司为主。见表1。
3.6例患者的诊疗过程及预后:发病后,6例患者均采用减停或更换免疫抑制剂的治疗措施。除此而外,其余处理措施不尽相同。1例患者采用了手术切除及局部放疗后缓解7年,复发后给于CD20单抗治疗4个周期后缓解;2例患者给予CD20单抗±低剂量的CHOP方案化疗8个周期,症状缓解。以上3例患者预后均较好,生存时间为2~10年;其中1例患者淋巴瘤发生在胃肠道,起病急,全身B症状重,虽给予更换免疫抑制剂、含CD20单抗的多线化疗、布鲁顿氏络氨酸激酶(BTK)抑制剂,但病情持续进展。还有3例患者淋巴瘤发生在中枢神经系统,其中1例给予放疗治疗后,病情持续进展;还有1例减少免疫抑制剂用量出现排斥反应后死亡。这3例患者预后均较差,生存时间为2个月~1年。见表1。
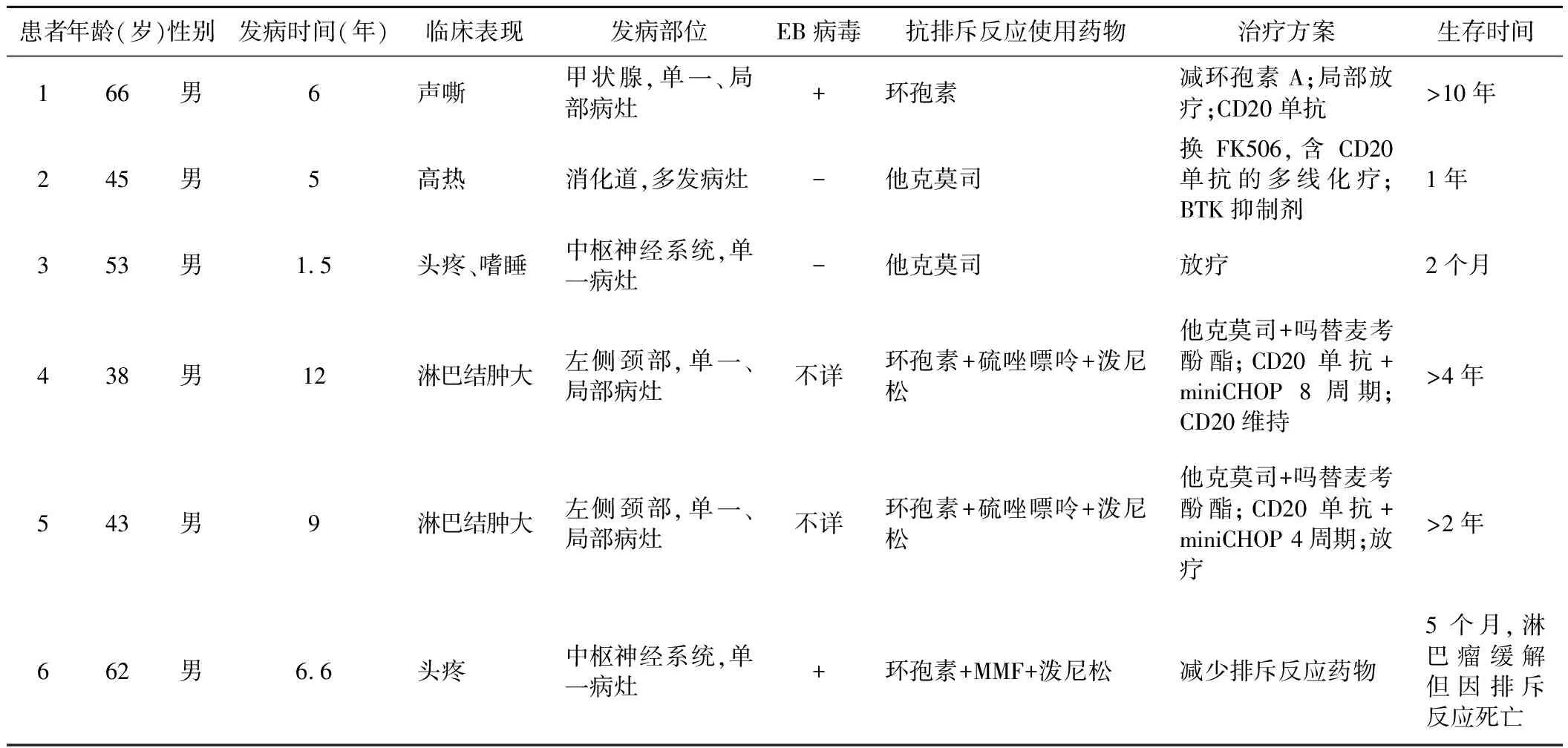
表1 纳入分析患者的临床特征及诊疗过程
讨 论
影响移植后PTLD发生的因素包括移植器官的类型、免疫抑制的强度/类型、供体/受体组织相容性、患者年龄、预防性抗病毒治疗、病毒感染、药物诱导和遗传因素。慢性EB病毒(EBV)感染存在于超过80%的B淋巴细胞增殖性疾病中[6]。在生物信息学分析中发生,EBV(-)PTLD相关的DLBCL和非PTLD相关的DLBCL似乎是相似的生物实体,并具有比EBV(+)PTLD相关的DLBCL更为复杂的遗传学及分子学特性,因此,EBV(-)PTLD相关的DLBCL可能被认为是一种淋巴瘤,只是恰好发生在移植受者身上[7]。EBV(+)/(-)PTLD DLBCL的预后在不同文献中存在争议,较早的国际多中心临床实验数据证实两者预后差异无统计学意义[8]。
PTLD的临床特征与其发病部位、疾病进展程度有关,一般主要为发热、盗汗、淋巴结肿大等症状。使用环孢素或他克莫司的患者,其首发症状多为骨髓、肝、肺和消化道的淋巴结肿大,而使用硫唑嘌呤更易出现中枢系统淋巴瘤[4]。本文纳入的6例患者中并没有观察到这一现象,但发生在浅表淋巴结的3例患者预后相对较好,发生在消化道、中枢神经系统等的3例患者预后较差,推测该类疾病的发病部位可能与临床预后有一定的联系。
减少免疫抑制、化疗、手术切除、抗病毒治疗和放疗是PTLD主要治疗方法。Paya等[9]建议减少或去除免疫抑制剂使用在EBV诱导的PTLD中有23%~50%的消退率,其原因可能是减轻免疫抑制可能激活T细胞进而针对EBV表达的淋巴瘤。利妥昔单抗和降低免疫抑制是目前预防性干预和靶向治疗的一线选择,除非患者患有严重的移植物抗宿主病[10]。
针对EBV(+)PTLD的特异性治疗方法有过继T细胞治疗、抗病毒治疗和免疫调节剂。EBV特异性细胞毒性T淋巴细胞或供者淋巴细胞输注在减少免疫抑制剂和利妥昔单抗使用后应答不佳的情况下具有较好的应答效果。抗病毒药物西多福韦在体外对包括EBV在内的不同双链DNA病毒显示出显著的抗病毒活性。免疫调节药物如来那度胺或蛋白酶体抑制剂,尤其是硼替佐米,可以导致EBV裂解激活[11]。
对于使用以上方法控制不佳的EBV(+)患者或对于EBV(-)患者,R-CHOP方案化疗是DLBCL的首选治疗方法,二线化疗方案如R-DHAP或R-DAEPOCH也可考虑[2]。对于以上方法治疗均无效的患者,可考虑使用BTK抑制剂等分子靶向药物[7]。嵌合抗原受体T细胞疗法(CAR-T)也被应用于复发难治的PTLD 患者中,并获得缓解[12-13]。
当患者存在T细胞耗竭治疗(长期使用免疫抑制剂)时应采用积极的策略,包括:(1)每周监测血浆或外周血单个核细胞EB病毒DNA;(2)如果EB DNA>1 000 copies/ml,可以考虑提前减少免疫抑制剂的使用,同时给与利妥昔单抗治疗。较多证据表明,预防性使用利妥昔单抗是治疗PTLD的一种可行且安全的策略[14]。
本文纳入分析的6例患者病理诊断相同但异质性较大,针对病灶单一、全身症状轻且进展较慢的患者,减停免疫抑制剂、抗病毒治疗、局部治疗方法(如小剂量化疗或局部放疗)可获得较好的生存期;对于多发病灶、全身症状重且疾病进展快的患者,除以上方案外,应用含CD20靶向药物的化疗方案,BTK抑制剂或细胞免疫治疗如CAR-T治疗作为挽救性治疗。
