含钙矿物及固废制备碳酸钙晶须的研究进展与思考
2021-08-18胡攀古卫乐田键朱艳超汤钒刘旻徐逸凡操未青
胡攀, 古卫乐, 田键,4,5*, 朱艳超, 汤钒, 刘旻, 徐逸凡, 操未青
1.湖北大学 材料科学与工程学院,湖北 武汉 430062; 2.功能材料绿色制备与应用教育部重点实验室,湖北 武汉 430062; 3.工业废弃物绿色产业化应用技术湖北省工程研究中心,湖北 武汉 430062; 4.玉林师范学院碳酸钙产业发展研究院,广西 玉林 537000; 5.湖北湖大天沭新能源材料工业研究设计院有限公司,湖北 武汉 430062
1 引言
碳酸钙有方解石、文石、球霰石三种同质异形体如图1所示,其中方解石和文石都是天然碳酸钙中较为常见的矿物晶型,文石是柱状或是纤维状,热力学上是亚稳态的,常常会随着环境条件的变化而转变为方解石。在常温常压下会以107年至108年的时间尺度转化为方解石。在干燥空气中加热时,在约400 ℃时开始转化为方解石[1-4]。

图1 多种晶型的碳酸钙
方解型碳酸钙形貌繁多有棒状、片状、层状等,而球霰石型碳酸钙多为球状,常用于吸附材料中,碳酸钙晶须属文石型碳酸钙,晶体结构完整,呈纤维状,内部缺陷少,硬度高、模量大,常被作为填充剂、增韧剂、增白剂应用在各个领域[5-6]。与其他钙基材料相比碳酸钙晶须对聚丙烯(PP)材料弯曲强度、冲击强度的增强效果明显优于普通轻钙[7];天然橡胶(NR)经改性碳酸钙晶须复合后,损耗因子降低,热稳定性提高,拉伸强度和抗撕裂强度都明显得到提升[8];造纸上碳酸钙晶须能赋予纸张更加良好的印刷性[9-10],更高的强度和更好的留着率;其他钙基材料在加入水性涂料,黏结强度及触变性增强效果与碳酸钙晶须相比明显不足[11-12]。
碳酸钙晶须作为一种新型的廉价晶须材料,将来有望取代成本高昂的碳化硅、硼酸铝、钛酸钾等晶须。但碳酸钙晶须制备条件通常较苛刻[13-14],工艺不成熟、装备要求高。因此低能耗、高效率、绿色环保型制备工艺是目前碳酸钙晶须制备的研究重点。本文综述对比了碳酸钙晶须制备方法的优缺点,并侧重论述了含钙矿物(方解石、大理石等)及固废材料(工业废弃物、生活废弃物)生产制备碳酸钙晶须的应用研究进展。
2 碳酸钙晶须的制备研究进展
经过长时间的发展与研究,现今碳酸钙晶须的制备方法主要包括碳化法、复分解法、尿素水解法、碳酸氢钙分解法、溶胶-凝胶法及超重力法等。制备方法对照特点见表1。
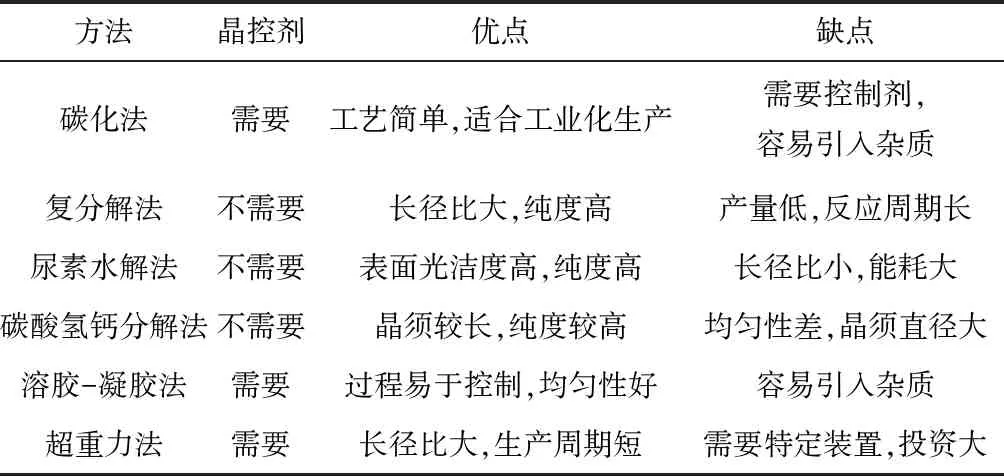
表1 碳酸钙晶须制备方法对比结果
目前在大规模工业生产中主要以碳化法为主,其他制备方法由于受制于许多复杂因素的影响,仍处于实验室研究阶段。
2.1 碳化法
碳化法是工业化生产碳酸钙晶须最常用的制备方法。同制备轻质碳酸钙方法类似,含钙矿石经过煅烧—消化—碳化过程后得到产品。碳化过程需要针状碳酸钙晶种、镁盐或磷酸盐等晶控剂来调控晶须的定向结晶生长[15]。
陈华雄[16]采用碳化法在Ca(OH)2-CO2-MgCl2体系中合成了碳酸钙晶须。研究发现,控制反应pH在8.5左右,并连续加入精制Ca(OH)2浆液,可以合成长度为30~28 μm、长径比为25~29的碳酸钙晶须。李庆蕾[17]同样将MgCl2作为晶控剂,且通过改善CO2在体系中的分散性,并在反应后期补加一定量Ca(OH)2悬浮液,将碳酸钙晶须的纯度提高到99.5%。进一步探究发现母液在循环使用12次后,晶须纯度仍能高达96%,长径比为15~20,晶控剂的利用率也大大提升。
碳化法制备工艺简单,且过程易于控制。在大型工业化生产中要注意两个方面:一方面要注意调控CO2的通气速率及其在浆液中的分散情况,避免局部饱和度过高而产生方解石和碳酸镁钙杂质;另一方面,碳化法生产过程中使用的晶控剂回收利用也是亟待解决的问题。
2.2 复分解法
复分解法多用于实验室制备,原料具有多样性,通过利用较低浓度的可溶性钙盐和碳酸盐在较高温度下反应生成碳酸钙晶须。
早在1957年,John[18]团队就利用向CaCl2溶液中滴加Na2CO3的方法,在温度为80~90 ℃、pH为6~8的条件下制得长为10~43 μm、长径比为15~35的碳酸钙晶须。
Lee[19]以Ca(OH)2作为钙源、Na2CO3作为碳源,亚氨基二乙酸作为诱导剂,研究了在低温(50 ℃)下碳酸钙晶须生长机理,探究发现,反应初期Ca2+会与亚氨基二乙酸络合为有机模板来诱导取向为(012)的针状文石形成。
复分解法工艺简便环保,晶须长径比相对较大,表面光洁度较好,纯度较高。但产量低,反应周期较长。此外制备时需要明确保障CaCl2浓度不能过高,否则将导致体系中Ca2+局部浓度过高,结晶的推动力增大,容易形成稳定的方解石型晶体,而不是向文石型晶体转变。
2.3 尿素水解法
尿素水解法是利用尿素水解过程中产生的CO2和可溶性钙盐进行碳化反应来制备碳酸钙晶须。反应过程如式(1)~(3):
(NH2)2CO(aq)+3H2O→2NH4OH(aq)+CO2(aq)
(1)
NH4OH(aq)→NH4+(aq)+OH-(aq)
(2)
Ca2+(aq)+CO2+2OH-(aq)→CaCO3(s)+H2O
(3)
体系中的CO2是由尿素水解得到,该法制备关键在于通过调控反应的条件(温度、压力等)来严格控制尿素的水解速率,提供晶须过饱和度较低的成核生长环境。
Wang[20]制备过程中发现,当CaCl2浓度为0.25 mol/L、尿素浓度为0.25~2.25 mol/L、反应温度为70~90 ℃时可制得长度为45 μm、长径比为10的针状文石型碳酸钙,且随着尿素含量增加,长度会有所减小。清华大学向兰[21]团队采用双注法,将摩尔比为1:1 的CaCl2和NH4Cl同时加入反应器中在80 ℃下反应得到文石型碳酸钙。
尿素水解法在制备碳酸钙晶须时,无需添加任何晶种和控制剂,可以避免引入杂质离子,产品纯度较高。但尿素水解速率难以把控,且能耗较高,导致利用该法进行工业化生产受到限制。
2.4 碳酸氢钙分解法
碳酸氢钙微溶于水,当外界温度和压力发生变化时,碳酸氢钙会变成碳酸钙析出。同碳酸盐岩地区洞穴中形成的钟乳石一样。是由含大量碳酸氢钙的地下水,在合适的压强和温度下,分解出CaCO3、H2O和CO2,附着在洞顶,慢慢沉淀,长久以往形成钟乳石[22-23]。
荒井康夫[24]基于此法将纯度为97.5%的石灰石溶于水中,然后通入CO2,通过调控反应温度、时间和搅拌速度,得到长径比约为35、纯度高达99.7%的碳酸钙晶须。
为缩短反应时间,提高产率,R.D.Chebotareva[25]预先对碳酸氢钙溶液进行磁处理,再用惰性气体吹扫或长时间煮沸除去溶液中过量CO2后,得到了文石型碳酸钙。研究证明磁处理有利于碳酸钙定向结晶,且CO2脱出扰乱了水的空间结构,溶液处于亚稳态,对磁场的作用更加敏感。这种辅以磁处理制得的晶须较长,纯度较高,但晶须尺寸范围分布较宽,整体均匀性很差,直径较大。
碳酸氢钙分解法需要高温反应条件,且对装备精密度要求较高。在晶须成核生长过程中辅助给予一定的外部条件(磁处理、微波照射),降低反应周期及温度,缩减生产成本,是目前研究的主要方向。
2.5 溶胶-凝胶法
溶胶-凝胶法是以无机盐或金属盐为前驱体,经水解缩聚后逐渐胶凝化,再经过高温热处理制备目标产品的方法[26]。
国内最早由韩志华、曹林[27]使用溶胶-凝胶法合成文石型碳酸钙,谢元彦[28]基于此法系统探究了温度、浓度、催化剂、介质、搅拌速率等试验条件对碳酸钙晶须形貌的影响。并通过控制试验条件在水浴温度80 ℃、搅拌速度150 r/min、热处理温度700 ℃及保温2 h条件下,合成了长约4 μm、直径为100~150 nm的碳酸钙晶须。
溶胶凝胶法制备工艺简单,设备价格低廉,反应过程易于控制,并且得到产品组分均匀,成纤性能好。但原料价格较高,热处理能耗较大,且生产过程中会产生有毒物质,严重污染环境。
2.6 超重力法
超重力反应结晶法是一种新兴的碳酸钙晶须制备方法。在高重力环境下合成的颗粒粒径分布窄,微混合和传质强化过程可以加速晶须生长过程[29]。
陈建峰[30]以Ca(OH)2和CO2为原料,H3PO4为晶控剂,在高重力环境下合成了平均直径为0.4~0.6 μm,长径比为10~15的碳酸钙晶须。相较其他方法将制备时间缩短了2/3。
Chao[31]等人采用高剪切混合器(HSM)调节反应微混合环境,通过优化HSM转子转速、反应温度和CO2流量分别为1.0×104r/min、83 ℃和200 mL/min,并以磷酸作为晶型控制剂,在HSM辅助结晶器中生成结晶纯度为98.1%、平均宽度直径为50 nm的碳酸钙晶须。
超重力法生产成本低、周期短且产品纯度较高。但设备的前期投资较大,产率较低,不适合进行大规模推广应用[32]。开发新的生产设备,简化制备流程,将成为超重力法在晶须制备上应用研究的新方向。
3 多样性原料制备碳酸钙晶须研究进展
原料是对碳酸钙晶须产品成本及性能最主要的影响因素之一,而大规模工业生产通常以高钙含量的大理石、方解石、石灰岩及白云石等工业矿石为主要原料。随着“十四五”生态文明建设的新使命,“绿水青山”理念及“低碳经济”等发展理念进一步深入人心,利用高钙含量的工业废弃物和生活废弃物等进行资源化回收利用制备碳酸钙晶须也逐渐引起学者的关注。
3.1 矿石原料制备碳酸钙晶须
方解石晶体属三方晶系的碳酸盐矿物,在地球上分布广泛,主要存在于大理石和石灰石中,是天然碳酸钙中最常见的矿石晶体,同时也是目前制备碳酸钙晶须中使用最多的原料。具体的制备工艺流程如图2所示。
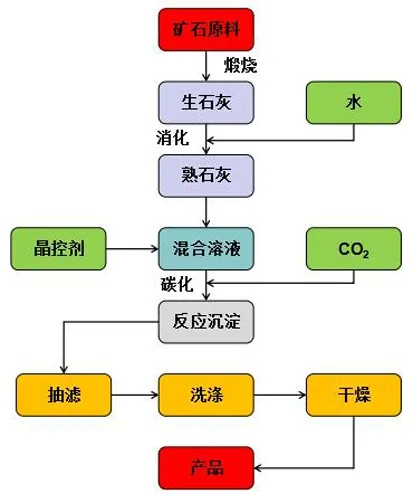
图2 含钙矿石制备晶须工艺流程
裴冰野[33]选用方解石矿物(CaCO3)为原料,经过高温煅烧后,分别采用一步碳化法和气-液间歇碳化法来制备碳酸钙晶须。最佳试验参数见表2。
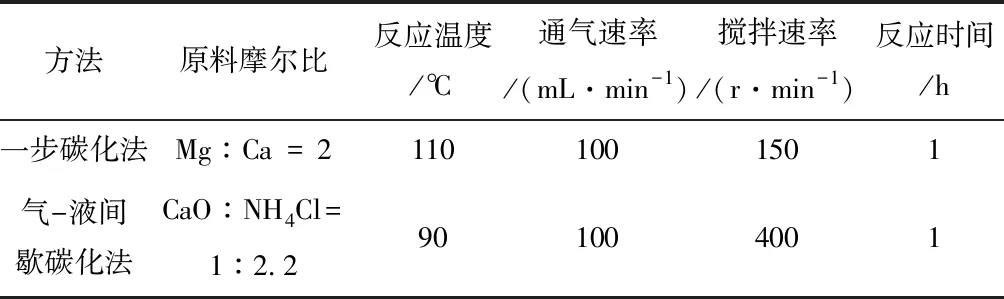
表2 一步碳化法和气-液间歇碳化法制备最佳参数
对比采用一步碳化法和气-液间歇碳化法来制备碳酸钙晶须,前者所得晶须直径为1~4 μm,长度为15~30 μm,后者的长径比为10左右。
李会杰[34]以白云石为原料,采用气液间歇碳化法,在850 ℃下煅烧4 h后控制反应温度80 ℃,搅拌速度400 r/min,二氧化碳通气速率100 mL/min反应,得到的产品中晶须含量为92.7%,长径比为23。而西南科技大学罗东山[35]以大理石矿石为原料,对比了一步碳化法和气液间歇法制备碳酸钙晶须。证明间歇法有利于促进文石晶体长度和直径的增大,能够得到尺寸更大的文石晶体,长度最大可达90 μm,粗部直径为7~9 μm,长径比为10,产品种晶须含量最高可达91%。
除了上述的几种主含CaCO3的矿石原料外,还有诸如菱镁矿(MgCO3)、菱锶矿(SrCO3)、白铅矿(PbCO3)等碳酸盐矿物,都可作为碳酸钙晶须制备的矿石原料。
3.2 工业废弃物制备碳酸钙晶须
在过去的几十年中,我国大力发展工业,经济突飞猛进。但是随着工业快速发展,其对环境造成的影响,雾霾严重,水土富营养化,温室效应造成冰川融化,海平面升高等问题日益突出。对人类未来的发展提出了考验[36]。如果能够将造成污染的废渣、废水、废气等放错位置的资源变废为宝,循环利用,不仅解决了日趋严峻的环境问题,而且大大降低了生产成本。
3.2.1 工业废渣
目前在钙含量高的大宗固废主要有钢渣、工业副产石膏、电石渣和粉煤灰等。钢渣是炼钢业在炼钢过程中,形成大量的似岩石的固体碱性副产物,其成分主要为硅酸盐和氧化物,氧化钙含量为40%~60%,可作为碳酸钙晶须良好的原料[37]。Mattila[38]基于氨水对钢渣中的钙组分晶型提取,而后经过碳化制备多晶型沉淀碳酸钙,通过改变[Ca2+]/[CO32-]值及反应体系的pH值,在40~50 ℃以上的温度及较长的沉淀时间下制得碳酸钙晶须。
工业副产石膏目前主要有磷酸生产的过程中产生的磷石膏和烟气脱硫净化产生的脱硫石膏。郑州大学刘咏[39]以磷石膏为钙源,进一步通过HCl浸取、NH3·H2O除杂得到精制CaCl2原料,并以碳化法成功制备出文石型碳酸钙晶须。Song[40]进行了脱硫石膏碳酸化生产不同晶型碳酸钙的研究,通过控制反应温度、时间、添加剂和搅拌速率等条件参数,得到了文石型、方解石型、球霰石型碳酸钙,试验过程中发现当加入30%~50%乙醇时,球霰石型碳酸钙完全向文石型转变。
主要成分为Ca(OH)2的电石渣是氯碱厂生产乙炔过程中排放的碱性工业废物,近年来这种废物的排放量巨大并呈现逐年增加的趋势[41],其大量堆存给环境带来了巨大的危害。由于其高钙含量,贵州大学曹建新[42]团队以其原料,以Na2CO3为碳源,经过酸洗后pH=8的电石渣可以在温度为80 ℃、搅拌速度为450 r/min、滴加速度为2 mL/min的反应条件下通过复分解法合成了最大长径比30~60文石型碳酸钙晶须。
传统的燃煤发电厂会产生多种废物流,包括固体废物粉煤灰、高盐废水(盐水)和烟气。为了最大限度地减少废物排放和对环境的影响,目前主要应用固体、液体和气体废物的分离处理技术实现固液气的分离,但处理成本很高,特别是对CO2的控制排放时过程。Lu[43]等利用电解碳化的方法,首先盐水废水电解产生的酸性溶解释放位于阳极的粉煤灰中的Ca2+,随后Ca2+在阴极处结合OH-生成Ca(OH)2,同时向溶液中通入CO2,产生CaCO3沉淀。基于上述研究,在通过调控体系中的通气速率及提供一定的搅拌速率和控制剂的情况下,预期可以得到碳酸钙晶须和其他晶型的碳酸盐产物。
双氰胺废渣是生产双氰胺过程中产生的副产物,其中CaCO3和Ca(OH)2的含量为29%~37%[44]。长久以来,这些废渣都采用堆置或掩埋的处置方式,占用土地,造成严重的环境污染,同时又浪费了资源。宁夏大学赵海鹏[45]进行了双氰胺废渣制备碳酸钙晶须同时联产氯化铵的工艺探究,利用蒸馏水将双氰胺废渣进行溶解,然后在30 ℃、搅拌速度为300 r/min的条件下,经10%HCl溶解反应10 min,随后抽滤加浓氨水除去杂质离子,得到精制CaCl2溶液。最后采用复分解法,将配好的浓度为0.25 mol/L的CaCl2和0.75 mol/L的NH4HCO3溶液同时滴入反应器中进行反应,80 ℃搅拌反应80 min后过滤、洗涤、烘干可得到碳酸钙晶须产品。
3.2.2 工业废水
采矿废水通常含有大量的无机钙盐,这些卤水主要来自地下咸水层,通过油气储层被带到地表,是石油开采过程的重要废弃物。
Zhang[46]向含锂卤水中加入浓度为1.7 mol/L的碳酸钠,并在搅拌速度为300 r/min,温度为30 ℃的条件下沉淀得到了方解石型、文石型及球霰石型碳酸钙。同时通过探究碳酸钙结晶过程和晶型转化过程中溶液的试验条件的变化,实现了溶液中钙离子的有效去除和锂离子的有效回收,回收率可达97.53%。
3.2.3 工业废气
工业废气主要是利用烟气中的二氧化碳为原料作为碳酸钙晶须碳化过程的原料气。从烟气中捕获二氧化碳进行利用可减少二氧化碳的排放,并且进行矿物碳酸化将CO2作为矿物碳酸盐进行螯合,具有很好的经济可行性[47-48]。四川大学的刘中清[49]团队以CaSO4悬浮液为原料,引入含CO2和N2的模拟烟气制备碳酸钙晶须,并对晶须生长的影响因素和机理进行了探讨。
李佳乐[50]从处理烟道中CO2的角度出发,基于碳化法制备碳酸钙晶须,利用自然界中丰富的海水为原料,并以氧化镁作为晶型控制剂、十二烷基苯磺酸钠(SDBS)作为表面活性剂。通过调控碳化过程,在固定烟道气中CO2的同时连续产出高纯的碳酸钙晶须。这为解决海水淡化过程中的钙结垢问题及工业生产中CO2排放问题提供了新思路。
3.3 生活废弃物制备碳酸钙晶须
碳酸钙不仅广泛地存在于天然矿石中,它还是人体、动物骨头及大自然生物中贝类、壳类的主要成分[51]。据估计,全世界每年产生超过25万t废弃蛋壳。并且根据联合国粮食及农业组织(2016年)数据显示,中国是双壳贝类的主要生产国(>1000万t)[52]。丢弃在环境中的贝类、壳类废弃物上残留的蛋液及附着的肉残渣会被微生物分解,而引起疟疾、登革热等疾病的产生,将严重危害环境[53-55]。
蛋壳的主要成分[56]是碳酸钙(94%)、有机物(4%)、磷酸钙(1%)和碳酸镁(1%)。Habte[57]等利用废弃的双壳贝类和鸡蛋壳为原料,采用碳化法,以MgCl2·6H2O为晶型控制剂,在80 ℃的温度下成功合成了平均晶体尺寸为10~30 μm、最佳长径比为21的碳酸钙晶须。具体制备流程如图3所示。
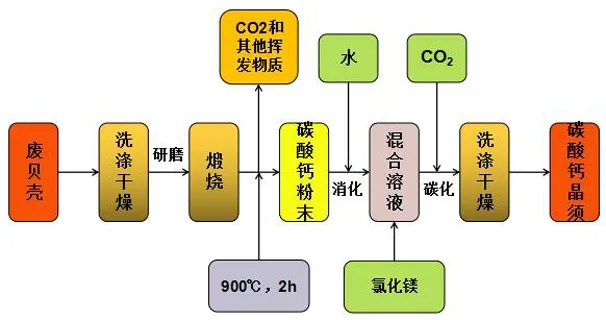
图3 废弃贝壳制备晶须工艺流程
此项研究扩展了贝类、壳类废弃物的高附加值再利用思路,同时探索了碳酸钙晶须作为重金属离子的吸附剂、药物载体可行性。
3.4 小结
制备碳酸钙晶须的原料众多,其中矿石原料来源广泛,能够集中大量开采生产,但是矿石中的杂质离子需要在后续生产过程中分离排除。而利用工业“三废”(废渣、废水、废气)来生产碳酸钙晶须不仅可以降低原料的生产成本,而且可以有效降低对环境的污染,但是由于原料有限,导致产率与矿石原料制备来说明显降低。目前研究较少的生活废弃物制备碳酸钙晶须的难点在于,废弃的贝壳、蛋壳难以集中回收运输,但这种天然生物钙原料,反应过程不会产生重金属污染,而且避免了生产过程中造成的环境污染,未来可通过合理的规划原料产地与生产地,降低运输成本,进行大规模生产。
4 结论及展望
碳酸钙晶须独特的晶体结构赋予了其在物理上具有高模量、高强度、耐热和隔热性好等优良性能,能广泛在塑料、橡胶、造纸、涂料、食品、医药、电子等领域应用。目前碳酸钙晶须制备方法众多,其中碳化法因其工艺简单、成本低廉,反应易于控制等优势,成为工业化生产中应用最广泛的制备方法。
根据团队多年来从事碳酸钙材料研究及产业化经验认为碳酸钙晶须材料应从以下几方面来发展:
(1)碳化法制备碳酸钙晶须目前在工业化生产及实验室制备中应用最为广泛。对比其他方法,碳化法工艺简单,能耗低,前段可配套其他钙基产品进行联产,成品长径比大,产率高。
(2)用廉价或废弃高含钙原料替代天然含钙矿物,提高原料的选择性,节约宝贵自然资源,同时实现废弃物的高值利用。
(3)为满足不同方向的应用需求,拓展碳酸钙晶须的应用面。碳酸钙晶须必须走高端化、专一性和功能性,深入研究碳酸钙晶须理化性能与制品性能影响机制,为碳酸钙晶须产品的制备提供需求导向。
(4)更深层次地探究晶须成核生长机理,诸如晶须成核生长驱动力调控、晶须生长微环境变化规律等,为特种功能化碳酸钙晶须制备提供理论指导。
(5)工业化生产碳酸钙晶须应当从较为成熟的钙基产品(轻钙、重钙等)的基础工艺和设备出发,逐步升级改造,提高生产效率,走低能耗、低污染的绿色环保节能工艺路线。
(6)试验制备的碳酸钙晶须相较于天然的文石而言,在强度及热稳定性等力学性能上还有很差的差距,未来模拟地质矿化及生物矿化制备拥有超高性能的碳酸钙晶须将成为碳酸盐生产的重难点。
