指纹光谱病原菌快速检测研究进展与趋势
2021-08-17廖文龙刘坤平胡建平林庆宇段忆翔
廖文龙,刘坤平,胡建平,甘 亚,林庆宇,段忆翔*
1. 成都大学食品与生物工程学院,四川 成都 610106 2. 成都大学四川抗菌素工业研究所,四川 成都 610106 3.四川大学机械工程学院分析仪器研究中心,四川 成都 610064
引 言
水作为人类健康和经济发展的必要条件,不仅能维持动植物生命活动,同时也为许多微生物的生长和繁殖提供天然场所,因此水也成了众多病原微生物的传播媒介之一。随着社会经济不断发展,水资源污染日益严重,饮用水污染已成为全球关注的热点话题,由水源性病原菌引起的疾病已经成为最常见的健康风险之一。除了饮用水,食品安全也是关乎人民健康与国计生民的重大课题,由于细菌广泛存在于水、 空气、 土壤等环境中,其隐蔽性使之容易成为食品加工、 流通、 及供应等环节潜在的生物安全隐患,一旦食品发生病原菌污染则可能引发难以预判的公共卫生事件。此外,随着经济全球化进程的加快,病原菌跨国传播的风险也与日俱增。因此加强病原菌快速检测,保障饮用水和食品安全,应对突发公共卫生事件,已成为各国政府及相关组织所面临的迫切任务。
经过多年的实践和探索,我国已建立了病原菌检测基本体系,现行病原菌检测标准大多是基于形态、 生理、 生化水平的经典方法,以及逐步成熟的分子生物学方法。其中,经典方法虽具权威,但操作繁琐,检测周期长(通常需要3~5 d),面对高时效性和高精密度的市场需求鞭长莫及。分子生物学方法将鉴定水平提升至核酸分子,虽具快速、 特异、 高灵敏的优点,但是检测条件较为苛刻,需要消耗昂贵的生化试剂进行DNA提取、 PCR扩增等复杂前处理,同时容易因核酸污染和死菌造成假阳性结果[1]。因此开发操作简单、 低成本的病原菌快检技术对于保障饮用水和食品安全意义非凡。
激光光谱技术具有非接触式测量、 高灵活性和高测量速度等优点,在过去几十年中得到了快速发展,诞生了包括激光诱导荧光(laser-induced fluorescence, LIF)、 可调谐激光吸收光谱(tunable diode laser absorption spectroscopy, TDLAS)、 激光拉曼光谱(laser Raman spectroscopy, LRS)、 激光诱导击穿光谱(laser-induced breakdown spectroscopy, LIBS)等多种光谱分析技术,并成功地应用于生物医学、 环境保护、 食品安全、 能源化工等领域[2-6]。近年来,随着固体激光器、 电光探测器和信号处理等领域的不断发展,能够快速获取目标物分子和原子指纹信息的LRS和LIBS技术在病原菌快检领域受到了广泛关注,为了进一步探索这些指纹光谱技术在病原菌检测中的应用潜力,对LRS和LIBS在病原菌检测中的优势和局限性进行了综述,并对其在病原菌快速检测领域的发展趋势进行了展望。
1 拉曼光谱
拉曼光谱是基于入射光子与目标分子间发生非弹性碰撞后,光子得到或失去部分能量而散射出不同波长的光,通过光谱仪记录不同波长的散射光,再与标准物质或数据库的光谱信息进行对比,可以得到分子化学键指纹信息(如图1所示)。通过构建目标分子的指纹图库,可实现相应物质的快速识别与定性检测。尽管早在1928年印度物理学家Raman就已经确认了拉曼散射过程的现象和原理[7],但由于拉曼散射效应太弱(散射光强度约为入射光强的10-8),早期以汞灯为光源的拉曼光谱采集往往需要长达数小时甚至数十小时的积分时间,因此在相当长的一段时期内拉曼光谱并没有得到广泛应用。直到1960年红宝石激光器出现后,使用激光作为光源的LRS才使拉曼光谱进入了一个全新的时期,由于激光的单色性好,方向性强,功率密度高,用它作为激发光源大大提高了激发效率,从而成为拉曼光谱的理想光源。随着探测技术的不断改进和对被测样品要求的降低,目前LRS在物理、 化学、 生物、 医药、 环境、 材料工业等各个领域得到了广泛的应用,越来越受研究者的重视。
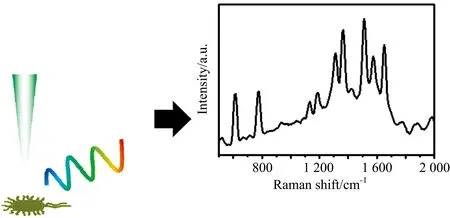
图1 拉曼光谱获取目标物分子指纹光谱信息Fig.1 Fingerprint spectral information of target molecularobtained by Raman spectroscopy
由于LRS可以提供丰富的指纹光谱,具有非侵入式、 无损分析、 制样简单、 样品消耗少、 重现性高以及水相容性等优点,而成为病原菌检测的潜在工具[8]。然而光谱信号弱灵敏度低的固有缺陷使得常规拉曼在生物检测中的应用困难重重,同时拉曼光谱对生物体中复杂的生物分子没有选择性,往往产生大量重叠光谱信号导致不同细菌细胞中特殊成分的光谱信号并不突出,此外LRS往往伴随高强度的荧光背景[9],因此对于细菌检测来说并不是一种灵敏的检测技术。为了降低生物体荧光背景提高拉曼信号的信噪比,20世纪七八十年代研究人员尝试采用紫外共振拉曼光谱(ultraviolet resonance Raman spectroscopy, UVRRS)进行生物分析[10-11],即利用波长接近或等于生物体待测分子中电子的吸收波长的激光作为激发源,比如利用波长在218~242 nm处的激发光与核酸碱基发生共振,波长在244~257 nm处的激光与含苯环的氨基酸发生共振[12],增加待测物电子跃迁几率的同时增加待测分子的散射截面,从而达到降低荧光背景增强待测物拉曼信号的目的。然而大多数细菌都含有相同的核酸碱基以及含苯环的氨基酸,因此共振Raman光谱具有较高相似性。尽管Nelson等[13]的研究表明由于不同种类的细菌细胞中生物分子的丰度存在差异,可以通过UVRSR的绝对强度和峰值强度比值的差异进行鉴别,但由于UVRRS对细菌其余化学物质的响应微弱导致选择性不高,同时UVRRS使用的紫外波段激光对细菌细胞和生物分子具有严重的光化学损伤作用,因此其实用性大打折扣。
尽管UVRRS在细菌检测中的应用未能得到较明显的发展,但幸运的是1974年Fleischmann等发现粗糙电极能使吡啶拉曼信号增强的现象[14],揭开了表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)研究的序幕。表面增强拉曼光谱(SERS)是在常规Raman光谱中引入贵金属(如Au,Ag,Cu 等)纳米粒子作为活性基底,利用其局域表面等离激元共振(LSPR)效应,将入射光场能量局域到纳米粒子表面,增强周围局部电场形成“热点”,当待测物靠近“热点”后通过电磁和化学增强机制实现Raman信号大幅提升,从而能够快速获取目标物的指纹光谱信息[15]。SERS除具有常规Raman光谱的特点外,还表现出荧光淬灭的优点,这些优势使得SERS在生命分析、 环境检测、 食品安全等众多领域广受关注。
2004年Jarvis等将SERS技术用于细菌鉴别[16],与普通Raman光谱实验相比,SERS提供的高灵敏度可以使采集时间从几分钟缩短至几秒钟,因此成为细菌检测的理想方法。由于SERS信号受“热点”效应影响显著,通常只有当贵金属纳米粒子间隙小于10 nm 时才会产生显著的“热点”[17],因此在采用SERS进行细菌检测时,贵金属纳米粒子(通常为银纳米粒子(AgNPs)或金纳米粒子(AuNPs))与细菌细胞间的靠近程度十分关键。为了使纳米粒子与细菌细胞紧密接触,研究者通常将细菌与银或金溶胶混合后再通过无机盐诱导聚集使纳米粒子与细菌细胞紧密结合[18],然而这种方法无法保证纳米粒子在细菌细胞上均匀分布,因此SERS光谱的重现性和稳定性较差。研究显示在细菌细胞原位合成Ag NPs,能够在一定程度上确保纳米粒子与细菌细胞接触更加均匀与紧密,从而提高Raman光谱的稳定性和重现性[19],然而原位合成需要将细菌浸入高浓度的硝酸银或还原剂溶液中,容易造成细菌细胞破损而影响检测结果的准确性[20]。随着纳米技术的快速发展,研究人员通过制备有序纳米阵列,或是具有特征拉曼信号的SERS 标签,开发了一系列基于标记和无标记SERS方法进行病原菌检测[21-23],然而这些阵列基底或SERS标签制备过程太过复杂,成本较高且难以大规模制备。因此到目前为止,受金属纳米粒子的材质、 形貌、 大小等自身属性,以及与待测物距离等多种因素的影响,重现性仍然是SERS 实际应用的一大瓶颈[24]。
近年来,研究人员不断探索创新共克难关,多种改进型SERS 技术为解决重现性问题带来了新的曙光,如壳层隔绝纳米粒子增强拉曼光谱(shell-isolated-nanoparticle enhanced Raman spectroscopy, SHINERS)[25-26],动态表面增强拉曼光谱(dynamic-SERS, D-SERS)[27-28],以及液相界面拉曼分析技术等[29-30],进一步推动了SERS在食品安全、 环境监测等领域的应用。其中,D-SERS在样品从湿态到干态的转变过程中进行光谱采集[31],利用湿态样品液体挥发时的毛细力、 静电力或化学螯合作用等,驱动纳米结构相互靠近并聚集,使样品经历一个“无热点—最佳热点—热点消失”的动态过程(如图2所示)。相对于干态或湿态SERS而言,D-SERS由于能够形成高效均匀的“热点”,因此具有更高的灵敏度和重现性。在细菌SERS检测中,湿态样品虽然可以在一定程度保护细菌细胞免受激光损伤,但是却难以保证细菌与纳米结构有效接触,因此已报道的细菌SERS检测以干态居多,而干态下细菌受纳米结构与激光双重作用,难以避免光热降解等损伤,同时干态SERS“热点”难以控制,因此干态SERS检测可靠性无法保证。D-SERS对于细菌检测来说正好结合了湿态和干态SERS的优点,在样品干湿转换过程中完成检测,既可以避免细菌受到激光损伤,又能够保证纳米粒子与细菌细胞结合紧密形成高效“热点”,为提供可靠的SERS分析奠定了良好的基础。
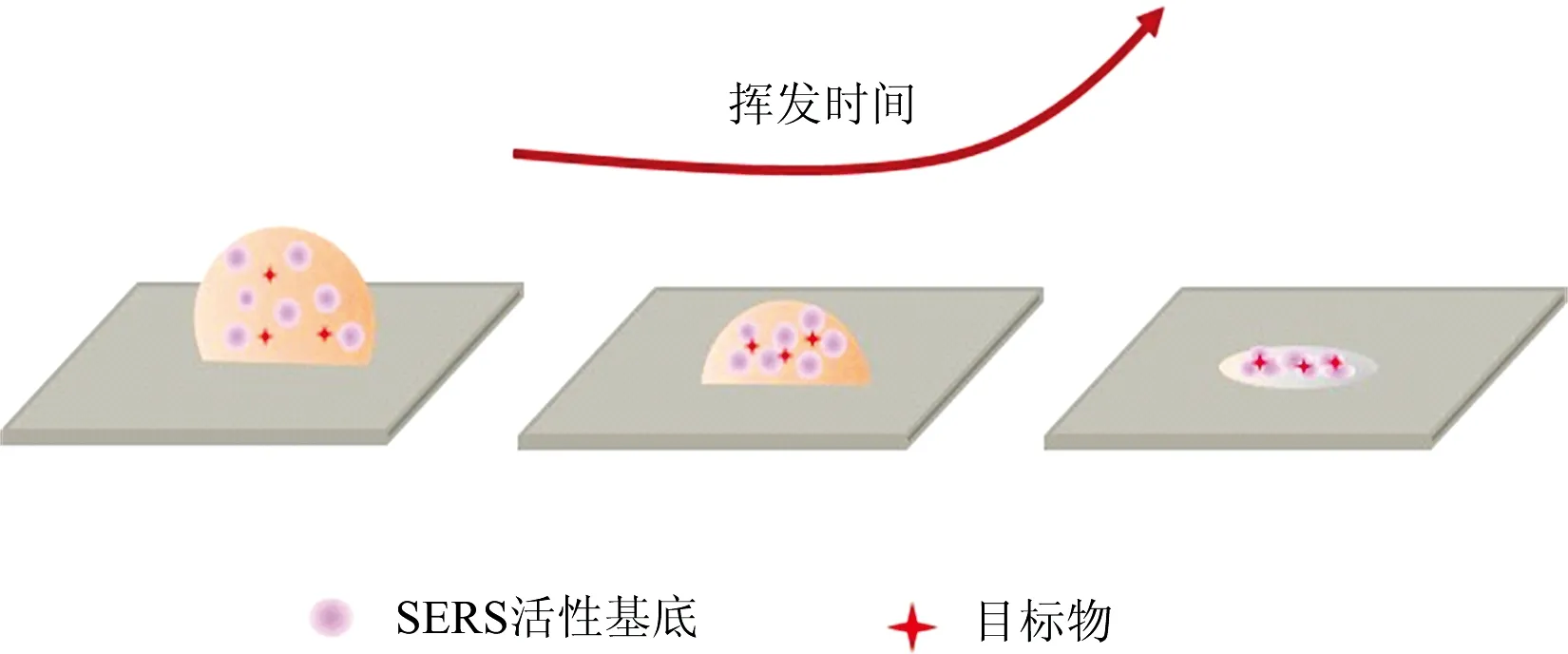
图2 D-SERS热点形成过程示意图Fig.2 A schematic diagram of D-SERShot-spot formation process
目前,D-SERS在细菌检测领域的研究报道尚处于初始探索阶段,检测对象主要集中在基质较为简单的水样或实验室模拟样品。例如Zhou等[32]针对饮用水中病原菌的快速检测,在含细菌的水中原位合成Ag NPs,利用D-SERS结合层次聚类分析鉴别了饮用水中大肠杆菌和表皮葡萄球菌; 第二军医大学李皓博士[33]针对临床真菌感染的诊断治疗难题,利用D-SERS对耐药白色念珠菌进行了快速诊断和药物筛选研究。这些研究进一步证明D-SERS相对传统SERS具有更高灵敏度和重现性。但是在面临实际样品检测时还需考虑诸多因素,实际样品基质成分比较复杂,而且细菌种类多浓度低,因此利用D-SERS进行检测时需要对目标菌进行高效分离富集,以降低基质和共存菌干扰,同时D-SERS是一个动态变化过程,如何保持细菌在整个检测过程中的稳定性也是关键,由此可见开发基于D-SERS的病原菌快速检测新方法还需进行系统而深入的研究。
2 激光诱导击穿光谱
1963年Ramsden等直接采用激光器为激发源进行原子光谱分析[34-35],标志着激光诱导击穿光谱(laser-induced breakdown spectroscopy, LIBS)技术的正式诞生。LIBS技术是利用脉冲激光聚焦后作用在待测样品表面,通过热效应激发微量待测物产生等离子体,最后利用光谱仪对等离子体的发射谱线进行收集,再与标准数据库中元素的特征谱线进行对比分析,实现对待测物元素检测的一种原子发射光谱技术(如图3所示)。随着近十多年高分辨宽光谱范围的中阶梯光栅光谱仪,高灵敏电荷耦合器件(CCD和ICCD)的快速发展,以及轻型、 廉价、 高功率激光器的出现,LIBS技术成为分析化学领域一颗冉冉升起的明星[36]。由于LIBS采用脉冲激光作用激发源,通过合理的光路设计或者使用光纤可以实现远距离聚焦,因此LIBS具有远程和非接触检测的能力,从而在生化危险品检测领域受到了众多研究者的关注[37-41]。总所周知,激光诱导产生的等离子体特征强烈依赖于激光参数,如脉冲宽度,脉冲能量,脉冲重复频率,激光辐照度等,其中脉冲宽度和脉冲能量是等离子体形成的主要影响因素,根据LIBS装置所用的激光脉冲宽度,可将LIBS分为纳秒LIBS(nanosecond-LIBS,ns-LIBS)、 皮秒LIBS(picosecond-LIBS, ps-LIBS)和飞秒LIBS(femtosecond-LIBS,fs-LIBS),其中ns-LIBS和fs-LIBS在细菌检测中的研究报道相对较多。
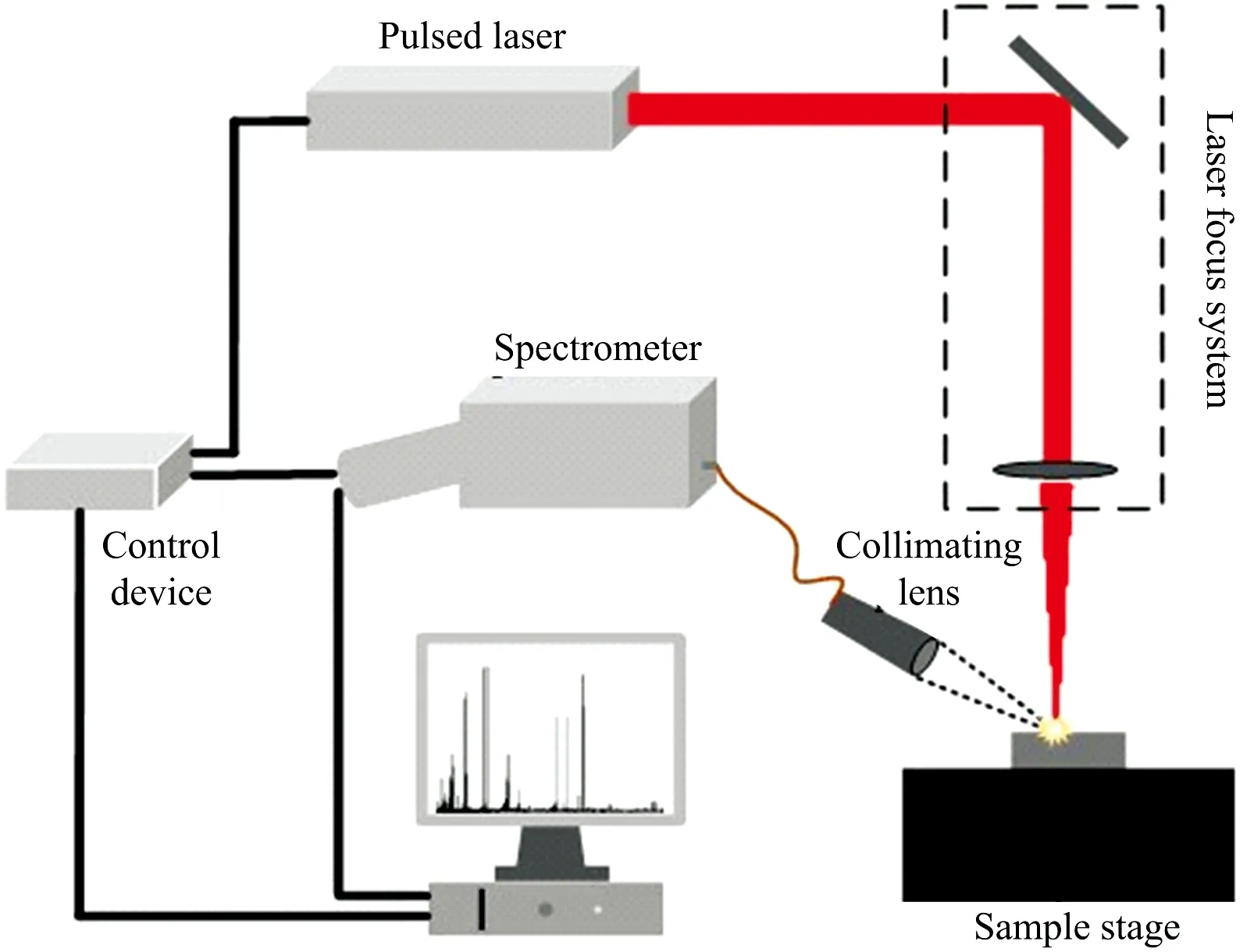
图3 LIBS装置示意图Fig.3 Schematic diagram of LIBS set-up
自2001年“911”恐怖袭击事件以及紧接着的“炭疽邮件事件”发生后,世界各国都开始投入巨大物力财力研究生化危险品现场快速检测装备以应对随时可能发生的生化恐怖袭击,LIBS技术由于其独特的优势成为生化危险品检测领域潜在工具[42-43]。纳秒激光器具有技术成熟、 性能稳定、 操作简单、 使用成本低等优势,国外研究人员率先开始基于纳秒激光器的ns-LIBS技术在细菌检测中的应用探索。2003年Morel等[44]将六种细菌样品和两种花粉样品干燥后压片,通过ns-LIBS获取了高信噪比的光谱信号,然后根据细菌细胞的矿物元素(如钙、 镁、 钾、 钠、 等)和有机元素(碳、 氢、 氧、 氮、 磷等)的发射光谱提出以累计强度比作为依据,通过时间分辨ns-LIBS进行生物危险品的鉴别。同年,Samuels等[45]利用ns-LIBS检测了细菌孢子、 霉菌、 花粉和蛋白质,他们采用孔径为0.45 μm的银膜过滤器对所有生物样品进行沉积后采集了LIBS光谱,通过主成分分析法对单个激光脉冲的LIBS光谱进行了分析,发现这些光谱数据包含足够的信息来区分不同的生物材料。2004年Kim等采用ns-LIBS检测了五种非致病微生物,光谱信号清楚地识别出了细菌细胞中的主要无机成分(包括钙、 镁、 钾、 钠、 铁、 磷),最后通过两条钙谱线强度比和两条磷谱线强度比建立细菌的指纹光谱完成鉴别[46]。这些早期研究结果表明,根据ns-LIBS获取细菌细胞无机元素或金属元素构建独特的元素指纹光谱库识别细菌确实是可行的。
飞秒激光器由于脉宽极短,小于物质的热耦合时间(皮秒),因此与物质作用时主要产生多光子电离而非热分解,同时极短的脉冲宽度不会进一步加热等离子体,从而避免等离子体温度过高而带来的严重连续辐射背景,因此相对ns-LIBS而言,fs-LIBS具有更高的信噪比和信背比[47]。此外,fs-LIBS由于激光诱导的等离子体的温度较低,几乎可以忽略其对环境空气中氮氧的激发,而ns-LIBS由于脉冲宽度较大,通常会持续加热诱导产生等离子得到高温等离子体,高温等离子体进一步激发剥蚀点附近的空气而发射强烈的氮和氧原子光谱,从而干扰有机或生物材料氮氧元素的发射谱线[48-49]。因此,采用fs-LIBS检测细菌时不仅可以得到无机元素的光谱信息,还可以有效地获得CN和C2等重组双原子分子的光谱信号,从而获得更全面的元素信息[50]。Baudelet等[50]采用fs-LIBS分析了五种不同细菌,得到六种微量矿物元素Na,Mg,P,K,Ca和Fe发射谱线,这些发射谱线的强度与其在细菌细胞内的浓度正相关,因此作者直接根据这些元素的光谱强度实现了五种细菌的区分。
早期探索性研究表明ns-LIBS和fs-LIBS均可有效获取细菌元素指纹信息,直接通过化学谱线强度信息或者结合化学计量学算法可以实现细菌分类,然而开发基于LIBS的病原菌快检技术仍面临诸多问题。首先,由于细菌的特殊性(体积小、 质量小),利用LIBS采集光谱信号时,脉冲激光会不可避免地烧蚀细菌负载基底,当基底含有与细菌相同的元素时则会干扰检测结果[51]。虽然通过培养大量细菌,冻干压片后进行LIBS测定可以避免基底信号的干扰,但是培养并冻干大量致病菌不仅耗时而且存在一定安全隐患。固体培养基也常作为细菌负载基底用于LIBS检测[52-53],然而培养基往往含有大量与细菌相同的元素,且不同厂家生产的培养基在化学成分上也存在差异,因此使用培养基作为细菌负载基底进行LIBS分析反而降低了检测结果的准确度。其次,采用LIBS进行细菌检测需要采集大量数据获得具有统计学意义的分类结果,同时要求待测细菌浓度较高,而实际检测中细菌浓度通常较低难以满足该技术的测试要求。
鉴于此,Rehse课题组设计了一种离心过滤器[54-55],通过离心可以对低浓度细菌进行高效浓缩,使LIBS分析检测限(LOD)接近103CFU。当前LIBS在细菌快速检测方面主要用于细菌的分类和鉴定,在细菌定量分析研究方面缺乏足够投入和关注。最近,我们课题组利用元素标记LIBS(elemental-tags LIBS,ETLIBS)开发了一种针对鼠伤寒沙门氏杆菌的定量检测方法,通过制备适配体修饰的铜纳米粒子作为元素标签,结合LIBS快速扫描检测限可低至61 CFU·mL-1[56],为LIBS快速高灵敏定量检测细菌提供新策略。为了将LIBS技术转化为一种实用、 可部署的检测或诊断工具,在过去十多年里研究人员进行了大量的研究,探索了LIBS硬件设备、 细菌培养条件、 以及数据处理方法等对检测结果的影响[50, 57-59],不断发掘LIBS在病原菌检测中的应用潜力,并逐步实现了从细菌元素指纹光谱的获取到死菌与活菌的区分,从纯菌株鉴别到有干扰物共存条件下的准确鉴别,从细菌的分类到定量检测等突破[41]。
3 总结与展望
激光器的诞生为光谱分析领域带来革命性变化,一方面高亮度的激光辐射提高了检测灵敏度使痕量测定成为可能,另一方面激光波长的可调谐性对原子或分子跃迁具有更高的选择性,只要选择适宜的波段范围和方法,就能够获得很高的灵敏度和选择性。随着现代科技的高速发展,相信小型化、 集成化以及低能耗的LIBS和Raman光谱分析设备,将在病原菌现场快速检测以及原位在线检测领域扮演重要角色。与此同时,多种检测技术相互结合取长补短,有望进一步提高检测结果的准确性和灵敏度,如Prochazka等[60]利用LIBS和Raman光谱分别获取细菌的分子和元素指纹光谱,并对所得数据进行融合后利用神经网络进行分类,结果表明数据融合后分类准确率由融合前的45%~50%提高到100%。基于LIBS和Raman光谱在仪器结构和光路设计方面的相似性,我们课题组利用波长为1 064 nm的脉冲激光器和波长为532 nm的连续激光器,搭建了一套可以检测样品同一位点元素和分子光谱信息的LIBS-Raman联用装置,并以单晶硅片和银包金纳米粒子(Au@Ag NPs)修饰的硅纳米线阵列作为细菌样品负载基底,利用该装置开发了基于LIBS和SERS相结合的细菌快速定量和定性分析新策略[61-62]。Dong课题组[63]将LIBS与胶体金免疫层析技术相结合,根据目标菌在免疫金试纸条检测线(T线)上富集显色进行定性分析,然后通过LIBS获取T线上富集的金属纳米粒子的发射光谱信号,间接实现目标菌的定量检测。这些联用技术或方法展现了LIBS和Raman光谱在病原菌检测领域的灵活性和多样性,进一步拓展了基于激光指纹光谱技术的应用前景,可以预见随着分析仪器的快速发展,能够提供待测样品多维互补信息的联用技术或装备将成为我们快速探索物质本质的重要工具和手段。
