免疫组化染色对病理技术质量控制的影响
2021-08-17邢延青
邢延青
(中国人民解放军联勤保障部队第九六O医院,山东 济南 250000)
0 引言
临床病理学诊断的重要部分为病理技术,切片质量直接影响了对疾病判断的准确率,所以病理技术质量控制尤为重要。常规的病理制片,存在一定的诊断局限性,容易漏诊或误诊。随着现代医疗水平的不断提高,免疫组化技术水平逐渐提升,这种技术切片质量高,诊断准确,已成为最普遍以及不可替代的辅助诊断技术[1]。本研究就100例患者为研究对象,对免疫组化染色对病理技术质量控制的影响进行探究。
1 资料与方法
1.1 一般资料。选取2019年12月至2020年12月在中国人民解放军联勤保障部队第九六O医院接受治疗的100例患者作为此次研究对象,并将其随机分为研究组与对照组,每组患者50例,其中,对照组男28例,女22例,年龄31~78岁,平均(48.38±6.76)岁;研究组男23例,女27例,年龄35~80岁,平均(52.56±4.73)岁。100例患者均自愿参与研究,签署了《知情同意书》,比较两组患者的基本资料,差异无统计学意义(P>0.05),具有可比性。
1.2 方法。对照组采用常规苏木精-伊红染色法(HE染色法),首先将组织蜡块进行常规切片、烤片处理,随后二甲苯Ⅰ、二甲苯Ⅱ各脱蜡5 min,无水乙醇、95%乙醇、85%乙醇洗涤各1 min,流水冲洗后,放入苏木精染色5~10 min,水洗,1%盐酸乙醇分化数秒,水洗,0.5%氨水反蓝,水洗,醇溶性伊红染色数秒钟,最后85%乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、100%乙醇Ⅰ、100%乙醇Ⅱ脱水,二甲苯Ⅰ、二甲苯Ⅱ透明,中性树胶封片。染色结果:细胞核呈蓝色,细胞浆呈粉红色。研究组采用免疫组化染色,首先将切片在室温下进行常规脱蜡处理,在常温下放入3%的双氧水中浸泡20 min;浸泡完之后,用PBS将切片进行冲洗,注意需要清洗三次以上,5 min一次,清洗时间要大于15 min;然后将700 mL+pH6.0的柠檬酸缓冲液倒入1000 mL的烧杯中,对其进行加热,加热至沸腾;将记HBsAg、HBcAg、ki-67、CK19抗体的切片均放入烧杯中并做好标记,加热15 min后取出;在常温下冷却后用pH7.4的PBS对切片进行清洗,次数与时间同上;所有切片均给予一抗处理,放置于4℃的冰箱内过夜孵育;用pH7.4的PBS进行冲洗,次数时间同上,再给予切片滴加二抗,放置于常温下孵育,时间为10 min;最后一次用pH7.4的PBS进行冲洗,次数时间同上,5~10 min的DAB显色;水洗后用苏木精进行衬染,用脱水透明中型树胶进行封固;将阴性阳性设置好以便针对不同的抗体[2]。常规病理制片的切片结构要求完整、薄,最佳厚度为3μm,无破损无折叠,细胞的形态可以观察清楚,染色较为明显,能够较好的进行核物质对比;免疫组化染色切片固定要及时,染色要清晰,对比鲜明,透光性好,结构完好无损,能够精确定位阳性物质,背景干净,色泽艳丽,无特异性着色。
1.3 指标观察。观察比较两组患者的切片优良总计率和确诊率。切片质量标准[3]:优:患者病理活检组织一致,细胞结构没有损坏、不收缩,细胞形态清楚,染色明显,能够很好的对比核质染色,没有脱片现象;良好:患者病理活检组织不完全一致,细胞结构没有明显损坏、不收缩,细胞形态较为清楚、染色较为明显,能够较好对比核质染色,脱片现象不明显;差:患者病理活检组织不一致,细胞结构有明显损坏、细胞收缩,细胞形态模糊,染色无法分辨,核质染色对比效果较差,有严重的脱片现象。
1.4 统计学分析。将数据输入SPSS 20.0中处理,计量资料用()表示,用t、χ2检验,计数资料n/%表示,P<0.05,组间数据比较存在意义。
2 结果
2.1 两组患者切片优良率。经过对比统计,研究组患者50例,其中优良切片48例,切片优良率为96%;对照组患者50例,其中优良切片有40例,优良切片率为80%,差异有统计学意义(P<0.05),见表1。

表1 两组患者切片优良率[n(%)]
2.2 两组患者的确诊率。通过免疫组化染色的研究组确诊率为(94.00%),常规HE染色对照组确诊率为(74.00%),研究组确诊率明显高于对照组确诊率,组间数据比较差异有统计意义(P<0.05),见表2。
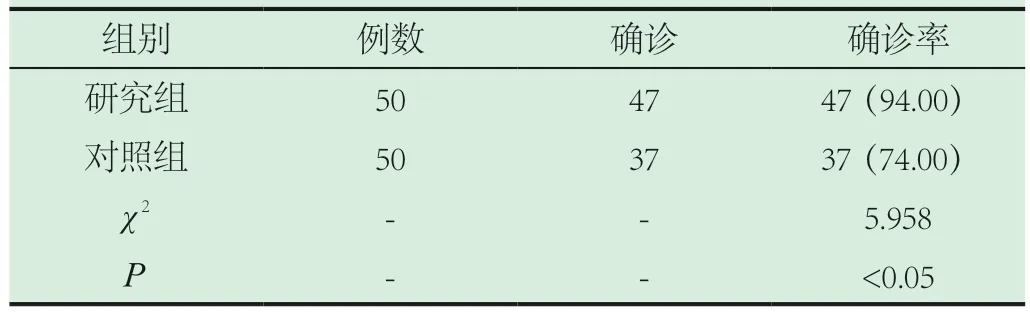
表2 两组患者的确诊率[n(%)]
3 讨论
随着我国医疗水平的不断提高,人们清楚的认识到病理技术质量控制的重要性。切片质量对病理诊断具有重大意义,免疫组化染色能够有效的提高切片质量。
免疫组化染色原理是合酶聚合物与二抗相结合,形成了多聚螯合物,再结合一抗,使得抗原抗体的信号放大,由于不会有链霉菌抗生物素蛋白在多聚物中出现,所以不会发生背景染色的现象,也就提高了切片的质量。在施行免疫组化染色时,最为重要的一步就是取材,在进行取材时极易出现以下问题[4]:①免疫组化取材时,对切片的质量要严格把控,要保证选取的病变组织适宜且体积厚度一致,对标本的描述要详尽,对标本的组织部位记载要准确,对标本要进行及时处理和保存,避免标本被污染,影响切片效果。②操作人员要在取材时就严格把控好切片的质量标准。后期进行固定操作后,能让新鲜组织保存好原来细胞形态,未能固定好,组织会形成自溶现象,在术后取得组织标本后,需尽快放置在固定液之中,让其充分固定好,固定时间依据样本大小不同存在差异性,大样本固定时间在18~24 h,小样本固定时间在4~6 h。免疫组化染色操作时,需良好染色试剂,能直接影响染色效果,脱蜡、浸水、脱水及透明时,选用酒精及二甲苯等试剂,需及时更新和补充,每一种试剂是否稳定会直接影响临床病理诊断结果。常见问题为[4]:①试剂的保存方法存在问题,使得试剂产生挥发,造成纯度下降;②长时间未能更新制剂,未能及时添加缺漏制剂,延滞了切片工作,使得组织切片质量下降,直接造成诊断准确性受到影响;在日常工作中,应定期更换免疫组化试剂,严格把关试剂使用、采购及配置,保障所有切片质量。在控制好免疫组化治疗过程中,最为重要的步骤为[5]:①对抗原进行高压修复操作,对染色结果有着重大影响的操作就是抗原修复,一旦在抗原修复过程中,修复不当或修复时间短和温度低,会造成无色片或假阴性片的形成;②组建免疫组化抗原阳性和阴性对比化学实验室时,检验免疫组化染色结果通过设置对照片来提升可信性,让免疫组化形成标准化操作,这个步骤不可缺少,也是极为关键步骤,完善质量技术指标也是我院医务人员形成自我保护的一种良好方式;③免疫组化染色操作时,对操作人员的要求非常高,所有操作严格依据要求进行,这也是保障染色质量和可重复性的重要依据。
本研究中通过对比常规HE染色与免疫组化染色对病理技术质量控制的影响,发现,研究组患者50例,其中优良切片48例,切片优良率为96%;对照组患者50例,其中优良切片有40例,优良切片率为80%;研究组确诊率为(94.00%),常规HE染色对照组确诊率为(74.00%),结果显示,使用免疫组化染色的研究组患者,切片优良率明显高于使用常规HE染色对照组;研究组的确诊率比对照组确诊率要高,这些结果都可以说明免疫组化染色的有效性、准确性,在常规HE染色切片不能对病例做出诊断时,可优先选择免疫组化染色技术进行辅助诊断。
综上所述,免疫组化染色对病理技术质量控制起着积极作用,能够有效地提高诊断的准确性,让患者能够得到快速且全面的治疗,同时也使病理技术的质量更上一层楼。
