猪圆环病毒2型和猪繁殖与呼吸综合征病毒混合感染病例的实验室诊断
2021-08-17尹德晶程振涛
吴 燕, 陈 静, 杨 鹏, 尹德晶, 程振涛*
(1. 贵州省贵阳市花溪区马铃乡农业服务中心,贵州 贵阳 550027; 2. 贵州大学动物科学学院,贵州 贵阳 550025)
2021年1月,贵阳市某养殖场猪群陆续出现不明原因死亡病例,病初出现被毛粗乱、消瘦、发热、喘气等症状,随后发病猪陆续死亡,病猪死亡前耳朵及全身有轻微发紫现象,病死率达80%,病程8~10 d。为了查明病因,特进行实验室病原学检测。
1 材料与方法
1.1 检测病料取3头病猪血液(3份)、组织病料(肺脏、肾脏、脾脏、淋巴结各2份)作为检测病料。
1.2 主要试剂及仪器(1)主要试剂:猪繁殖与呼吸综合征病毒(PRRSV)通用型实时荧光定量RT-PCR(qRT-PCR)检测试剂盒、猪瘟病毒(CSFV)通用型实时荧光定量RT-PCR检测试剂盒,购自北京世纪元亨公司;DNA/RNA提取试剂盒、DL 2 000 DNA Marker试剂、2×TaqPCR MasterMix,购自大连宝生物工程有限公司。(2)主要仪器:普通PCR仪[TC-96/G/H(b)B],购自杭州博日科技有限公司;荧光定量PCR仪(Line-genek),购自杭州博日科技有限公司;电泳凝胶成像仪(SYGENE),购自Gene公司。
1.3 血液及组织样品DNA/RNA提取取3份血液样品100 μL,按DNA/RNA提取试剂盒说明书方法室温环境提取血液总DNA和RNA;取肺脏、肾脏、脾脏、淋巴结各1 g于灭菌研钵,加入生理盐水1.5 mL快速研磨,匀浆后转入1.5 mL灭菌离心管中,8 000 r/min离心2 min,取上清液100 μL,按DNA/RNA试剂盒说明书方法室温环境提取各组织的总DNA和RNA。
1.4 相关病毒核酸检测
1.4.1 PCV-2核酸检测分别以血液和组织样品的总DNA为模板,采用PCR方法进行PCV-2检测。扩增体系25 μL:2×TaqMixture 12.5 μL,10 μmol/L上、下游引物(PCV2-P1:5’-AAGGGCTGGGTTATGG TATG-3’;PCV2-P2:5’-CGCTGGAGAAGGAAAAAT GG-3’)各1 μL,模板DNA 2 μL,灭菌双蒸水 8.5 μL。 反应条件:94 ℃预变性 3 min;94 ℃变性30 s,56 ℃变性30 s,72 ℃延伸 45 s,共35次;72 ℃延伸10 min。取PCR产物8 μL于含核酸染料的1.2%琼脂糖凝胶上电泳(110 V,25 min),于凝胶成像系统观察结果(预扩增片段353 bp)。
1.4.2 PRRSV核酸检测分别以血液和组织样品的总RNA为模板,构建qRT-PCR反应体系25 μL:无菌无核酸酶水5 μL,qRT-PCR反应液12.5 μL,酶混合液1.0 μL,荧光探针4.5 μL,模板RNA 2 μL。反应条件:42 ℃ 5 min,95 ℃ 10 s;95 ℃ 5 s,60 ℃ 35 s,共40个循环,在每次循环第2步收集荧光信号。根据阳性对照标准,以Cq值≤35并出现特定的扩增曲线判定为阳性。
1.4.3 CSFV核酸检测分别以血液和组织样品的总RNA为模板,构建qRT-PCR反应体系25 μL:无菌无核酸酶水7.1 μL,qRT-PCR反应液12.5 μL,酶混合液1.0 μL,荧光探针2.4 μL,模板RNA 2 μL。反应条件:42 ℃ 5 min,95 ℃ 10 s;95 ℃ 5 s,60 ℃ 35 s,共40个循环,在每次循环第2步收集荧光信号。根据阳性对照标准,以Cq值≤30并出现特定的扩增曲线判定为阳性。
2 结果
2.1 PCV-2核酸检测结果
2.1.1 血液样品由图1可见:3份血液样品PCR均扩增出大小为353 bp基因片段,与阳性对照片段相符,表明血液中存在PCV-2。
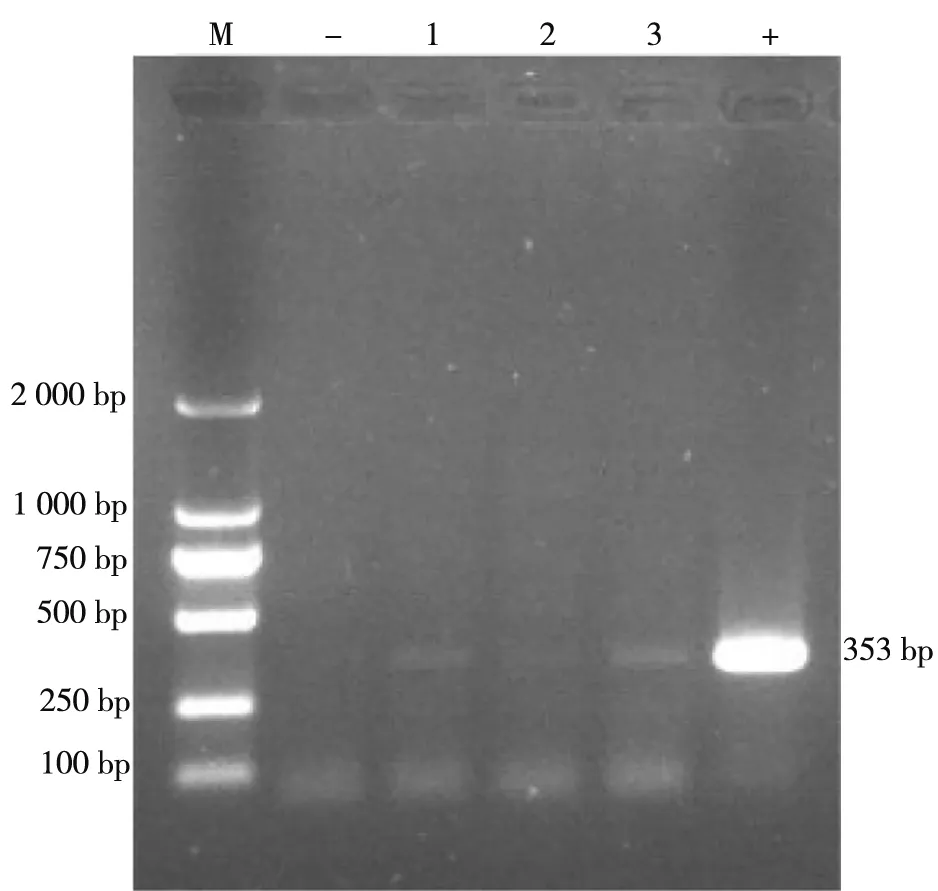
M:2 000 bp分子质量标准; -:阴性对照; 1~3:血液样品; +:阳性对照图1 血液样品PCV-2 PCR检测结果
2.1.2 组织样品由图2可见:2份组织样品PCR均扩增出大小为353 bp基因片段,与阳性对照片段相符,表明组织中存在PCV-2。
2.2 PRRSV核酸检测
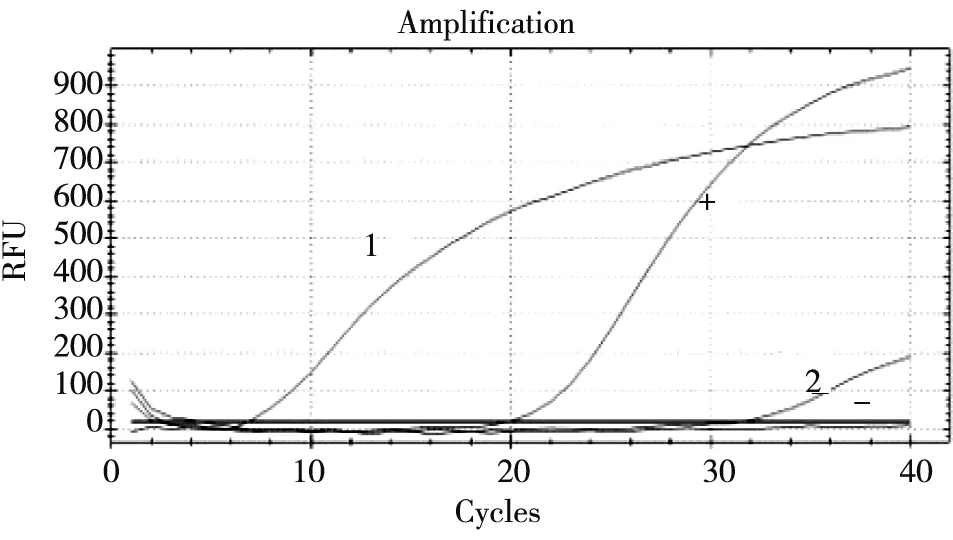
2.2.1 血液样品由图3可见:阳性对照Cq值为21,而3份血液样品Cq值>40,且无明显扩增曲线,说明血液中不存在PRRSV。

M:2 000 bp分子质量标准; -:阴性对照; 1~2:组织样品; +:阳性对照图2 组织样品PCV-2 PCR检测结果

+:阳性对照; -:阴性对照; 1~3:血液样品图3 血液样品PRRSV qRT-PCR检测结果
2.2.2 组织样品由图4可见:阳性对照Cq值为21,而2份组织样品Cq值均<35,且有明显扩增曲线,说明组织中存在PRRSV。
+:阳性对照; -:阴性对照; 1~2:组织样品图4 组织样品PRRSV qRT-PCR检测结果
2.3 CSFV核酸检测
2.3.1 血液样品由图5可见:阳性对照Cq值为22,而3份血液样本Cq值>40,且无明显扩增曲线,说明血液中不存在CSFV。
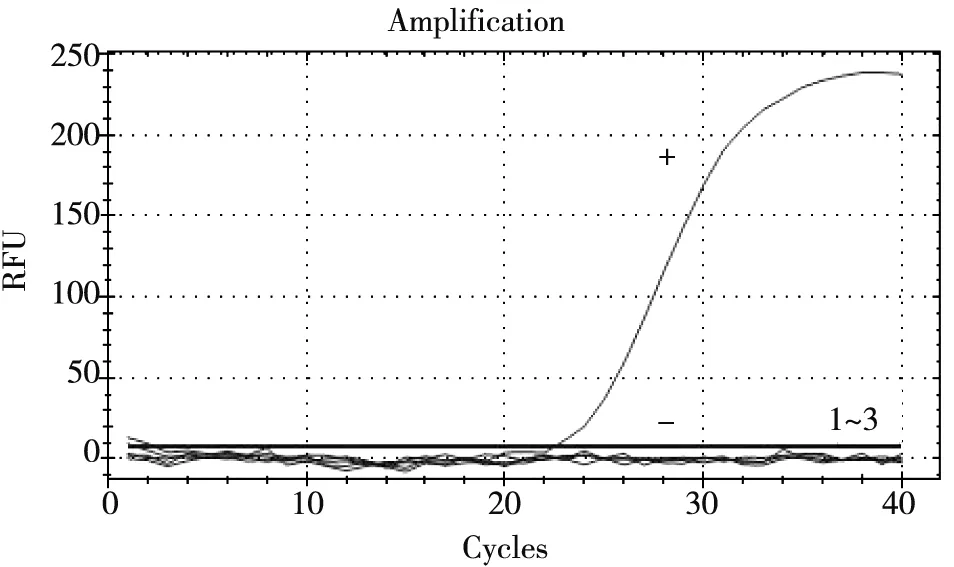
+:阳性对照; -:阴性对照; 1~3:血液样品图5 血液样品CSFV qRT-PCR检测结果
2.3.2 组织样品由图6可见:阳性对照Cq值为20,而2份组织样品Cq值>40,且无明显扩增曲线,说明组织中不存在CSFV。

+:阳性对照; -:阴性对照; 1~2:组织样品图6 组织样品CSFV qRT-PCR检测结果
3 结论
对送检的猪血液样品和组织样品进行PCV-2、PRRSV、CSFV核酸检测结果表明,猪场病例存在PCV-2、PRRSV混合感染。
4 讨论
4.1PCV-2为单链环状DNA病毒,可引起仔猪断奶后多系统衰竭综合征(PMWS),是危害猪群健康的重要疾病之一,具有空气传播、垂直传播、持续感染、亚临床感染、免疫抑制和继发感染等特点[1~3]。PRRSV为单链RNA病毒,主要引起母猪繁殖障碍、木乃伊胎以及仔猪呼吸道症状等[4,5]。据相关报道,PRRSV在猪淋巴结等组织中的存活时间比血液中长且含量高,因此在采集病料时应侧重采集该病原体主要侵害部位和含量高的病料进行检测[6]。
4.2近年来,猪病混合感染日趋普遍和严重,如PCV-2易与其他常见病原体混合感染,其中PRRSV与PCV-2的混合感染最为严重[7,8]。此外,CSFV与PRRSV混合感染也呈上升趋势[9~11]。PRRSV与PCV-2混合感染后会使IL-10(白介素10)大量表达,引起炎症反应、机体免疫抑制、免疫系统紊乱,增加其他细菌或病毒感染的概率,死亡率增加[12,13]。
