菠菜色素的提取与分离实验教学优化探索
2021-08-17郭乃妮郑敏燕赵维纪思媛曾睿李敏
郭乃妮,郑敏燕,赵维,纪思媛,曾睿,李敏
(咸阳师范学院化学与化工学院,陕西咸阳 712000)
天然产物广泛地存在于自然界中,种类众多,许多天然产物具有惊人的生理效能。从常见的植物中提取天然产物,对天然产物进行分离、提纯、鉴定和结构分析,寻求具有特殊结构与性质特别是用于人类健康的天然产物是有机化学及实验中一个十分活跃的领域[1,2]。
有机化学实验常用的萃取、蒸馏、结晶等是天然产物分离提取的基础方法,随着色谱技术的不断发展薄层层析、柱层析、气液色谱及高效液相色谱等已经越来越多地应用于天然产物的提取[3-5]。绿色植物如菠菜中含有叶绿素、叶黄素、胡萝卜素等多种天然色素,通过菠菜色素的提取和分离实验可以使学生对天然产物的分离提取有一定认识和理解,有助于培养学生实验技能,提高学生学习的积极性和综合能力[6]。但是传统实验方法在对叶黄素、叶绿素和胡萝卜素分离的柱层析实验操作中,存在着液体色素添加不均匀、水分较多、时间受限、层析效果不佳等问题[7-9],研究通过采用把菠菜色素的提取浓缩液和柱层析法所用吸附剂载体中性氧化铝混合搅拌均匀,在红外线烘箱中烘干后,进行色素柱层析操作,可以有效地提高柱层析色素的分离效果,该优化研究使胡萝卜素、叶黄素、叶绿素分离更快速、精确,提高了分析效果,有效地提高了实验的可操作性,提高了实验效率。
1 实验原理
菠菜中含有叶绿素(绿色)、胡萝卜素(橙色)、叶黄素(黄色)等多种天然色素,这几种色素结构均属共轭多烯的衍生物。叶绿素以叶绿素a(C55H72O5N4Mg)和叶绿素b(C55H70O6N4Mg)两种相似的结构存在,结构如图1和2所示,均为吡咯衍生物与金属镁的配合物,是绿色植物光合作用的必需催化剂,大烃基结构的存在使叶绿素易溶于丙酮、乙醇、石油醚等有机溶剂。
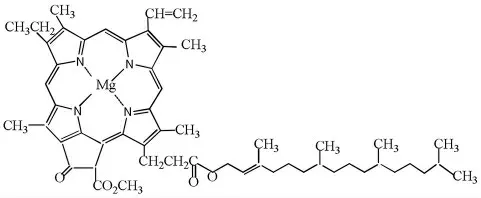
图1 叶绿素a结构Fig.1 structure of chlorophyll a
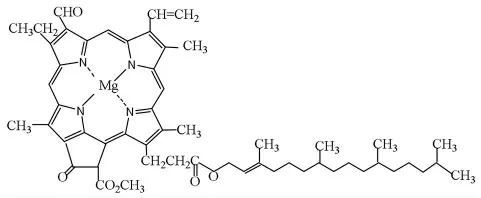
图2 叶绿素b结构Fig.2 structure of chlorophyll b
胡萝卜素(C40H56)是一类长链共轭多烯,结构如图3所示,易溶于氯仿、苯和石油醚。胡萝卜素具有维生素A的生理活性,可作为食品工业中的色素使用,无毒安全,是一种抗氧化剂,具有解毒作用,在抗癌、预防心血管疾病等方面有显著的功能,并进而防止老化和衰老引起的多种退化性疾病,是维护人体健康不可缺少的营养素。
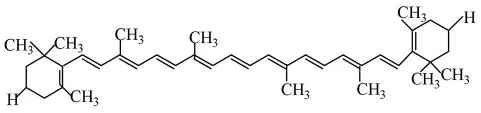
图3 胡萝卜素结构Fig.3 structure of carotene
叶黄素(C40H56O2)是胡萝卜素的羟基衍生物,又称类胡萝卜素,结构如图4所示,含量通常是胡萝卜素的2倍,与胡萝卜素相比较易溶于乙醇而在石油醚中溶解度较小。叶黄素本身是一种抗氧化物,并可以吸收蓝光等有害光线,对光氧化、光破坏具有保护作用,是构成人眼视网膜黄斑区域的主要色素。
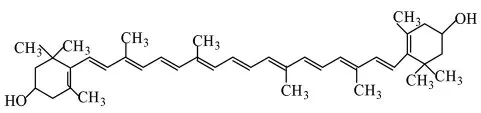
图4 叶黄素结构Fig.4 structure of lutein
吸附柱层析法是分离、提纯和鉴定有机物的重要方法,本研究采用将菠菜色素的提取浓缩液和柱层析吸附剂载体中性氧化铝先均匀搅拌混合,再在红外线烘箱中充分烘干,最后用烘干拌匀的含色素的固体氧化铝进行柱层析操作。该实验的固体色素分离法利用色素能均匀分层,并且胡萝卜素、叶黄素、叶绿素因极性差异在柱层析层析液中溶解度和分离速度的不同实现主要色素的快速、精确分离提纯。主要色素依次分离的顺序为:胡萝卜素(橙色)、叶黄素(黄色)、叶绿素a(蓝绿色)和叶绿素b(黄绿色)。
2实验部分
2.1 实验仪器及试剂
仪器:FA2004型电子分析天平(常州德普纺织科技有限公司),UV-240紫外分光光度计(上海精密仪器仪表有限公司),ZK-072型真空干燥箱(上海沪粤明科学仪器有限公司),层析柱(20×1.0cm),研钵,蒸馏烧瓶,冷凝管,抽滤瓶,烧杯,量筒。
试剂:中性氧化铝(150~160目)、乙醇(95%)、石油醚、丙酮、丁醇、甲醇、无水Na2SO4,以上均为分析纯试剂;新鲜菠菜。
2.2 实验过程
菠菜色素的提取分离过程如图5所示。
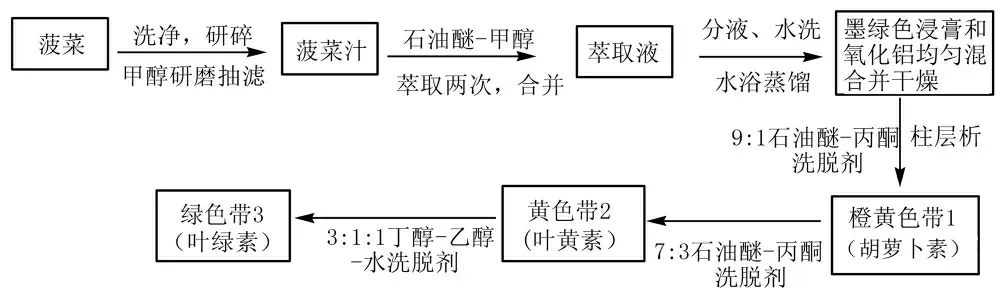
图5 菠菜色素的提取分离
2.3 实验操作规程
2.3.1 菠菜色素的提取
称取20 g新鲜干净无水的菠菜叶,剪碎后与20 mL的甲醇拌匀后在研钵中仔细研磨2~5 min,用布氏漏斗抽滤,弃去滤液后将糊状菠菜叶放回研钵,用10 mL体积比3∶2的石油醚-甲醇混合液萃取两次,每次轻轻研磨并抽滤,将所得深绿色萃取液合并后转入分液漏斗,用20 mL的蒸馏水分两次轻轻振荡萃取除去甲醇,分液后取上层液体加入无水Na2SO4干燥,再通过水浴蒸馏除去大部分石油醚,得1 mL深绿色浓缩色素提取液。
2.3.2 菠菜色素的分离
采用柱层析法进行菠菜色素的分离,具体操作规程如下:
在20×1.0 cm的层析柱中加入10 cm高的石油醚,用玻璃漏斗缓慢加入适量中性氧化铝(150~160目),同时打开层析柱下边旋塞,边加边用小木棒敲打层析柱,保持层析柱内石油醚液面高度不变,保证吸附剂紧密均匀平整。装完层析柱后打开下端旋塞,放出部分石油醚使得氧化铝表面石油醚层高度剩余1~2 mm即可。
将所得的1 mL深绿色浓缩色素提取液与氧化铝搅拌均匀,在65℃条件下真空干燥后用玻璃漏斗加入上述层析柱顶部,打开层析柱下端旋塞使石油醚液面下降至柱面以下1 mm后,关闭旋塞,再从顶端用滴管滴加石油醚后再次打开下端旋塞,使液面下降至柱面下1 mm左右,重复操作数次使得色素全部进入柱体。
配制石油醚-丙酮(9∶1)的洗脱剂50 mL,用滴液漏斗在层析柱上面逐滴加入洗脱剂,打开层析柱下端旋塞逐滴放出洗脱剂,层析开始,用锥形瓶收集得到的第一个橙黄色样品色素即为胡萝卜素;再用配制的石油醚-丙酮(7∶3)作洗脱剂,分出的黄色样品色素即为叶黄素;最后用配制的丁醇-乙醇-水(3∶1∶1)作洗脱剂,分出的绿色样品色素即为叶绿素。
2.3.3 菠菜色素的紫外光谱测定
胡萝卜素的紫外光谱测定:将分离所得橙黄色样品用石油醚稀释后加到1 cm的比色皿中,以石油醚做空白试剂,用V-240紫外分光光度计测得λmax为480 nm、452 nm,对应的吸光度分别为0.494、0.576。
叶黄素的紫外光谱测定:将分离所得黄色样品用石油醚稀释后加到1 cm的比色皿中,以石油醚做空白试剂,用V-240紫外分光光度计测得λmax为447 nm、423 nm,对应的吸光度分别为0.673、0.457。
叶绿素的紫外光谱测定:将分离所得绿色样品用石油醚稀释后加到1 cm的比色皿中,以石油醚做空白试剂,用V-240紫外分光光度计测得λmax为662 nm、429 nm,对应的吸光度分别为0.236、0.342。
3 结论
该研究采用色素提取液和吸附剂氧化铝混合干燥后的固体加入法进行柱层析操作,对液体添加法进行了改良,实现了色素固体加入的实验优化研究改革。研究发现,通过改进后胡萝卜素、叶黄素、叶绿素a和叶绿素b在洗脱剂(流动相)的作用下先后出现了橙色、黄色、蓝绿色、黄绿色四个均匀分层、颜色鲜明、完整的色谱带,实验结果与理论预期完美结合,实现了菠菜色素的有效分离及提纯。实验色素浸膏的优化加入使实验教学的现象更加直观、有效,避免了实验结果不清楚、现象不明对学生的负面影响,有利于学生对主要色素的极性大小、吸附原理、流动相和固定相等知识概念的生动形象理解,方便了理论知识和实践环节的衔接,有助于学生对技能知识的掌握,加强了学生创新思维的培养,大大调动了学生实践操作的积极性和主动性。
