海藻糖改性聚乙烯醇及其防雾/防霜涂层
2021-08-16白景奇任丽霞朱孔营赵蕴慧李晓晖袁晓燕
白景奇,白 珊,任丽霞,朱孔营,2,赵蕴慧,李晓晖,袁晓燕
(1.天津大学材料科学与工程学院,天津市材料复合与功能化重点实验室,天津 300350;2.天津大学分析测试中心,天津 300072)
由于具有良好的生物相容性、成膜性、黏结性和耐溶剂性,聚乙烯醇(PVA)常以纤维、水凝胶及薄膜等形式用作功能材料或生物材料[1,2].为提高其加工性能、力学性能、生物降解性和生物相容性,结合其结构特点,往往需要将PVA与其它成分共混或化学改性[1~5].王郗等[4]发现使用山梨醇改性PVA可明显改善PVA的热塑加工性能.闫铭等[3]借助于PVA微晶交联作用提高了海藻酸钠/聚丙烯酸/PVA复合纤维的力学性能.利用透明质酸对PVA进行改性可得到较强力学性能和亲水性及生物相容性的共混膜,以减少蛋白质吸附[5].从侧羟基入手对PVA进行接枝也是一种常用的改性方法[1,6],如蒋春花等[6]制备的PVA接枝离子液体聚合物电解质表现出良好的热稳定性.
雾和霜的形成会显著降低透明物体的清晰度,给光学仪器和设备的应用带来不便,因此研究防雾/防霜涂层十分必要[7~14].防雾涂层通常以亲水性高分子为主要成分[7],形成层层复合、交联或半互穿网络(SIPN)[8~15].作为一种亲水性物质,PVA常用作防雾涂层原料[8~10,16~19],并与有机或无机成分复合对涂层进行改性.例如,将PVA与水解苯乙烯-马来酸酐共聚物结合可得到具有自修复能力的防雾涂层[16];与SiO2纳米粒子复合可提高PVA防雾涂层的稳定性[17].另外,在防雾的同时具有在冰点以下的防霜能力也是涂层所必须具备的性能[8~12].海藻糖是一种非还原性葡萄糖二糖,在生物体内以游离或糖脂形式存在,可通过氢键、水合等作用保护蛋白质和细胞在脱水、高温及冷冻等不良环境下免遭破坏[20~22].研究表明,在PVA冻胶体系中加入海藻糖可改善PVA分子间氢键作用[23].
本文用海藻糖对PVA进行接枝改性,并将接枝物与乙二醇二甲基丙烯酸酯(EGDMA)混合制备亲水性半互穿网络(SIPN)涂层,以期借助于海藻糖的抗冻和防失水作用提高涂层的亲水性和防雾、防霜能力.
1 实验部分
1.1 试剂与仪器
聚乙烯醇(PVA),Mn=11000~31000,醇解度98%,美国Alfa Aesar公司;海藻糖(Tre),北京百灵威公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、(3-巯基丙基)三甲氧基硅烷(MPTS)、乙二醇二甲基丙烯酸酯(EGDMA)和安息香二甲醚(DMPA),天津希恩思公司;4-二甲氨基吡啶(DMAP),上海萨恩公司.
AvanceⅢHD 400 MHz型核磁共振波谱仪(NMR)和TENSO 27型傅里叶变换红外光谱仪(FTIR),德国布鲁克公司;CPSM5500A型原子力显微镜(AFM),广州本原纳米仪器有限公司;722s型可见分光光度计,上海菁华科技仪器有限公司;JC2000D型接触角测量仪,上海中晨数字技术设备有限公司;DXR型拉曼光谱仪,美国赛默飞公司.
1.2 样品制备与表征
1.2.1 聚乙烯醇-g-海藻糖(PVA-g-Tre)的合成 合成路线如Scheme 1(A)所示.首先参照文献[24,25]方法合成羧基化海藻糖(Tre-COOH),然后在EDC和DMAP作用下,通过Tre-COOH的羧基与PVA羟基的反应得到接枝物.具体过程如下:将Tre-COOH,EDC和DMAP溶于去离子水中,在冰水浴条件下搅拌30 min后于室温下静置;在磁力搅拌下将PVA溶于95℃以上的热水,待降至室温后将之加到上述反应体系中,室温下继续反应3 d,然后透析3 d(截留分子量8000)并冻干,得到白色絮状产物.控制n(COOH)/n(OH)分别为1∶1,2∶1,3∶1,4∶1和5∶1,制备不同接枝率的PVA-g-Tre,分别记为P1,P2,P3,P4和P5.
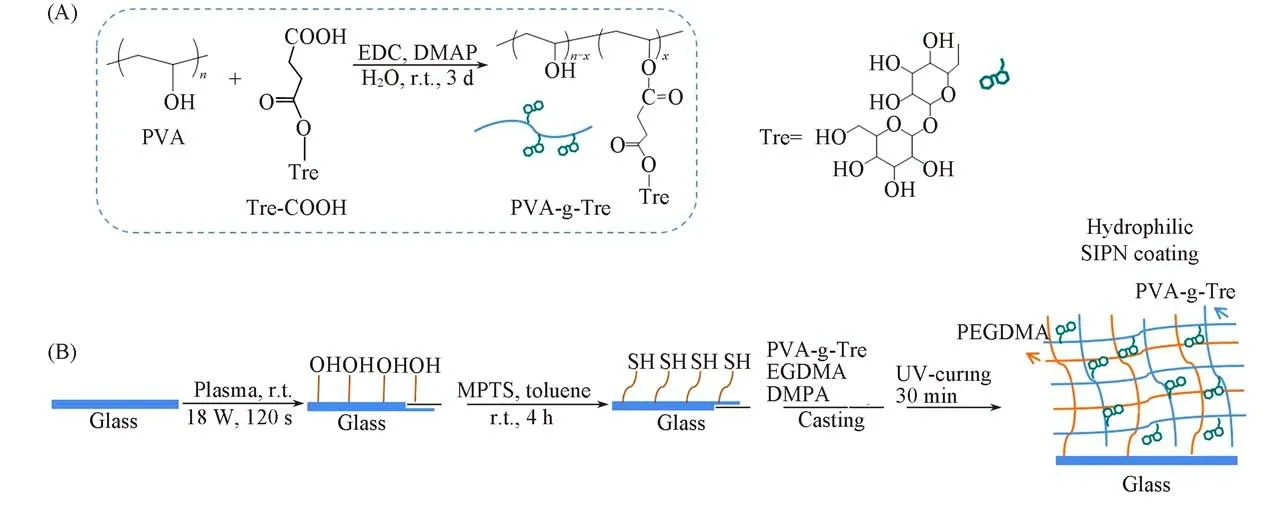
Scheme 1 Synthesis of PVA-g-Tre(A)and schematic preparation of the antifogging coating(B)
1.2.2 涂层的制备 制备方法如Scheme 1(B)所示.先分别用等离子体、硅烷偶联剂MPTS对玻璃基底(1 cm×1 cm)进行表面处理,并用溶剂超声清洗后,将100μL PVA或PVA-g-Tre的10 mg/mL水溶液(含1 mg/mL EGDMA,0.20 mg/mL光固化剂DMPA)均匀涂在玻璃上,用UV光照射(365 nm,125 W)30 min,再在匀胶机上继续以3000 r/min的转速处理40 s以使之分散均匀,然后于40℃下静置1 h至完全固化形成SIPN涂层.玻璃的另一面也按照同样步骤涂覆相同组分的SIPN涂层.根据使用的PVA-g-Tre,防雾涂层分别记为C-P1,C-P3,C-P3,C-P4和C-P5.
1.2.3 表征 以氘代水为溶剂进行1H NMR测试;用溴化钾压片法进行FTIR测试;采用AFM轻敲模式对涂层表面进行形貌表征;以5μL去离子水为测试液体,记录涂层表面水接触角在200 s内的变化;在波长为400~800 nm范围测定防雾前和冷防雾后的涂层透光率;采用热蒸气法表征涂层热防雾性能,即将样品置于80℃热水上方3 cm处保持10 s后,对下方的“Antifogging”字样用数码相机拍照,获得热防雾照片;将样品在-20℃环境中放置45 min后取出,于室温、相对湿度50%的条件下立即拍照,得到冷防雾照片;在室温、相对湿度50%条件下将样品置于冷台上,以2℃/min速率降温至-5℃时开始记时,每隔1 min拍照,以观察防霜现象;制备水与涂层质量比为3.02的涂层/水二元体系,测试拉曼光谱(激发波长为532 nm).
2 结果与讨论
2.1 PVA-g-Tre的结构表征
由FTIR谱图[图1(A)]可见,在接枝物P1—P5的谱线上,于1720和992 cm-1处分别出现了酯基上C=O和海藻糖与糖苷键相连的—CH—的特征峰.由1H NMR谱图[图1(B)]可见,接枝物在δ5.2附近存在海藻糖—CH—的特征峰(l),在δ2.6处出现了Tre-COOH上与酯基相连的亚甲基—CH2—的特征峰(e,f),而δ1.6处出现了主链亚甲基的特征峰(a,c)[25].由FTIR和1H NMR结果可推测已成功合成PVA-g-Tre.通过1H NMR谱图中δ5.2(l)与δ1.6(a,c)处特征峰的积分面积比值计算接枝率,即已接枝海藻糖的重复单元占PVA总重复单元的摩尔分数.结果表明,P1,P2,P3,P4和P5的接枝率分别为2.8%,4.5%,15.3%,25.8%和64.9%.
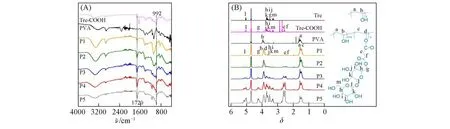
Fig.1 FTIR(A)and 1H NMR(B)spectra of Tre-COOH,PVA and PVA-g-Tre with different grafting ratios
2.2 涂层的表面性能
图2 为分别含有PVA和不同接枝率PVA-g-Tre的防雾涂层的AFM照片.可以看出,涂层表面较平整,PVA涂层的粗糙度(Rq,nm)仅为0.76 nm,海藻糖接枝后,涂层的粗糙度略有增大,其中C-P5涂层的粗糙度达到3.45 nm,未发生明显的相分离.亲水性涂层的润湿性能够促进水分子的铺展,或将水分子吸入涂层内部,从而提高防雾性能[10].由不同防雾涂层表面水接触角在200 s内的变化(图3)可知,随着PVA-g-Tre接枝率的增加,涂层水接触角呈下降趋势,且接枝率越高,水接触角随着时间下降幅度越大.200 s时,C-P1,C-P2,C-P3,C-P4和C-P5涂层的水接触角分别为(24.5±2.5)°,(19.7±3.5)°,(15.5±1.1)°,(10.3±0.5)°和(6.0±0.7)°,显著低于玻璃[(27.9±0.82)°]和C-PVA[(31.2±3.0)°],说明海藻糖的引入改变了PVA的分子结构,使得PVA-g-Tre的亲水性高于PVA,从而提高了涂层的亲水性和润湿性.

Fig.2 AFMimages over a scope of 10μm×10μm of the coatings containing PVA and PVA-g-Tre with different grafting ratios(A)C-PVA,R q=0.76 nm;(B)C-P1,R q=2.58 nm;(C)C-P2,R q=2.94 nm;(D)C-P3,R q=2.37 nm;(E)C-P4,R q=2.82 nm;(F)C-P5,R q=3.45 nm.
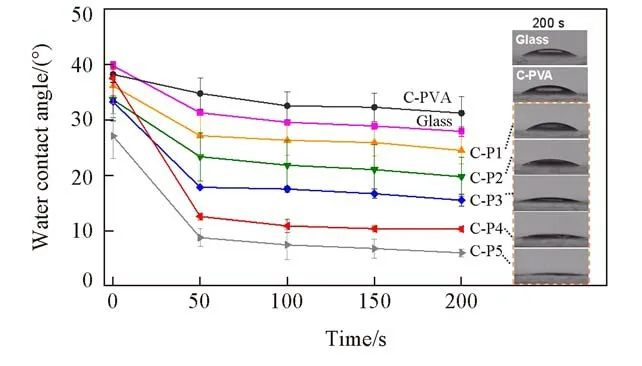
Fig.3 Variation of water contact angle on different coating surfaces in 200 sInsets:pictures showing water contaet angle measurement at 200 s.
2.3 涂层的防雾和防霜性能
采用热蒸汽法表征涂层的热防雾性能,并对低温放置样品取出后立即拍照且测定透光率来考察涂层的冷防雾性能.由透光率结果(图4)可知,防雾测试前,C-P1,C-P2,C-P3,C-P4和C-P5涂层的透光率分别在89.0%~90.4%,89.0%~90.8%,89.0%~90.3%,89.6%~91.1%和89.2%~90.4%范围内,与PVA涂层(88.6%~88.9%)和玻璃(90.0%~91.1%)相当;于-20℃放置45 min再置于室温后,涂层的透光率仍能保持在88%~90%,而玻璃的透光率则已下降至30.1%~30.5%.由图5给出的防雾照片可以看出,与玻璃相比,PVA及其海藻糖接枝物涂层均具有较好的热防雾与冷防雾性能.
图6给出了不同涂层防霜测试过程中的数码照片.结果表明,在-5℃下放置5 min时,玻璃表面已经开始结霜并变得模糊,而PVA涂层的中心部位也已出现了冰晶,并在34 min时冰晶已布满了整个样品表面;但直至43 min时,接枝率较小的C-P1涂层才开始结霜,C-P2,C-P3,C-P4和C-P5涂层均到60 min以后才开始结霜,且随接枝率升高有延迟结霜趋势.可见,与PVA相比,由于海藻糖的引入使得接枝物具有更强的亲水性,从而显著延迟了PVA-g-Tre涂层表面冰晶出现的时间,提高了该涂层的防霜性能.

Fig.4 Transmittance of different samples before(A)and after(B)being stored at-20℃for 45 min,and exposed quickly to a warm and humid surrounding(ca.20℃,55%relative humidity)

Fig.5 Photographs of the bare glasses and those covered with the coatings containing PVA and PVA-g-Tre in different grafting ratios over boiling water(ca.80℃,100%relative humidity)(A)and exposed quickly at ambient conditions(ca.20℃,55%relative humidity)after being stored at-20℃for 45 min(B)
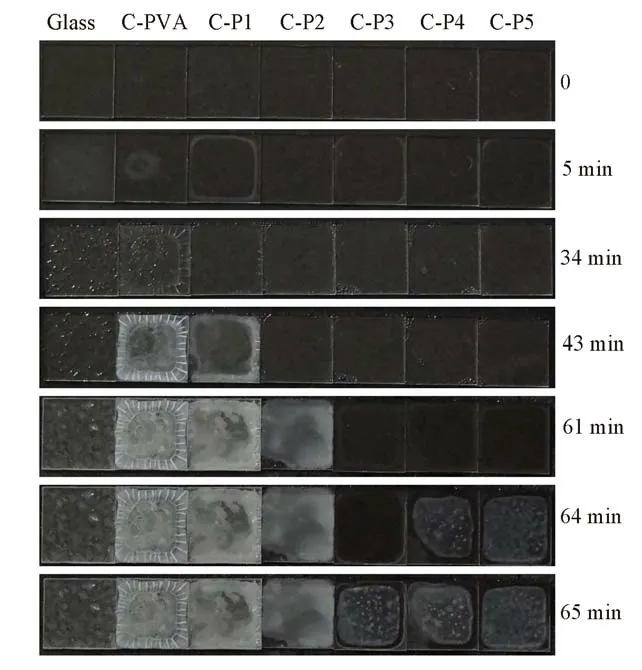
Fig.6 Optical images showing the frost formation on the bare glass and those covered with coatings with timeThe samples in 1 cm×1 cm were placed on a cooling stage controlled at-5℃,relative humidity of 50%.The time was recorded when the stage temperature cooled to-5℃from room temperature at a rate of 2℃/min.
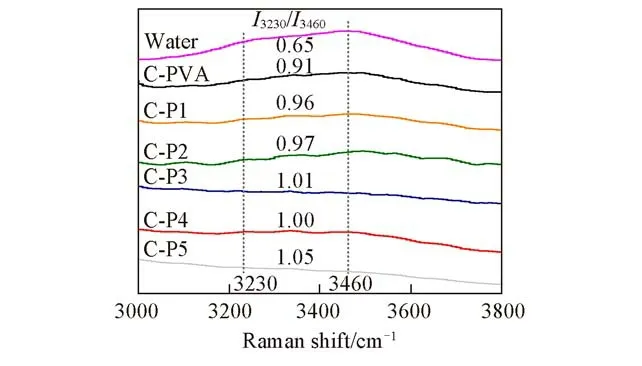
Fig.7 Raman spectra of water and the different coatings containing 3.02 mg/mg water measured at room temperature
为了进一步研究PVA与PVA-g-Tre涂层的防雾及防霜性能差别的原因,对涂层/水二元体系进行了拉曼光谱分析.从图7可以看出,纯水及涂层/水体系均在3230 cm-1和3460 cm-1处出现了水分子间氢键的特征峰[26,27],分别对应水的四面体结构强氢键作用和不完整四面体结构弱氢键作用,这两个峰的强度比(I3230/I3460)代表了两种氢键作用的相对强度[27].结果显示,涂层的强氢键作用均远高于纯水,且PVA-g-Tre涂层的强氢键作用均明显高于PVA涂层,随着接枝率增加,涂层的I3230/I3460比值由C-P1的0.96增加至C-P5的1.05,说明强氢键作用比例有所增加,即涂层与水分子间的强氢键相互作用有所加强,继而提高了涂层的亲水性和润湿性,并延缓了涂层表面结霜时间.
3 结 论
首先合成了几种不同接枝率的海藻糖接枝改性PVA,之后将PVA-g-Tre与少量EGDMA混合,并经光固化制备了含有PVA或不同接枝率PVA-g-Tre的亲水性SIPN涂层.经AFM、水接触角、热防雾和冷防雾测试及拉曼光谱分析表明,海藻糖接枝改性增强了PVA-g-Tre与水的相互作用,提高了涂层的亲水性和润湿性,接枝率最高为64.9%的SIPN涂层的水接触角在200 s内可降至(6.0±0.7)°,显著低于PVA涂层的(31.2±3.0)°.PVA-g-Tre涂层在保留了PVA涂层的防雾性能的同时,冷防雾时也可保持88%~90%的透光率,并显著提高了涂层的防霜性能,可延迟涂层表面的结霜时间至60 min以上.
