不同植物生长调节剂对银边玉簪组织培养的影响
2021-08-16孙忠奎于永畅关秋竹王江勇陶吉寒
乔 谦,王 雪,孙忠奎,于永畅, 关秋竹,王江勇*,陶吉寒
(1.山东省果树研究所, 山东 泰安 271000; 2. 泰安时代园林科技开发有限公司,山东 泰安 271000;3.泰安市泰山林业科学研究院 山东 泰安 271000; 4. 泰山学院,山东 泰安 271000)
玉簪属(Hosta)植物是百合科(Liliaceae)多年生宿根草本,主要分布在东南亚地区,在日本、朝鲜及我国的东部和南部地区均有广泛栽植[1-2]。耐旱,耐寒,喜阴,是一种重要的园林地被植物。玉簪除可供观赏外,其鲜花含有芳香油,可用于提取制作芳香浸膏;同时,玉簪的嫩芽可供食用,全草可入药。因此,近年来,玉簪已成为极具开发前景的野生花卉和药用植物,我国也陆续从美国和欧洲引进了不少优良品种进行栽培试验[3-4]。玉簪多于春、秋季分株繁殖,可播种或组织培养繁殖。银边玉簪(Hosta‘Slivery Edger’)为花叶玉簪类型,叶边缘乳白色,观赏价值更高,在我国的野生种类较少,多为从国外引进。但银边玉簪的童龄期相对普通绿叶玉簪较长,从播种到开花需至少3 a,且孕育种子很少,生产上用种子繁殖困难重重[5],因此采用组织培养技术是解决银边玉簪快速大量增殖的主要途径[6-7]。目前关于玉簪的组织培养研究主要集中在花叶玉簪、紫萼玉簪等物种上[5,8-10],对银边玉簪的组织培养技术鲜有报道。本试验研究了银边玉簪品种‘甜蜜’的组织培养技术,包括增殖的植物生长调节剂配比和瓶内生根的培养基配方,以期筛选出合理高效的玉簪增殖调节剂配比和生根培养基配方,完善移栽后的管理技术,为银边玉簪的组织培养工厂化育苗提供一定的理论与实践依据。
1 材料与方法
1.1 试验地点、时间及材料
本试验于2019年3—8月在山东省果树研究所生物技术组织培养研究室进行,材料为无病害、生长健壮的银边玉簪品种‘甜蜜’的嫩芽。外植体为前期培养所获得无病害、生长健壮的银边玉簪品种‘甜蜜’无菌苗的叶片。
1.2 试验方法
1.2.1 外植体材料的培养获取及其芽诱导 参考邱靖等[11]方法对‘甜蜜’嫩芽进行消毒处理,在备用培养基中培养14 d后,切取无污染的叶片作为外植体,接种于培养基(MS+2.0 mg/L 6-BA+1.0 mg/L NAA)上进行芽诱导。
1.2.2 不同植物生长调节剂配比对银边玉簪‘甜蜜’组织培养苗增殖的影响 参考张春梅等[12]、周建峰等[13]对花叶玉簪的研究,以MS 培养基为基础培养基,添加蔗糖30 g/L、琼脂7 g/L,pH值为5.8。分别添加不同质量浓度的6-BA(1.0,2.0,3.0 mg/L)和NAA(0. 1,0. 2,0. 3 mg/L),共计9种处理,每处理接种不定芽20个,重复3次。接种7 d后观察组织培养苗生长情况,培养30 d后统计总芽数、增殖倍数、苗高及生长状况。培养条件为温度(25 ± 2) ℃,光照时间为14 h / d,光照强度为2 000 lx。
1.2.3 不同培养基对银边玉簪‘甜蜜’组织培养苗生根的影响 在增殖培养基中生长30 d后,切取生长健壮的增殖芽苗,接种于添加不同质量浓度 NAA(0. 1,0. 3,0.5 mg /L)或IBA(0. 1,0. 3,0.5 mg /L)的1/2 MS培养基上,每处理接种20个,重复3次,培养25 d后统计生根情况,包括生根株数、生根率、平均根长等。培养条件为温度(25±2) ℃,光照时间为14 h / d,光照强度为2 000 lx。
2 结果与分析
2.1 不同激素配比对银边玉簪‘甜蜜’组织培养苗增殖的影响
不定芽接种14 d后,基部腋芽开始萌动而产生突起。随着培养时间的持续延长,腋芽呈现不同程度的增长,培养30 d后腋芽大小、增殖倍数及生长状况均存在差异(见表1)。根据表1,处理4中(2.0 mg /L 6-BA和0.1 mg /L NAA的MS培养基)银边玉簪的芽增殖总数最多,为198个,增殖倍数最高,为3.3,且植株叶片浓绿,长势健壮良好。其次分别为处理5(2.0 mg /L 6-BA和0.2 mg /L NAA的MS培养基)和处理3(1.0 mg /L 6-BA和0.3 mg /L NAA的MS培养基),2者增殖总芽数分别为168和150,增殖倍数分别为2.8和2.5,同样与其他处理差异显著,植株长势良好。此外,当6-BA质量浓度为3.0 mg /L时,银边玉簪的增殖总芽数减少,且生长状况较差,苗高降低,叶片颜色较淡。
2.2 不同培养基配方对玉簪增殖芽苗生根的影响
由表2看出,在1/2 MS培养基添加不同质量浓度的IBA和NAA均能促使银边玉簪生根。与NAA相比,相同质量浓度的 IBA 对银边玉簪生根的影响更为显著,生根率均在75%以上(处理1—3),且IBA 质量浓度为0. 3 mg/L时,培养25 d的生根率最高,为88.33%,平均根长1.7 cm,植株生长健壮,叶片浓绿。添加NAA的1/2 MS培养基生根效果整体较差(处理4—6),植株几乎不生根,且苗长势差,叶片发黄,其中质量浓度为 0.3 mg/L NAA 的玉簪生根率仅为3.33%,茎基部膨大,根粗短。
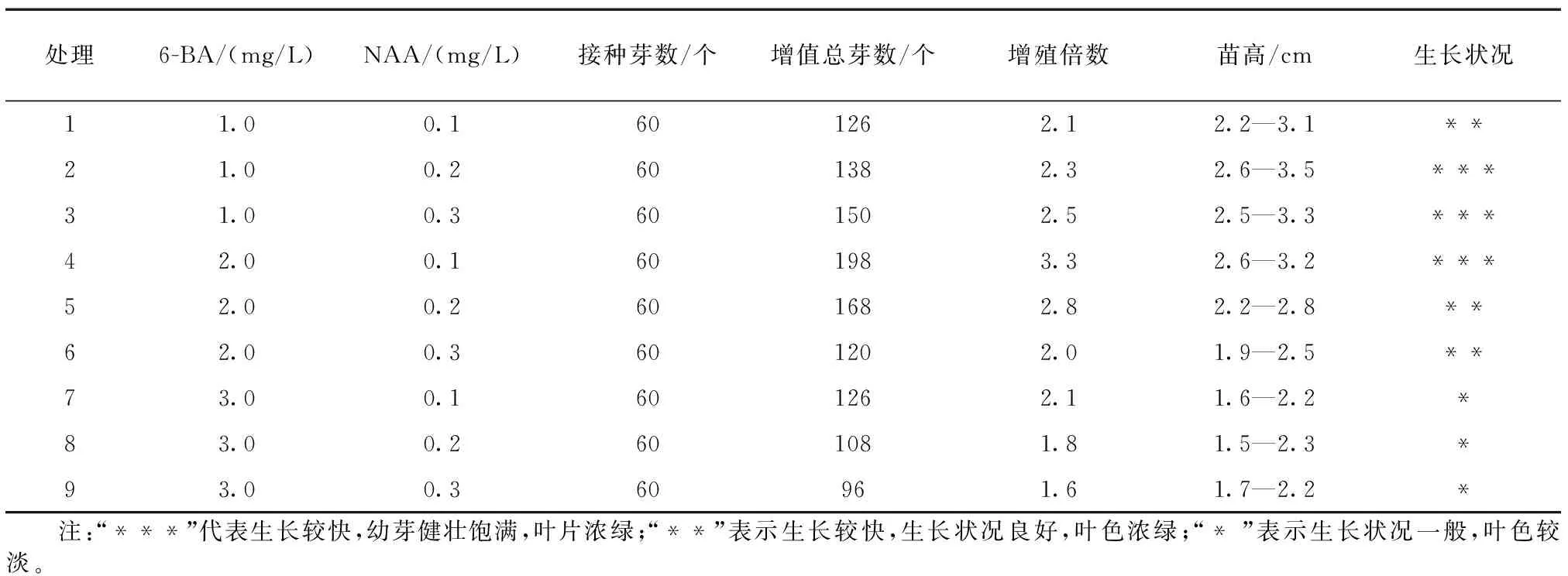
表1 不同生长调节物质处理下玉簪腋芽的增殖情况统计
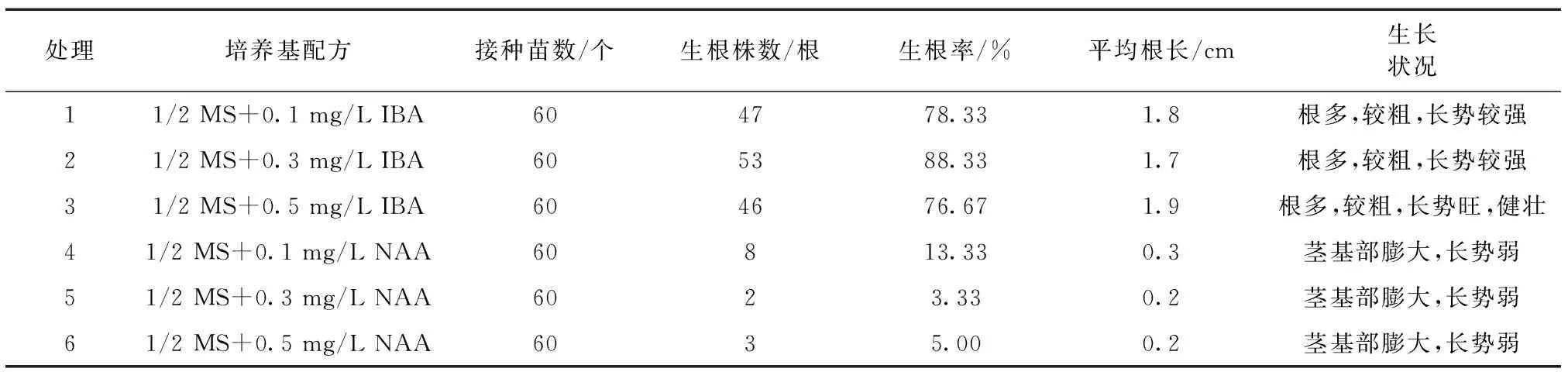
表2 不同激素条件下玉簪增殖芽苗的生根情况统计
3 结论与讨论
玉簪具有较强的耐荫抗寒抗旱等特性,在园林景观中应用广泛,常应用于树荫下片植或园林绿地中点缀,随着玉簪栽培应用面积的扩大,研究其生长繁育必不可少,尤其是组织培养工作在近年来受到越来越多的园艺研究者所关注,其可为玉簪生长发育及其生理或分子调控变化研究提供优良稳定的物质基础,保证试验材料的一致性,但关于各种激素的最适浓度,研究结果并不统一。前人研究报道6-BA 可促进芽分化及诱导愈伤组织发生,抑制根发育及衰老,其与 NAA 配合使用,能有效促进芽增殖与根诱导[14]。本研究也发现,最适合银边玉簪‘甜蜜’芽增殖的培养基为MS+2.0 mg /L 6-BA+0.1 mg /L NAA,培养30 d的增殖倍数为3.3,且植株叶片浓绿,长势健壮良好。但与唐渊等[15]的研究结果有所不同,其研究发现‘法兰西’与‘甜心’玉簪增殖芽分化效果最佳培养基为MS + 2. 0 mg /L 6-BA + 0. 2 mg /L NAA,而张春梅发现,最适合“花叶”玉簪增殖的培养基为 MS+3. 0 mg /L 6-BA+0. 1 mg /L NAA+0. 4 mg /L ZT[12],初步推测可能是由于不同基因型的培养材料在增殖过程中所需的激素浓度和激素组合有所不同[16]。本研究还发现,当6-BA质量浓度为3.0 mg /L时,“花叶”玉簪的增殖总芽数减少,且生长状况较差,苗高降低,叶片颜色较淡,说明较高的6-BA质量浓度会抑制玉簪的增殖。除6-BA,NAA 外,2,4-D,KT等激素也具有刺激植物生长、促进细胞分裂的作用,但目前未见有用在玉簪组织培养中的报道[17],这也是下一步玉簪组织培养研究的一个方向。
本研究表明不同质量浓度的IBA和NAA均能促使银边玉簪生根,但与IBA相比,NAA促生根能力较弱,生根率和平均根长均处于较低水平,几乎不生根,且组织培养苗长势较差,其中质量浓度为 0.3 mg/L NAA 的玉簪生根率仅为3.33%,说明NAA不适合银边玉簪的生根培养;而 IBA 对银边玉簪生根有明显影响,生根率均逾75%。本研究表明最适合银边玉簪‘甜蜜’的生根培养基为1/2 MS + 0.3 mg /L IBA,培养25 d生根率为88.33%,平均根长1.7 cm,植株生长良好,这与张春梅、周青等研究结果一致[12,14],同时也有研究认为IBA和NAA均能有效诱导玉簪生根[18-19],笔者推测这种差异更多与玉簪的品种有关。
