血清25-羟维生素D水平与急性胰腺炎预后的相关性
2021-08-16严妤函童智慧张兴虎万文辉
刘 瑜,黄 方,严妤函,童智慧,张兴虎,万文辉
0 引 言
维生素D(VD)是人体中一种重要的脂溶性维生素,通过调节机体钙磷代谢平衡,在维持神经肌肉正常功能和骨骼健康中具有重要作用。VD本身并无生物活性,需要在肝、肾羟化酶的作用下产生1,25二羟维生素D[1,25(OH)2D],后者是人体内主要的生物活性形式。活性VD与细胞内的VD 受体(Vitamin D receptor,VDR)结合通过调控靶基因转录和表达而介导复杂的生物学功能[1]。此外,VD还具有重要的炎症和免疫调节作用,免疫系统细胞,如活化的T、B淋巴细胞、中性粒细胞、抗原提呈细胞等均表达羟化酶和VDR。研究表明,VD缺乏与多种疾病风险和(或)严重程度增加相关,包括感染、自身免疫性疾病、心血管疾病、肿瘤、肌少症、骨关节炎和移植排斥反应等[2]。25-羟维生素D[25(OH)D]作为VD代谢中间产物,半衰期长达数周,且不受甲状旁腺素、血钙、血磷等影响。因而,血清25(OH)D被作为反映机体VD营养状况的金指标[3]。
急性胰腺炎(acute pancreatitis,AP)虽起始于胰腺局部,但通过大量释放炎性细胞因子产生全身炎症反应,除加重胰腺损伤外,部分患者还发生胰外重要器官的功能障碍,病死率高[4]。既往研究报道,危重症患者普遍存在VD不足或缺乏[5-9];但在AP患者中还缺少大规模研究。本研究在大样本AP患者中对25(OH)D水平进行检测,并对其与AP严重程度和临床预后的相关性进行分析,以期为临床早期识别AP危重患者,优化强化治疗方案和改善预后提供参考。
1 资料与方法
1.1 研究对象选择我院2018年1月至2019年12月消化内科和普通外科ICU住院的AP患者共508例。AP的诊断需符合以下3项中的2项:①急性、持续、严重的上腹部疼痛;②血清脂肪酶(或淀粉酶)活性≥正常值上限3倍;③影像学检查(通常采用增强CT)有AP的特征性表现[10]。纳入标准:①汉族;②年龄≥18岁;③AP诊断明确、病历资料齐全。排除标准:①无法获得知情同意书;②患有其他特殊疾病,如甲状旁腺疾病、获得性免疫缺陷综合征、自身免疫性疾病、器官移植后,严重的心、肝、肾、肺、脑等重要器官疾病;③曾摄入或应用过对炎症过程有调节作用的细胞因子,如TNF-α抗体等;④接受免疫抑制剂和激素治疗,经口服或其他途径补充外源性VD。脓毒症定义为感染导致危及生命的器官功能障碍。其诊断标准参照2016年美国重症医学会与欧洲重症医学会联合发布的脓毒症诊断新标准即感染+序贯器官衰竭(sequential organ failure score,SOFA)评分≥2分[11]。本研究经原南京军区南京总医院伦理委员会审核通过(2017NZGKJ-079);所有受试者或其家属均签署知情同意书。
1.2研究方法收集所有入组AP患者的一般人口学资料、个人史、既往史、发生AP的病因、实验室和辅助检查结果、治疗方式、住院时间、临床转归等。计算体重指数(BMI)、诊断AP后最高急性生理与慢性健康评分(acute physiology and chronic health evaluation, APACHE)Ⅱ和SOFA评分。所有患者在诊断AP两天内血生化管抽取静脉血3mL,凝固后离心收集上清,采用人25(OH) D ELISA试剂盒(上海酶联生物科技有限公司)按说明书方法对血清25(OH)D水平进行检测,通过试剂盒中标准品梯度浓度以及吸光度(OD值)绘制的线性回归方程,根据样品的OD值,计算出患者25(OH) D浓度。实验按照试剂盒说明设置复孔,最终结果取2次检测的均值,两次检测变异系数<10%。血清25(OH)D<20 ng/mL定义为VD缺乏(组);20 ng/mL≤25(OH)D<30 ng/mL定义为VD不足(组);25(OH)D≥30 ng/mL定义为VD充足(正常组)[12]。基于局部因素和全身因素对AP严重程度进行分级[13]。①轻型AP:不存在胰腺(胰周)坏死以及器官功能衰竭;②中型AP:存在无菌性胰腺(胰周)坏死和(或)暂时性的器官功能衰竭;③重型AP:存在感染性胰腺(胰周)坏死或者持续性的器官功能衰竭;④危重型AP:感染性胰腺(胰周)坏死合并持续性器官功能衰竭。
2 结 果
2.1 研究对象共收集AP患者508例,其中7例25(OH)D水平检测失败,故最终纳入统计分析的AP患者为501例,其一般人口学资料和临床特征见表1。501例AP患者中,男339例、女162例,年龄18~86岁,平均(44.83±13.81)岁。发生AP最常见的原因为胆源性(49.50%),其次为高脂血症性(43.91%),其他类型占6.59%。中位25(OH)D浓度为17.96(14.45~22.66)]ng/mL,VD不足171例(34.13%)、缺乏303例(60.48%)、充足27例(5.39%)。住院期间最高APACHE II评分(9.62±6.98)分,SOFA评分(2.60±3.17)分。收住ICU 311例(62.08%),发生脓毒症154例(30.74%)、重症AP(重型+危重型)206例(41.12%)、死亡47例(9.38%)。

表1 501例急性胰腺炎患者临床资料
2.2VD水平与AP严重程度的关系501例AP患者中,轻型140例(27.94%)、中型155例(30.94%)、重型77例(15.37%)、危重型129例(25.75%),见表2。VD缺乏和不足组具有较高的APACHE II评分和SOFA评分,收住ICU和发生脓毒症及死亡的频率较高,住院时间和住ICU时间延长,重型和危重型AP患者较VD充足组明显增多。随着AP严重程度加重,VD缺乏的发生率明显增加,见图1。25(OH)D水平与APACHE II评分(r=-0.208)、SOFA评分(r=-0.236)、住院总时间(r=-0.260)、住ICU时间(r=-0.309)、降钙素原水平(r=-0.184)、IL-6(r=-0.208)、CRP水平(r=-0.156)呈负相关。
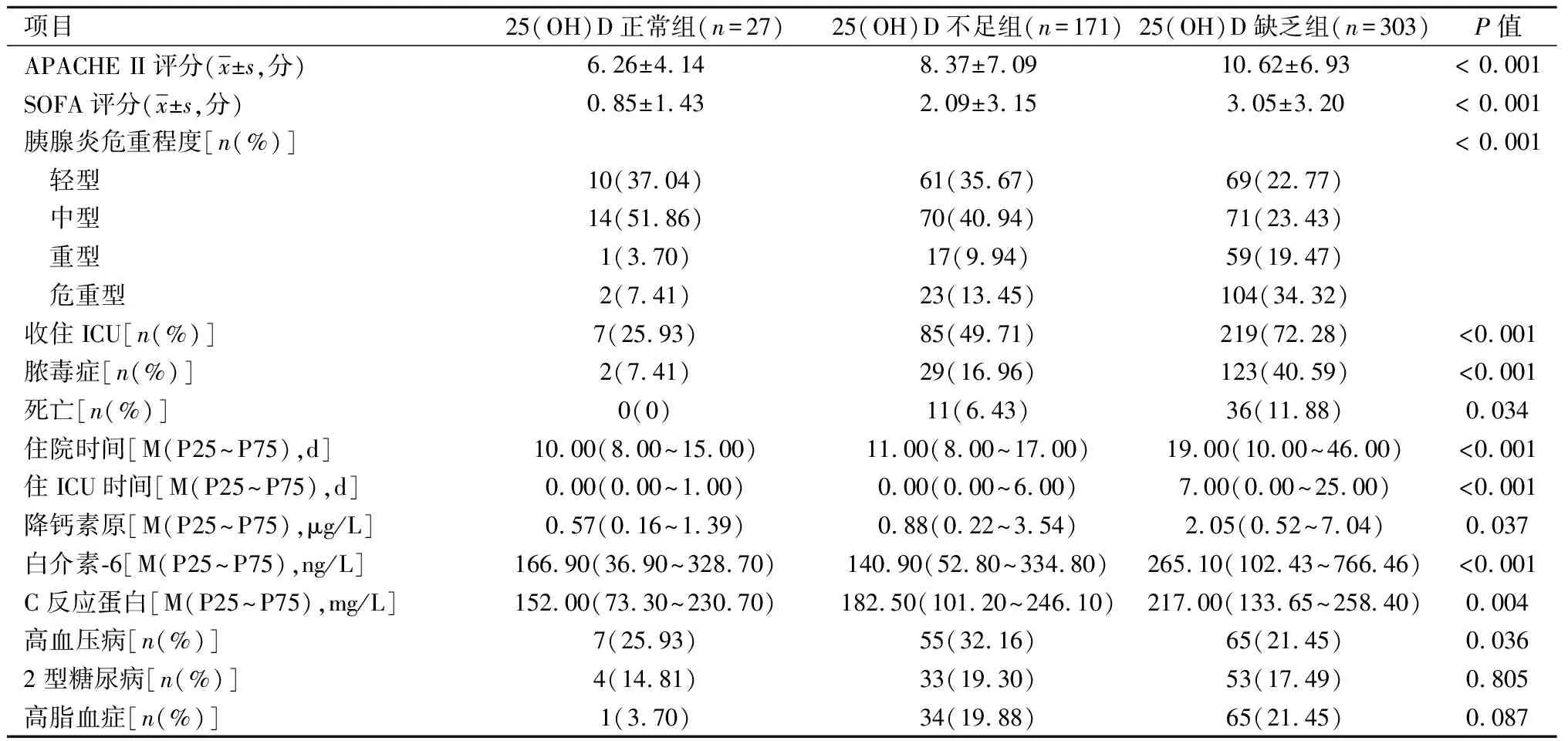
表2 维生素D水平与急性胰腺炎严重程度的关系

图1 不同急性胰腺炎严重程度组维生素D缺乏的发生率
2.3VD缺乏与AP患者发生脓毒症的相关性501例AP患者中154例(30.74%)发生脓毒症。与未发生脓毒症者相比,脓毒症者具有较高的APACHE II和SOFA评分、较长的住院和住ICU时间,较高的死亡率和炎性因子水平,较低的25(OH)D水平。校正年龄、性别、BMI、吸烟饮酒状态、既往史后,非条件Logistic回归分析示,VD缺乏是AP患者发生脓毒症的独立危险因素,与脓毒症风险增加相关[OR(95%CI)=3.768(2.368~5.997),P<0.01]。见表3。

表3 维生素D缺乏与急性胰腺炎患者发生脓毒症的多因素分析
2.4VD缺乏与AP患者进展为重症的关联501例AP患者中206例(41.12%)进展为重症。与非重症相比,重症者BMI偏高,有较高的APACHE II和SOFA评分、较长的住院和住ICU时间,较高的死亡率和炎性因子水平,较低的25(OH)D水平。校正年龄、性别、BMI、吸烟饮酒状态、既往史后,非条件Logistic回归分析示,VD缺乏是AP患者进展为重症的独立危险因素,可增加重症AP的发生风险[OR(95%CI)=4.297(2.806~6.582),P<0.01]。见表4。

表4 维生素D缺乏与急性胰腺炎患者进展为重症的多因素分析
2.5VD缺乏与AP患者死亡的关联501例AP患者中,47例(9.38%)发生死亡。与存活者相比,死亡者具有较高的APACHE II和SOFA评分、较长的住院和住ICU时间,较高的死亡率和炎性因子水平,较低的25(OH)D水平。校正年龄、性别、BMI、吸烟饮酒状态、既往史后,非条件Logistic回归分析示,VD缺乏是AP患者死亡风险增加的独立危险因素[OR(95%CI)=2.406(1.162~4.984),P=0.018]。见表5。

表5 维生素D缺乏与急性胰腺炎患者死亡的多因素分析
3 讨 论
VD通过对免疫系统进行调节,能促进机体对病原微生物清除、防止炎性细胞因子过度产生、增强机体免疫耐受、降低机体炎症反应、减少组织损伤等[2]。既往研究报道危重症患者普遍存在VD不足或缺乏(26-82%)[15-16],且VD缺乏与疾病严重程度、器官功能不全、住ICU时间和死亡率增加相关。胰腺炎患者也存在25(OH)D水平低下。Abou Saleh等[17]报道AP患者较非AP患者,VD缺乏、骨质疏松和骨折的发生率明显增高;Bang等[7]报道超过40%的AP患者入院时存在严重VD缺乏(<20 nmol/L ≈ 8 ng/ml);Teichmann等[9]发现绝经前女性慢性胰腺炎患者VD水平明显低于健康对照组;荟萃分析[6]也表明慢性胰腺炎患者有较高的VD不足或缺乏的发生率,分别为83%和65%;Huh等[5]在韩国人群中发现56.2%的AP患者存在VD缺乏, 28.5%存在VD不足。国内林伟仁[18]、冯思青[19]等也报道了类似的结果。与既往研究结果相同,本研究中AP患者也普遍存在VD不足(34.13%)或缺乏(60.48%),且与AP严重程度相关。VD缺乏和不足组重型和危重型AP患者明显增多,且随着AP严重程度加重,VD缺乏者所占比例明显增加。血清25(OH)D水平与APACHE Ⅱ评分、SOFA评分、住院总时间、住ICU时间、降钙素原、IL-6和CRP水平呈负相关。分析胰腺炎患者VD变化的原因主要有:①来源减少。人类VD主要来源于皮肤内7-脱氢胆固醇经阳光紫外线照射和食物中摄取VD[1]。胰腺炎患者由于食欲不振、禁食、日照减少等,VD来源减少。但鉴于25(OH)D的半衰期为1~2月,来源减少并不能完全解释AP患者VD的这种变化[3]。②炎症反应。Bang[7]和Huh[5]等均报道AP患者血浆25(OH)D与CRP水平呈负相关。本研究也发现25(OH)D与炎症指标降钙素原、CRP、IL-6呈负相关,表明AP的炎症状态与血清25(OH)D水平显著降低密切相关。研究表明,炎症时活化的单核巨噬细胞通过羟化酶将25(OH)D转化成1,25(OH)2D,后者通过与VDR结合促进细胞色素 P450 家族成员24A1(CYP24A1)表达,CYP24A1可增加25(OH)D和1,25(OH)2D降解[20]。炎症时热休克蛋白(heat shock protein, Hsp)70表达增加促进其与细胞内25(OH)D的结合,导致细胞内的25(OH)D增多[21],促进了上述25(OH)D向1,25(OH)2D的转化和降解。严重感染时维生素D结合蛋白(vitamin D-binding protein, VDBP)减少,导致肾脏25(OH)D 重吸收减少[22]。因此25-(OH) D水平下降可能是炎症反应的结果,而不是AP的原因。③血钙降低,钙离子的下降会增加甲状旁腺激素的分泌,从而增加25(OH)D的肾源性代谢[7]。
虽然VD在炎症和免疫调节过程中有重要作用,但VD缺乏与AP预后的相关性报道较少且样本量偏小。Huh等[5]对242例AP患者进行分析,发现VD缺乏是收住ICU和重度AP的危险因素;冯思青[19]在42例中-重度AP患者中发现VD缺乏与3个月内有无局部并发症相关。本研究纳入了501例AP患者,根据不同预后进行分组,校正年龄、性别、吸烟饮酒状态、既往史后,回归分析发现VD缺乏者脓毒症、重症AP、死亡发生率明显增加。因此,血清25(OH)D作为一种简便易得的指标是预测AP预后的有效生物标志物。
本研究存在一定的不足:虽是前瞻性设计,但AP患者均来自同一医院,且我院为全国知名急性重症胰腺炎诊治中心,重型和危重型AP患者比例较高,因此存在选择偏倚;仅对诊断AP 2天内的25(OH)D水平进行检测,没有对25(OH)D水平进行动态观察;影响血清25(OH)D水平的因素较多,没有对季节因素(光照)、食物摄入种类进行分析。综上,本研究结果具有较好的临床意义,除了其他已知的预测因素,如降钙素原、D-二聚体、CRP等,VD缺乏可成为预测AP不良预后的独立危险因素。血钙降低与AP严重程度相关,由于AP患者普遍存在VD缺乏或不足,外源性补充VD是否能改善AP患者预后还需要进一步行前瞻性研究[23]。
