miR-195真核表达载体的构建与生物信息学分析及其靶向PD-L1介导淋巴细胞增殖的实验研究
2021-08-16罗小琴刘朝奇邹云雷李晓晓
罗小琴,赵 云,刘朝奇,邹云雷,李晓晓
0 引 言
微小RNA(microRNA, miRNA)是一类长度约21~25个核苷酸的非编码小单链RNA,通过与靶mRNA 3′非翻译区部分或完全互补,以促进其降解或抑制翻译,从而实现对靶基因转录后的调控。miRNA的异常表达与各种癌症相关,其不仅可作为肿瘤抑制基因或癌基因,还是肿瘤微环境的关键调节因子,在细胞增殖、分化、凋亡、迁移和侵袭等生物学过程中发挥重要的调节作用[1-2]。研究表明miRNA不仅可作为肿瘤诊断和预后的生物标志物,还可作为肿瘤免疫治疗的新靶标,对提高癌症患者生存率具有十分重要意义[3-4]。Cao等[5]研究发现,在脂肪肉瘤组织和细胞中miR-195表达降低,而通过上调miR-195的表达量可抑制肿瘤细胞的生长、增殖和迁移,并能促进肿瘤细胞的凋亡。Chen和Wang[6]研究发现,miR-195在肝癌细胞和血清中的表达下调,且miR-195表达水平与淋巴结转移和TNM分期有关,而通过使用miR-195模拟物来过表达miR-195可抑制肿瘤细胞的增殖,迁移和侵袭,表明miR-195可作为肝癌患者的新型诊断标志物参与肝癌的发展。在肿瘤微环境中,肿瘤细胞高表达的程序性死亡配体1(programmed cell death-Ligand 1,PD-L1)可与T细胞表面高表达的程序性死亡受体 1 (programmed cell death protein 1,PD-1)结合,持续激活PD-1/PD-L1信号通路,抑制T细胞的活化和增殖,诱导T细胞的功能丧失,从而使肿瘤细胞逃避机体的免疫监视和杀伤,而阻断 PD-1/PD-L1 信号通路可以逆转肿瘤免疫耐受状态,增强抗肿瘤免疫效应[7]。本研究旨在构建miR-195真核表达载体,研究其与肝癌细胞中PD-L1的关系及其对淋巴细胞增殖的影响,并通过生物信息学预测miR-195的靶基因,并对靶基因结合进行信号通路分析。
1 材料及方法
1.1 主要材料与设备SPF级雌性Bal b/c小鼠、体重18~20 g由三峡大学实验动物实验中心提供,实验动物合格证号(NO.42010200004833),饲养环境:20~25 ℃,(50±5)%相对湿度,12 h昼夜循环光照,标准喂养。人源性肝癌细胞瘤株HepG2、鼠源性肝癌细胞瘤株H22、真核表达载体pcDNA3.1(+)由三峡大学肿瘤微环境与免疫治疗湖北省重点实验室提供;RNA 提取试剂盒、大肠埃希菌DH5α感受态细胞 、质粒提取及纯化试剂盒购于Vazyme公司;限制性内切酶EcoRⅠ和XhoI、T4 DNA连接酶、RNA逆转录试剂盒购于Takara公司;转染试剂Turbofect购于Thermo Scientific公司;PCR仪购于美国 Whatman Biometra公司;流式细胞仪购于Biosciences公司。
1.2方法
1.2.1 miR-195引物设计和基因扩增在GenBank 获取miR-195的基因组序列,采用Primer 5.0设计引物,引物上游序列为:aggtGAATTCCACAC TGTGGTGTTA GAGC,下游序列为:aggtCTCGAGCTGTTCCCTC TTCTCTCC,其中上游引物中含有EcoRⅠ酶切位点,下游引物中含有XhoⅠ酶切位点。以正常宫颈脱落细胞DNA为模板,通过PCR扩增得到miR-195前体。PCR循环条件:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸3 min,共30个循环。用纯化试剂盒对PCR扩增产物进行纯化,取5 μL纯化后的目的片段,用1%的琼脂糖凝胶电泳检测产物条带。
1.2.2miR-195真核表达质粒的构建用EcoRI、Xhol分别连续单酶切纯化后的目的片段与空载体pcDNA3.1(+),再用纯化试剂盒纯化。用T4 DNA连接酶将二者连接过夜,将连接产物转化至DH5α感受态细胞,置于氨苄抗性平板上,37 ℃培养箱培养过夜,次日挑选单克隆菌落摇菌后进行质粒抽提。将重组质粒pcDNA3.1-miR-195通过EcoRI单酶切进行鉴定,以pcDNA3.1(+)为对照,并将鉴定正确的质粒送至武汉生工生物工程股份有限公司进行测序。
1.2.3miR-195靶基因预测使用在线靶基因预测工具miRPathDB、miRWalk、GeneCards预测miR-195的靶基因,为降低结果假阳性率,取这3个数据库交集作为预测靶基因的结果。通过在线工具DIANA tools绘制韦恩图,得到交集靶基因,并将3个数据库中都存在靶向关系的基因用于后续分析。
1.2.4质粒转染细胞及分组取对数生长期的HepG2或H22细胞,以5×105/mL接种于6孔板中,待细胞密度达60%~70%时,用转染试剂Turbofect将pcDNA3.1(+)、pcDNA3.1-miR-195分别转染入HepG2与H22细胞系中培养48h。设立空白对照组、pcDNA3.1组及实验组(miR-195组)。
1.2.5RT-PCR检测HepG2细胞中miR-195及PD-L1的表达将HepG2细胞转染48 h后,在无菌操作台中用Trizol法提取总 RNA 并逆转录为cDNA,其中,miR-195的逆转录引物为:gtcgtatccagtgcagggtccgaggtattcgcactggatacgacGCCAATATTT;PD-L1为试剂盒提供的Oligo dT Primer和Random 6 mers。采用RT-PCR检测HepG2细胞中miR-195和PD-L1表达水平,循环条件为:95 ℃预变性20 s,95 ℃变性3s,60 ℃退火30 s,72 ℃延伸1 min,共30个循环,每个样品重复3次,采用相对定量法分析实验数据。
1.2.6流式细胞仪检测肿瘤细胞表面PD-L1蛋白表达将pcDNA3.1(+)、pcDNA3.1-miR-195转染HepG2细胞48 h后,用PE标记的PD-L1抗体与肿瘤细胞共培养1 h后,流式细胞仪检测PD-L1蛋白的表达情况。
1.2.7流式细胞术检测miR-195对小鼠脾淋巴细胞增殖的影响将Balb/c H22荷瘤小鼠处死后,在超净台中分离小鼠脾,研磨得到脾淋巴细胞,然后加入绿色荧光染料CFDA-SE(Carboxyfluorescein Diacetate Succinimidyl Ester)标记淋巴细胞。将标记后的淋巴细胞加入到经pcDNA3.1(+)、pcDNA3.1-miR-195转染48 h的H22细胞中共培养,48 h后在流式细胞仪上检测淋巴细的胞增殖情况。实验分为4组:淋巴细胞组(L组),淋巴细胞+H22细胞组(L+T组),淋巴细胞+H22细胞+ pcDNA3.1组(L+T+pcDNA3.1组)和淋巴细胞+H22细胞+pcDNA3.1-miR-195组(L+T+miR-195组)。
1.2.8miR-195预测靶基因生物功能及信号通路富集分析应用DAVID6.8数据库,将miR-195的预测靶基因进行基因本体论数据库(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析,GO功能主要包括细胞成分(cellular component) 、分子功能(molecular function)、生物过程(biological process) ,并通过R语言ggplot 2安装包对预测结果进行分析和图形绘制,显著相关基因P<0.05。
1.3统计学分析采用SPSS 19.0软件进行统计分析,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P≤0.05表示差异具有统计学意义。
2 结 果
2.1 pri-miR-195 PCR扩增及序列分析从正常宫颈脱落细胞提取DNA,以其为模板,PCR扩增得到大小为400 bp特异性条带,条带清晰明亮,与预期产物大小相符,且无非特异性扩增杂带,见图1。
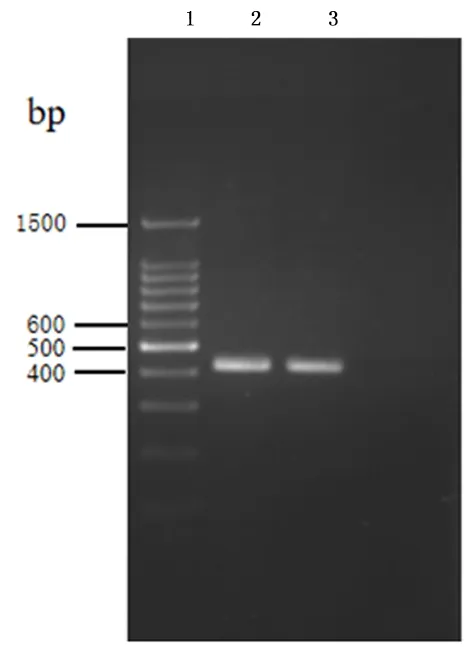
1:Maker; 2、3:pri-miR-195
2.2miR-195真核表达载体的构建和鉴定用EcoRI和Xhol分别连续单酶切空载体pcDNA3.1(+)及PCR扩增产物,将目的片段特异插入空载体pcDNA3.1(+)的相应酶切位点。将重组质粒pcDNA3.1-miR-195与pcDNA3.1(+)经EcoRI单酶切后进行鉴定,pcDNA3.1-miR-195分子量大小较空载体pcDNA3.1(+)增大,说明真核表达载体pcDNA3.1-miR-195构建成功,见图2。

1:Maker; 2、3:pcDNA3.1; 4、5:miR-195
2.3miR-195与PD-L1的靶向关系验证生物信息学预测PD-L1为miR-195的靶基因,miR-195与PD-L1部分碱基存在互补配对现象,结合位点见图3。RT-PCR结果显示,pcDNA3.1-miR-195转染后的HepG2细胞中miR-195表达量显著高于对照组和pcDNA3.1组,而PD-L1的表达量显著低于对照组和pcDNA3.1(+)组,差异具有统计学意义(P<0.01),见表1。

图3 miR-195与PD-L1结合位点
表1 pcDNA3.1-miR-195转染HepG2细胞后miR-195及PD-L1 mRNA表达水平
此外,流式细胞仪结果显示对照组(44.37±2.35)和pcDNA3.1组(43.86±1.20)中PD-L1表达量明显升高,而miR-195组中PD-L1表达量(20.33±1.03)显著降低(P<0.01),见图4。
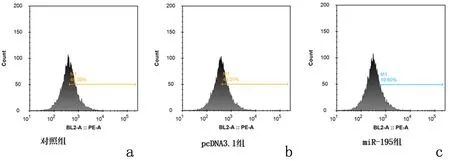
a:对照组; b:pcDNA3.1组; c:miR-195组
2.4miR-195对小鼠脾淋巴细胞增殖的影响与L组(1.455±0.050)淋巴细胞增殖比较,L+T组(1.280±0.141)和L+T+pc-DNA3.1组(1.240±0.424))降低,差异具有统计学意义(P<0.05);L+T+miR-195(1.640+0.099)组与L+T组相比,淋巴细胞增殖增高,差异具有统计学意义(P<0.05);L+T+pc-DNA3.1组与L+T组相比,淋巴细胞增殖差异无统计学意义(P>0.05),见图5。
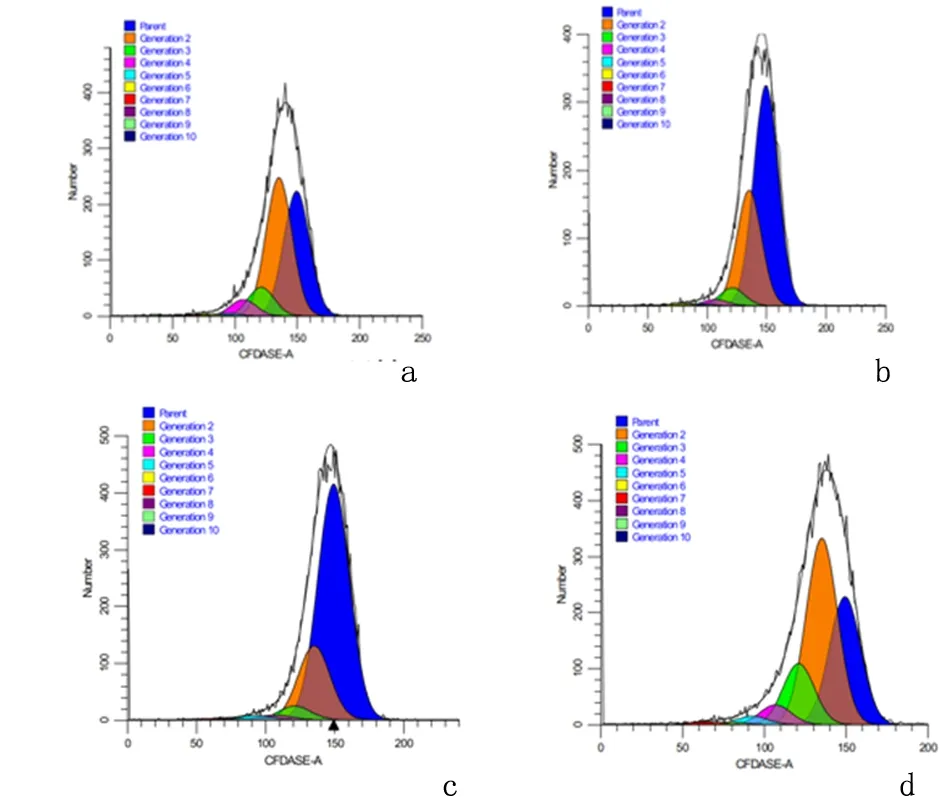
a:L组; b:L+T 组; c:L+T+pcDNA3.1组; d: L+T+miR-195 组
2.5miR-195的靶基因预测结果使用miRPathDB、miRWalk、GeneCards 3个在线数软件预测miR-195的靶基因分别为8212、651、7297个,三者取交集得到342个交集靶基因,见图6。

图6 数据库预测miR-195靶基因
2.6miR-195预测靶基因GO功能及KEGG信号通路分析GO功能富集分析提示miR-195靶基因主要位于细胞膜、细胞质、细胞质溶胶等细胞组件中,参与蛋白质结合、ATP结合、转录因子活性等分子功能,涉及以DNA为模板的转录调控、RNA聚合酶Ⅱ启动子对转录的正/负调控、蛋白质磷酸化等生物过程。KEGG信号通路分析提示miR-195主要富集在PI3K-Akt、MAPK、Hippo和Wnt等信号通路。见图7,表2-表5。
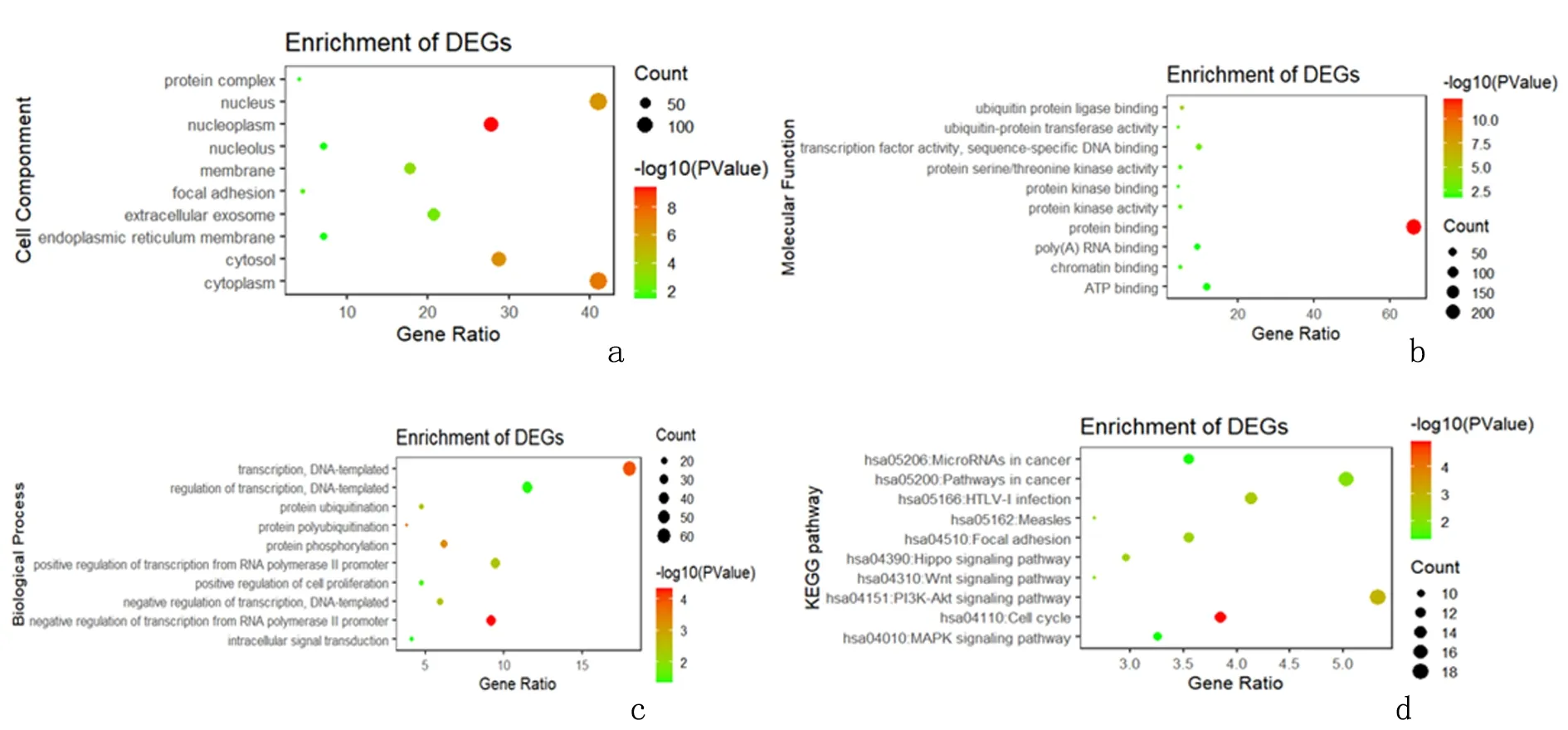
a:miR-195 靶基因细胞成分; b:miR-195 靶基因分子功能n; c:miR-195 靶基因生物过程;d:miR-195靶基因KEGG信号通路

表2 miR-195预测靶基因的细胞成分
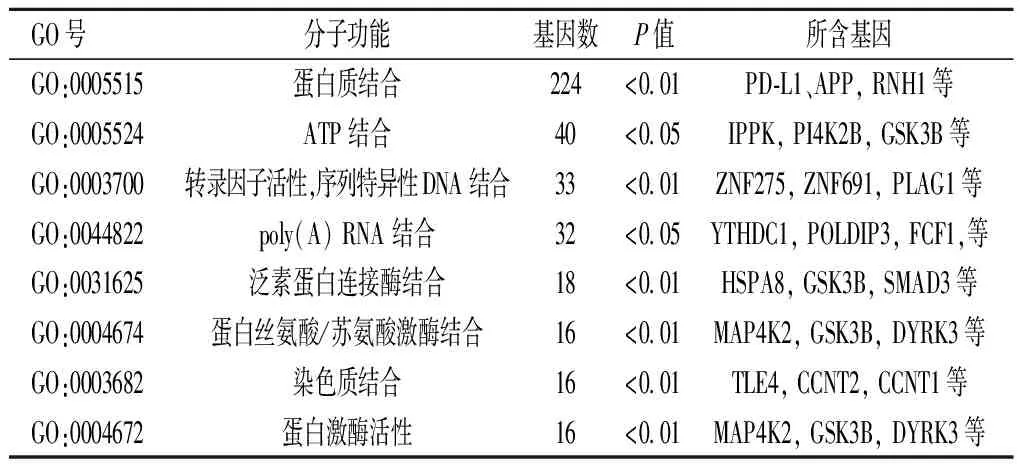
表3 miR-195预测靶基因的分子功能
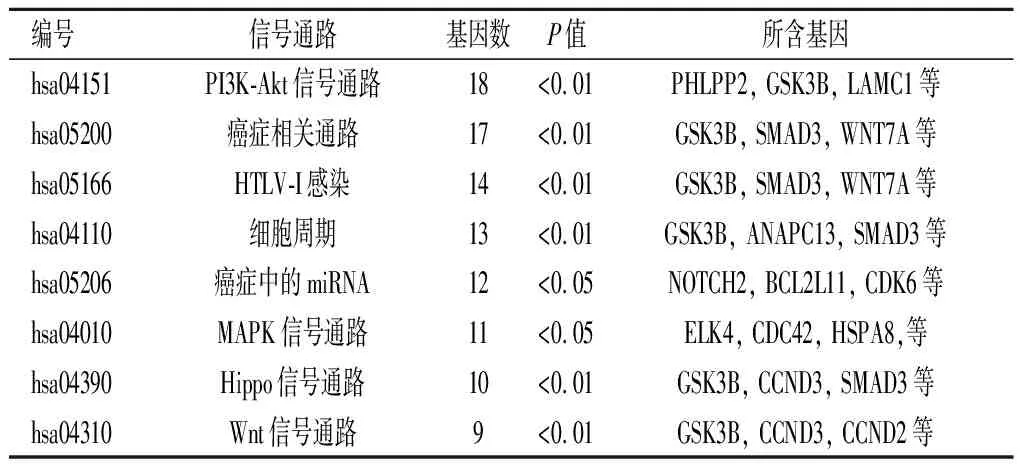
表5 miR-195预测靶基因的KEGG信号通路分析
3 讨 论
miRNA作为抑癌或致癌基因在转录后水平调控基因表达,与肿瘤的发生、发展密切相关。深入研究miR-195与肿瘤的相关性有望为临床肿瘤诊断与治疗提供新思路。研究发现,miR-195可作为乳腺癌早期检测的一种新的非侵入性生物标志物,miR-195的低表达与肿瘤分化程度、淋巴结转移和临床分期之间存在显着相关性[9]。在直肠癌中,miR-195通过靶向调控PI3K-Akt信号通路抑制肿瘤细胞的迁移和侵袭[10]。Sun等[11]研究发现,miR-195通过靶向Hippo-YAP信号通路抑制结直肠癌的增殖、迁移、侵袭和上皮间质转化,同时miR-195的低表达水平与结直肠癌患者的总体存活率差显着相关。Zhao等[12]研究发现,miRNA-195在胃癌组织和血清中低表达,但YAP高表达。双重荧光酶报告基因显示,miR-195和YAP之间存在靶向关系,过表达miR-195可通过抑制YAP介导的Wnt /β-catenin通路,抑制细胞增殖和侵袭并促进细胞凋亡。在小细胞肺癌中,miRNA-195通过抑制Rap2C蛋白依赖性MAPK信号转导来促进细胞凋亡并抑制小细胞肺癌细胞的增殖[13]。上述研究表明,miR-195功能广泛,可能在肿瘤细胞的增殖、凋亡、迁移、侵袭等生物学方面具有重要调节作用。
研究证实,PD-1/PD-L1信号通路是肿瘤免疫抑制的重要组成部分,可抑制CD8+细胞毒性T淋巴细胞的存活和增殖,并影响肿瘤浸润性T细胞的功能,最终抑制免疫反应并诱导肿瘤的免疫耐受[14]。近年来,PD-1/PD-L1免疫检查点抑制剂在肿瘤的临床治疗中显示出较好的安全性和疗效。He等[15]等研究发现,弥漫性大B细胞瘤组织中miR-195表达下调,PD-L1表达上调,过表达miR-195可通过靶向PD-L1促进IFN-γ和TNF-α的分泌,从而减弱弥漫性大B细胞瘤的免疫逃逸,增强抗肿瘤免疫。同时研究发现,miR-195可通过阻断PD-L1免疫检查点,在肿瘤微环境中激活T细胞来增强放疗敏感性[16]。此外,临床前研究表明,PD-1/PD-L1抑制剂通过选择性阻断PD-1/PD-L1信号通路,对延长晚期肝癌患者的中位无进展生存期、提高患者生存质量已显示出优势[17-18]。然而在肝癌细胞中,miR-195与PD-L1的表达情况和作用机制文献报道较少。
本研究成功构建pcDNA3.1-miR-195真核表达质粒,通过在线数据库预测出miR-195的靶基因,并对靶基因集合进行GO功能及KEGG信号通路分析。结果发现miR-195主要调控以DNA为模板的转录调控、RNA聚合酶Ⅱ启动子对转录的正/负调控、蛋白质磷酸化等生物过程,参与PI3K-Akt、MAPK、Hippo和Wnt等信号通路。此外,生物信息学分析预测出PD-L1为miR-195的靶基因。本研究将成功构建的重组质粒转染入肝癌细胞后,进一步分析miR-195与肝癌细胞中PD-L1的关系及其对淋巴细胞增殖的影响。RT-PCR及流式细胞仪结果显示,miR-195表达量的升高会不仅会降低肿瘤细胞PD-L1的表达,还能促进淋巴细胞的增殖。这可能是由于降低PD-L1的表达量会特异性阻断PD-1/PD-L1信号通路,进而解除肿瘤免疫耐受状态,恢复肿瘤特异性T细胞对肿瘤细胞的杀伤,从而会促进T淋巴细胞的增殖。此外,生物信息学分析预测出miR-195的相关通路,为后续研究miR-195在肝癌发生、发展过程中潜在的分子作用机制提供依据。
