QuEChERS-液相色谱-串联质谱法测定海参中敌敌畏
2021-08-15张玲丁洪流纪丽君叶湖山珊吴翠玲
张玲,丁洪流,纪丽君,叶湖 ,山珊,吴翠玲
1.苏州市食品检验检测中心(苏州 215104);2.苏州市产品质量监督检验院(苏州 215104);3.安捷伦科技(中国)有限公司(北京 100102)
海参齐名于鱼翅、燕窝和人参,被公认为世界八大珍品之一,含有生物活性物质,如皂苷、不饱脂肪酸和蛋白质[1-2],是一种低脂肪、高蛋白食物。其营养价值高,具有延缓性腺衰老、提高记忆力、抗肿瘤及防止动脉硬化等作用。随着海参营养价值知识的普及,海参也作为一道菜品逐渐进入百姓的餐桌。正是由于海参在市场上十分走俏,即产生了行业乱象,已有调查表明海参产品良莠不齐,消费者对其难辨优劣,商家为了获取暴利,加胶基加糖现象已成了行业公开的秘密。另外,养殖环境对海参的品质有较大决定作用,央视“3·15晚会”曝光了海参养殖中使用敌敌畏现象的普遍性,海参养殖户在池塘中加入敌敌畏,其目的是清理池塘中的螃蟹、鱼虾等生物,而海参对敌敌畏的抗药性较强,不会被药死。按照我国农药管理条例规定,农药使用者不得扩大农药的使用范围,而敌敌畏的使用范围显然不包括海参养殖。敌敌畏具有高效、快速、广谱性等特点,是目前应用最为广泛的有机磷杀虫剂[3],可用于农作物杀虫,但应有安全间隔期,一般规定在农作物收获前7 d停止用药。GB 2763—2019[4]对敌敌畏这种有机磷农药残留检测方法的具体规定为谷物按照GB 23200.113[5]、GB/T 5009.20[6]、SN/T 2324[7]方法检测;油料和油脂按照GB 23200.113[5]、GB/T 5009.20[6]方法检测;蔬菜、水果按照GB 23200.8[8]、GB 23200.113[5]、GB/T 5009.20[6]、NY/T 761[9]方法检测;调味料按照GB 23200.113[5]方法检测。另外,对敌敌畏的检测方法研究还有气质联用法[10-11]、液质联用法[12]等。以上这些方法更多见诸于对蔬菜、水果、谷物、油料和油脂等的检测。由于海参具有丰富的蛋白质,比果蔬等农药残留分析更为复杂,在现行农残分析标准中未见针对海参中敌敌畏的检测方法。
QuEChERS是一种在农产品方面检测的快速样品前处理技术[13],具有操作简单、环保经济和适用范围广等特点。此次试验旨在建立一种基于QuEChERS前处理的高效液相色谱-串联质谱(High performance liquid chromatography tandem mass spectrometry,HPLCMS/MS)测定海参中敌敌畏方法,为执法提供依据。
1 材料与方法
1.1 材料与试剂
海参样品(市售);敌敌畏(质量浓度为100 μg/mL,北京坛墨质检科技有限公司);QuEChERS萃取试剂盒(EN 15662,安捷伦科技有限公司);Captiva EMR-Lipid固相萃取柱(200 mg,3 mL,安捷伦科技有限公司);甲醇、乙腈(色谱纯,美国Thermo Fisher公司);甲酸、甲酸铵(质谱级,苏州精密化学科技有限公司);试验用水为超纯水。
1.2 仪器与设备
AgilentQQQ-6470、高效液相色谱仪(安捷伦科技有限公司);Mili-Q型超纯水仪(美国密理博公司);ME204E电子天平(梅特勒-托利多集团);Multi Reax自动涡旋仪(德国Heidolph公司);MD200-1氮吹仪(杭州奥盛仪器有限公司)。
1.3 试验方法
1.3.1 敌敌畏标准溶液的配制
标准储备液:精密称取敌敌畏标准品,用甲醇溶液配制成质量浓度为10 μg/mL的溶液,作为标准储备液。
空白样品提取液:用不含敌敌畏残留的样品,按照1.3.2制备空白样品提取液。
标准工作溶液:精密吸取适量工作溶液,用甲醇溶液稀释成质量浓度为5,10,20,50和100 ng/mL标准工作溶液。
1.3.2 样品前处理
称取5 g(精确到0.001 g)鲜海参样品,置于50 mL离心管中,加入3 mL水,加陶瓷均质子涡旋1 min;加入10 mL乙腈,振荡3 min,加入Bond Elut QuEChERS EN萃取盐包,剧烈振荡1 min,以8000 r/min低温离心10 min,取2.4 mL乙腈提取液,置于15 mL离心管中,加0.6 mL水涡旋,过Captiva EMR-Lipid柱,重力自流,接收流出液,抽干小柱,合并接收液于15 mL离心管中,收集流出液在30 ℃条件下氮吹至小于1 mL,用乙腈定容至1 mL,过0.22 μm滤膜上机分析。
1.3.3 测定条件
1.3.3.1 液相色谱条件
色谱柱:Agilent Poroshell 120 SB-C18(2.7 μm,3.0 mm×100 mm);流动相A:0.1%(V/V)甲酸-2 mmol/L乙酸铵;流动相B:0.1 %(V/V)甲酸-乙腈。梯度洗脱程序:0 min 80% A,4.0 min 10% A,6.0 min 10% A,6.5 min 80% A,9 min 80% A;流速:400 μL/min;柱温:30 ℃;进样量:5 μL。
1.3.3.2 质谱条件
离子化方式:正离子源喷雾(Positive electrospray ionization,ESI+),多反应监测(Multi reaction monitor,MRM)采集模式;干燥器温度250 ℃,干燥器流速7 L/min,雾化器电压30 psi,鞘气温度325 ℃,鞘气流速11 L/min,碰撞能量3500 V,喷嘴电压500 V。
1.4 数据处理
定性分析:在相同的色谱条件和质谱条件下,对照敌敌畏物质标准品定性离子以及出峰时间,对样品中敌敌畏物质进行定性分析。
定量分析:通过不同敌敌畏物质定量离子的峰面积,根据敌敌畏物质标准曲线的回归方程,计算样品中敌敌畏成分的含量。
2 结果与分析
2.1 质谱条件的优化
取敌敌畏标准品,采用多反应监测扫描模式进行子离子优化。质谱条件见1.3.3.2。母离子为M+1,液相部分只连接两通进行优化,优化后的质谱参数见表1,以响应信号最高的作为定量离子,响应信号次之的作为定性离子。

表1 敌敌畏多反应监测扫描模式的质谱参数
2.2 流动相的选择及洗脱梯度的优化
采用水及乙腈作为流动相,敌敌畏色谱峰呈现矮胖的形状,而采用乙酸铵及乙腈为流动相,目标物峰形尖锐,由于是采用正离子电离模式,在流动相中加入0.1%甲酸会更加有利于目标物离子化[14],因此确定以0.1%(V/V)甲酸-2 mmol/L乙酸铵溶液(A)和0.1%(V/V)甲酸-乙腈(B)作为流动相。流动相洗脱梯度优化的最终结果见表2。结果显示,4 min内敌敌畏目标物出峰(图1),出峰时间为3.989 min。

表2 梯度洗脱程序

图1 敌敌畏物质的定量离子色谱图
2.3 固相萃取柱的选择
试验对样品的净化采用Captiva EMR-Lipid固相萃取柱。试验采用乙腈对海参中大量的蛋白物质进行提取和沉淀,对比了Bond Elut PPL和Captiva EMR-Lipid两类固相萃取柱的净化和保留效果,以加标回收率作为评价指标。结果显示,Captiva EMR-Lipid固相萃取柱的吸附及净化能力较好,能够有效地将海参样品中的色素及脂肪吸附,不仅有效地去除了对目标化合物的干扰物,还确保了待测组分较少的损失,能够在保证良好净化效果的同时使操作过程更简单。
2.4 检测方法的线性关系和检出限
标准曲线在5~100 ng/mL的质量浓度范围内线性关系良好,敌敌畏线性相关系数值为0.998,标准曲线见图2。以信噪比大于3为检出限,检出限为5 μg/kg。

表3 敌敌畏的线性试验结果
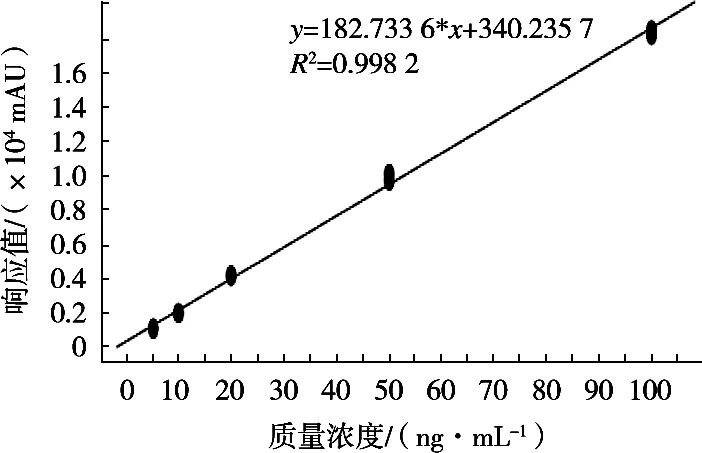
图2 敌敌畏标准曲线
2.5 方法回收率及精密度
选用鲜海参阴性样品,对其添加不同浓度敌敌畏标准物质,加标回收试验的3个水平加标量分别为10,20和40 μg/kg,每个水平重复6次测定,结果见表4。结果显示,加标回收率在80%~89%之间,相对标准偏差为2.78%~3.56%(n=6),方法精密度及准确度均较高。海参样品加标质谱图谱见图3。

表4 敌敌畏的加标回收率结果(n=6)

图3 敌敌畏成分加标质谱图谱
2.6 样品应用
为了进一步验证试验方法的实用性,将其他市售干制海参及新鲜海参按照所优化的条件进行检测,结果均未检出。今后将进一步加大抽样量并扩大抽样样品品类,对新建方法进行充分验证。
3 结论与讨论
试验采用QuEChERS前处理的方法,提高了海参中敌敌畏物质农药残留定量的准确度和重现性。试验利用液质联用仪进行检测,该方法简单易行、可操作、准确灵敏、基质干净以及减少仪器污染,既提高工作效率,又节约劳动成本,可为海参中敌敌畏物质农药残留的检测提供科学客观、准确可靠的方法。
