沸石分子筛对CH4/H2的吸附与分离性能*
2021-08-14袁俊鹏刘秀英李晓东于景新
袁俊鹏 刘秀英 李晓东 于景新
(河南工业大学理学院, 郑州 450000)
基于分子模拟的高通量计算方法, 通过对199个沸石结构特征和吸附分离性能之间的关联性研究, 发现具有超微孔结构的沸石材料对CH4分子有良好的吸附分离性能, 等摩尔CH4/H2混合组份的CH4吸附选择性和单组份的CH4吸附量之间存在明显的线性关系.通过使用巨正则蒙特卡罗模拟方法, 获得了3个孔道形沸石对CH4和H2的吸附等温线和等量吸附热等物理量.结果表明在相同外界环境下, 孔道形沸石的孔结构(表面积和孔体积)对CH4吸附量的影响高于能量效应(吸附热).结合甲烷蒸汽重整制氢的工业背景, 进一步研究了CH4/H2混合体系在不同组份下的分离选择性能, 结果表明, 超微孔沸石材料对CH4的吸附选择性与体相压力和进料比无关.通过气体分子的质心分布密度发现, CH4在孔道形沸石中优先占据更小孔窗的空间,而H2的分布范围更大但是未存在明显的优先吸附位点.
1 引 言
随着人口增长和经济发展, 化石能源日益枯竭, 人们迫切需要寻找新的能源替代品.氢气作为一类无污染、热值高、可循环的能源气体引起了研究者的高度关注[1—4].在甲烷蒸汽重整制氢系统中,各种气体杂质(如CH4)严重影响到氢气产率[5,6],因此氢气提纯是该工艺的一个重要环节.在各种分离技术中, 基于多孔材料的物理吸附由于能耗低、经济成本小、操作条件简单等优点得到了广泛应用[7—10].因此, 近几年来物理变压吸附方法逐渐得到重视[11,12], 而寻找适合的吸附剂成为实现该过程的关键因素.
沸石是一类重要的多孔晶体材料, 基本组成单元是TO4(T 通常为Al, Si或P)四面体[13,14].它们通过氧桥互相连接形成各种拓扑结构, 普遍应用在煤化工、石油化工和精细化工等领域.首先, 沸石分子筛可用作离子交换剂[15], 从“硬”水中去除Ca2+和Mg2+离子.其次, 它的第二类用途是催化[16,17], 应用于炼油的催化裂化过程, 显著提高了汽油产量以及原油利用率.同样, 由于独特的孔道和孔笼(具有容纳客体分子的孔腔)结构[18,19], 沸石在吸附与分离中也得到了广泛研究.相比于传统的实验测试分析流程, 基于分子模拟和量子化学的计算方法可以快速得到材料的各种性能, 同时, 获得的相关微观信息也为材料设计指明了研究方向.Schembecker研究组[20]使用密度泛函理论研究了BEA, MOR与C1-C4醇的相互作用, 结果表明BEA和MOR对醇类有机物可能是一种优异的吸附材料.Fu等[21]采用巨正则蒙特卡罗(grand canonical Monte Carlo, GCMC)模拟, 研究了苯和噻吩在MFI中的吸附性能和竞争性吸附机理.基于对四种完全不同的拓扑结构中Al的含量和位置的研究, Calero课题组[22]指出沸石中Al-Na+对的数量敏感地影响了吸附行为, 特别是提高了CO2的吸附.此前, 我们也使用GCMC模拟研究了MOR和MFI对CH4的吸附性能[23], 结果表明MOR是一种更有潜质的吸附剂.
目前沸石结构的数量仍在不断增加, 但是有关能源气体存储及吸附分离的研究还很少; 另一方面, 对沸石分子筛数据库中的每种结构进行合成及测试需要消耗大量资源.在此背景下, 基于高通量筛选的计算方法[24—26]得到了广泛研究.本文针对国际沸石分子筛数据库中有序的全硅类沸石材料,首先采用基于分子模拟的高通量筛选方法对所有结构的甲烷吸附量以及甲烷/氢气吸附选择性进行计算并分析结构与性能之间的关联性.随后, 依据孔腔极限直径(pore limiting diameter, PLD)大于0.38 nm (甲烷分子的动力学直径)且小于0.7 nm(超微孔尺寸)的条件对沸石结构进行排序, 并筛选出吸附选择性排名前3的超微孔沸石分子筛.最后通过GCMC方法研究了这3个沸石对CH4和H2的单组份吸附及CH4/H2的二元混合组份吸附.为了进一步分析整个过程中不同沸石结构对各种气体分子的吸附行为, 得到了它们的优先吸附位点,并详细阐述了结构特征与吸附性能之间的关系.
2 模型与方法
2.1 高通量计算
本研究采用基于分子模拟的高通量计算方法,具体计算流程如图1所示.首先从国际沸石分子筛网站[27]下载得到242个有序晶体结构.其次, 使用Zeo++软件[28,29]以0.5 nm作为探针分子半径计算每个沸石的可接触表面积(accessible surface area, ASA), 并排除34个ASA为0的结构.同时还计算了最大孔径(largest cavity diameter, LCD),探针分子的可占据孔体积(accessible probe-occupiable volume, POAV), 其中对于POAV, 探针分子半径设置为0, 即计算不占骨架原子的空间.然后,采用GCMC模拟方法计算剩余208个沸石的甲烷吸附量并排除9个因结构不合理而导致吸附量小于0的沸石材料, 同时也计算了孔隙率(porosity),甲烷吸附热和等摩尔甲烷/氢气的吸附选择性,其中对于porosity, 探针分子设置为He.最终获得199个沸石分子筛的4个几何描述符, 1个能量描述符, 甲烷吸附分离性能数据.超微孔(< 0.7 nm)材料由于尺寸效应(较小的分子被吸附在骨架孔壁上, 而较大的则被阻碍在孔道外)使其在气体分离领域有显著的优势.因此, 在该孔径限定范围内选择了3个具有优越吸附选择性的沸石材料.

图1 高通量计算流程Fig.1.High-throughput calculation process.
2.2 沸石结构
表1分别列出了ASV, BOF和FER沸石分子筛的晶格常数和孔结构信息, 其中ASV为四方晶系, BOF和FER属于正交晶系.为了直观探究沸石材料的内部结构, 进行了孔结构可视化(设置He为探针分子).

表1 沸石的结构参数Table 1.Structural parameters of zeolite.
图2给出了高通量计算筛选得到的3个超微孔沸石材料的超晶胞结构, 其中ASV, BOF和FER的晶胞数目分别为3 × 3 × 2, 4 × 2 × 2, 2 ×2 × 4.从图2可以观察到ASV有一个主孔道(LCD为4.9512 Å), 而在垂直于主孔道方向上是六元环孔径(甲烷分子不能穿过该孔道尺寸), 因此它属于一维孔道类沸石.同样, BOF也是一维孔道沸石, 并且该孔道结构呈现“S”型分布.FER为二维孔道类沸石, 孔道窗口分别由八元环和十元环组成.因此这3个材料均属于不包含孔笼结构的孔道形沸石.

图2 ASV, BOF和FER的孔道结构Fig.2.Channel structure of ASV, BOF and FER.
2.3 力场设置
沸石骨架的原子力场参数从TraPPE (transferable potentials for phase equilibria)力场[30]得到.对于CH4分子, 采用联合原子势能模型[31], 此势能模型取自Martin和Siepmann开发的TraPPE力场.而H2分子采用Darkrim和Levesque开发的三点模型[32,33], 在双原子分子的质心(center of mass, COM)引入点电荷来重现实验中分子的四极矩现象.在GCMC模拟过程中它们都被视为刚性分子.表2详细列出了本研究中客体分子和沸石材料所使用的势能参数.
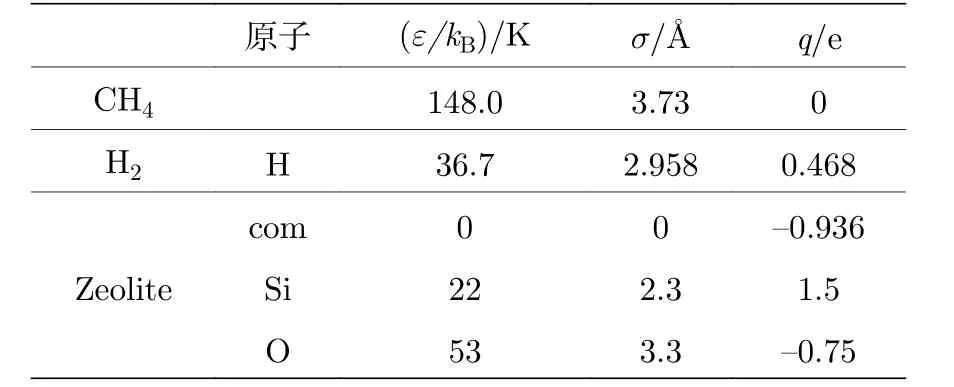
表2 吸附质分子和沸石的力场参数Table 2.Force field parameters of adsorbate molecules and zeolites.
2.4 模拟细节
采用GCMC模拟方法计算沸石材料的甲烷/氢气单组份吸附性能和二元混合组份分离性能,所有吸附分离过程以及孔隙率均采用RASPA2软件[34,35].对于吸附质分子之间以及客体分子与沸石骨架原子的非键相互作用使用Lennard-Jones (LJ)势能函数和Coulomb势能函数共同描述, 即:
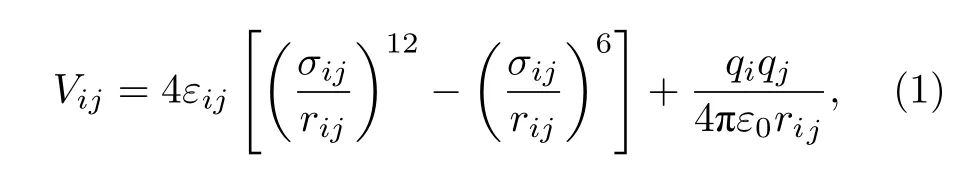
其中, i和j表示两个相互作用的原子, Vij是非键相互作用能, εij为势阱深度, σij是势能平衡位置,rij是两个原子之间的距离.对于任意两个原子的非键相互作用使用Lorentz-Berthelot (LB)混合规则, 截断半径设定为12 Å.qi和qj为原子电荷,ε0是真空介电常数, 长程库仑静电相互作用采用Ewald求和方法计算.在模拟中, 沸石分子筛处理为刚性骨架, 即材料的原子位置不会发生改变.模拟晶胞沿着3个维度分别扩展到不小于截断半径的两倍, 且施加周期性边界条件.对于单组份吸附模拟, 每次执行3 × 105次循环, 前1 × 105次为平衡模拟, 后2 × 105次进行统计平均计算.对于二元混合组份分离模拟, 为保证竞争分子之间的平等性和模拟结果的准确性, 统计平均的数据采样使用5 × 105次循环.
等量吸附热(Qst)代表了吸附质分子与吸附剂晶格原子之间的相互作用强度[36].它是衡量固体表面能量异质性和评估吸附剂性能的重要概念, 吸附热可以用Clausius-Clapeyron方程表示, 即:
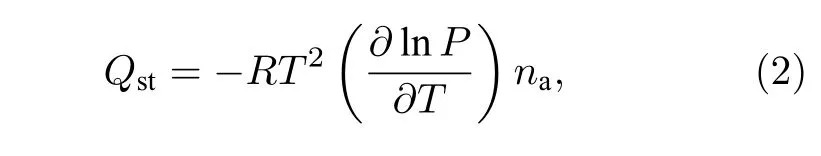
其中Qst是等量吸附热, R为普适气体常数, P是吸附压力, T为模拟温度, na是吸附量.在模拟甲烷/氢气分离过程中, 二元混合组份的吸附选择性系数计算公式如下:其中A和B是吸附质分子, x为吸附相中的绝对吸附量, y是本体相中的压强, S为吸附选择性系数.

3 结果与讨论
3.1 高通量筛选
通过采用基于分子模拟的高通量筛选方法在排除ASA为0且吸附量小于0的结构后获得了199个沸石在温度为298 K, 压力是1 bar (1 bar =105Pa)下的吸附性能数据, 并从最大孔径、表面积、孔体积和孔隙率这4个几何描述符来探究结构与气体分子吸附分离之间的关系.图3(a)描述了甲烷吸附量和吸附热与LCD之间的相互关系.随着LCD的增加, 吸附量先增加后减小, 在最大孔径约为6 Å时, 吸附量达到最大值, 这表明具有超微孔结构的沸石对CH4分子具有良好的吸附性能.从图3(b)可看出, 当表面积在1400—2100 m2·g—1范围时沸石材料的吸附性能最好.甲烷吸附量与其吸附热呈现正相关性, 其中吸附热主要分布在10—25 kJ·mol—1区间.在图3(c)和图3(d)中, 最大吸附量的POAV位于0.2 cm3·g—1左右, 而porosity则处于0.3的位置, 这一结果初步说明对于沸石材料, 最大的孔容量并非导致更高的吸附容量.通过对孔结构与吸附量的关系图研究表明在甲烷的吸附量中适当的孔径和特定的结构占主导地位.另外, 还发现甲烷吸附量随porosity的分布情况(图3(d))与图3(a)相似, 这说明LCD和porosity存在某种关联性.
图4展示了在模拟温度为298 K, 压力为1 bar时等摩尔甲烷/氢气体系的吸附选择性能与孔结构之间的关联性.对比图3吸附性能与孔结构信息,发现在甲烷/氢气混合体系中, 甲烷吸附选择性能和最大孔径、表面积、孔体积的分布情况同甲烷的吸附容量相类似.当LCD为6 Å, ASA为1400—2100 m2·g—1以及POAV在0.2—0.3 cm3·g—1的范围时, 沸石结构对甲烷分子的分离性能最好.同样,这一结果也表示甲烷的吸附选择性与沸石的孔径具有较强的关联性并且和甲烷的吸附热呈现明显的正相关性.在图4(d)中, 随着porosity的增加,甲烷的吸附选择性先增加后减小, 在porosity为0.3时, 选择性达到最大值.通过图3和图4整体分析表明单组份的甲烷吸附量和等摩尔组份的甲烷选择性之间也具有一定关联性.
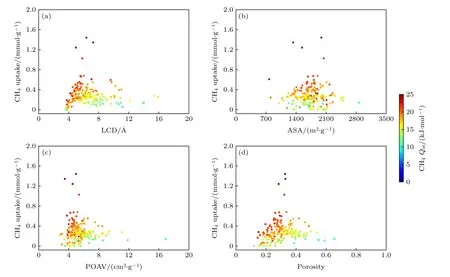
图3 沸石材料中吸附性能与孔结构之间的关联性Fig.3.Correlation between adsorption performance and pore structure in zeolite materials.
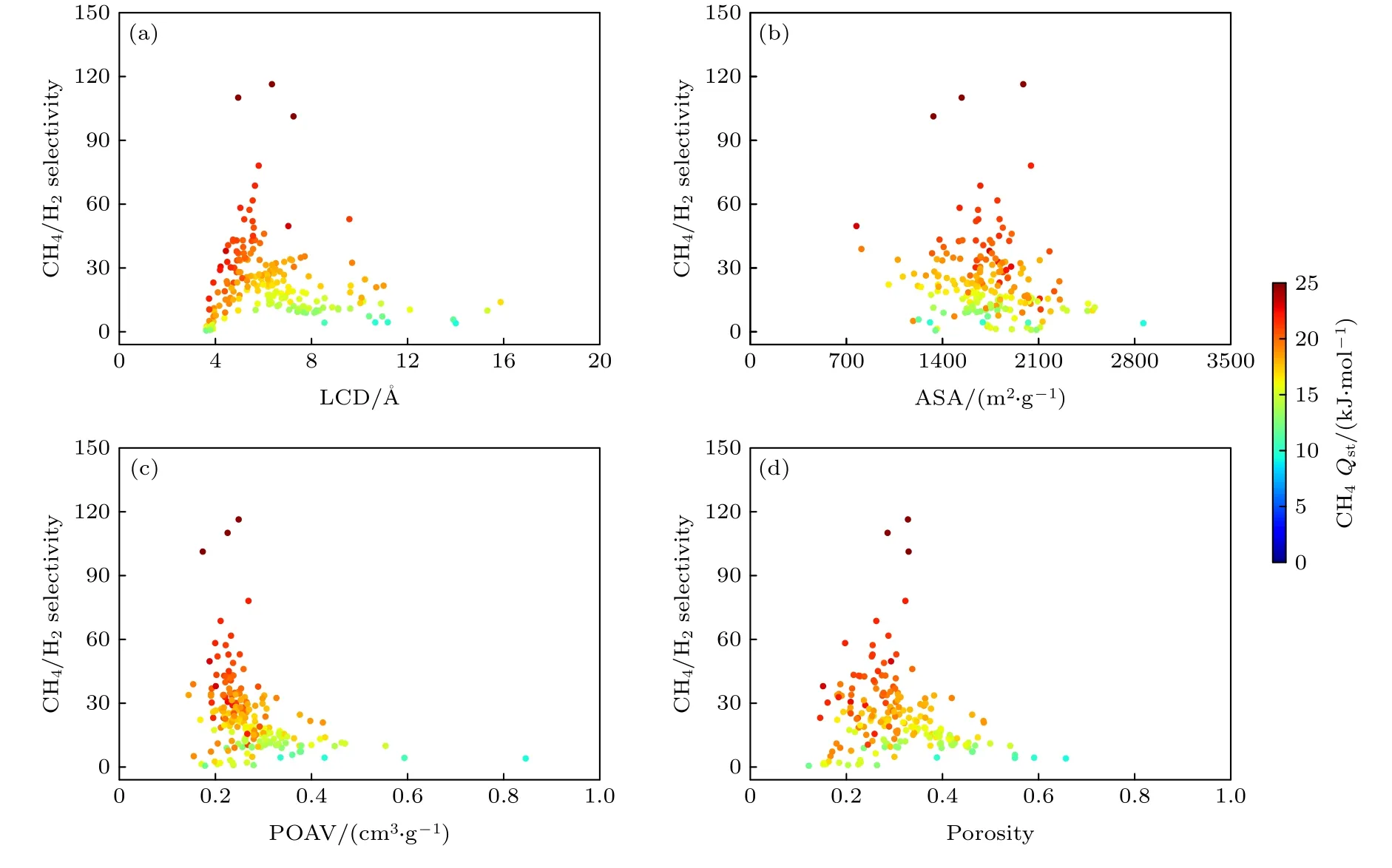
图4 沸石材料中分离性能与孔结构之间的关联性Fig.4.Correlation between separation performance and pore structure in zeolite materials.
如图5(a)所示, 沸石分子筛LCD和porosity之间的正相关性解释了甲烷吸附量在两者物理量上相似的分布情况, 这表明LCD也可以作为一种评价沸石孔容量的性能指标.在图5(b)中等摩尔甲烷/氢气混合组份的甲烷吸附选择性和单组份的甲烷吸附量存在明显的线性关系, 这说明在该混合体系中沸石材料对甲烷分子的吸附选择性决定于它的吸附容量.图5(c)展示了能量描述符(吸附热)与吸附选择性的关系, 较高的吸附热有利于提升沸石对甲烷分子的吸附分离性能.

图5 (a) LCD, porosity和POAV之间的关联性; (b), (c) 甲烷吸附量、吸附热和甲烷/氢气吸附选择性之间的关联性Fig.5.(a) Relationship between LCD, porosity and POAV; (b), (c) the correlation between CH4 adsorption capacity, adsorption heat and CH4/H2 adsorption selectivity.
3.2 纯组份吸附
本节使用GCMC方法模拟了超微孔沸石材料ASV, BOF和FER在温度为273和298 K、压力范围为0—100 kPa下的单组份吸附性能.图6(a)为CH4的吸附曲线, 它属于经典的朗缪尔型等温线.当温度为273 K时, 甲烷分子吸附量依次为:FER > BOF > ASV.当吸附压力增加到1 bar时,FER和BOF具有相同的吸附量: 0.8123 mmol·g—1,该值远高于ASV具有的吸附量, 这归因于中低压下沸石材料的气体吸附量主要与孔容量有关, 该结果也得到表2中孔结构信息的支持.模拟温度升高将导致吸附质分子能量增加, 同时也使得沸石材料的吸附量明显下降.图6(b)描述了沸石分子筛对H2的吸附等温线, 在室温下它们均为直线型吸附曲线, 这表明沸石对H2的吸附能力远低于CH4.当压力为1 bar时最大的吸附量仅有0.0118 mmol·g—1.

图6 沸石对CH4 (a) 和H2 (b) 的吸附量Fig.6.Adsorption capacity of zeolite for CH4 (a) and H2 (b).
为了更好地理解气体分子在沸石骨架中的吸附行为, 计算了298 K下等量吸附热与超额吸附量之间的关系.图7(a)展示了CH4的等量吸附热, 在零吸附量下ASV的初始吸附热为20.228 kJ·mol—1,相比沸石BOF和FER, 较高的吸附热表明它对CH4具有更强的相互作用能.然而从图6(a)知道它的吸附等温线始终低于这两个沸石, 这也表明在常温中压下, 孔结构(表面积和孔体积)对吸附行为的重要性.BOF对CH4的等量吸附热随着吸附量的增加而呈现上升趋势, 即CH4分子之间的相互作用提高了沸石的吸附能力, 当吸附量到达0.4492 mmol·g—1时, 吸附热为20.293 kJ·mol—1.相比于直通道沸石ASV和FER, S型孔道结构更有利于增强沸石和甲烷分子的吸附性能.图7(b)是H2的等量吸附热, 恒定不变的吸附热对应图6(b)的直线型吸附等温线.同时, 较低的吸附热表明在中压下提高H2吸附量的主要方法是改善沸石材料对氢气分子的相互作用能.

图7 沸石中CH4 (a) 和H2 (b) 的等量吸附热Fig.7.Isosteric heat of adsorption of CH4 (a) and H2 (b) in zeolite.
3.3 二元混合组份吸附
本节讨论温度为298 K时沸石分子筛在CH4/H2混合体系中对甲烷气体分子的吸附选择性能.如图8所示, 在CH4/H2系统中沸石对CH4的吸附选择性几乎与体相压力的变化无关.这说明沸石的结构特征直接决定了CH4气体分子的吸附选择性.在图8(a)中当压力为1 bar时ASV, BOF和FER对甲烷的吸附选择性分别为37.167, 38.388和42.835.该选择性曲线的高低与吸附等温线一致,这一现象与前面3.1节中沸石结构和性能关系的研究结果相同.在等摩尔组份(图8(b))和yCH4/yH2= 0.95∶0.05组份(图8(c))的混合体系中沸石分子筛对CH4的吸附选择性有一样的结论, 该研究表明, 吸附质分子的进料比对甲烷分子的分离性能影响比较小, 这也表现出该材料在不同环境下具有筛选甲烷分子的优良潜质.
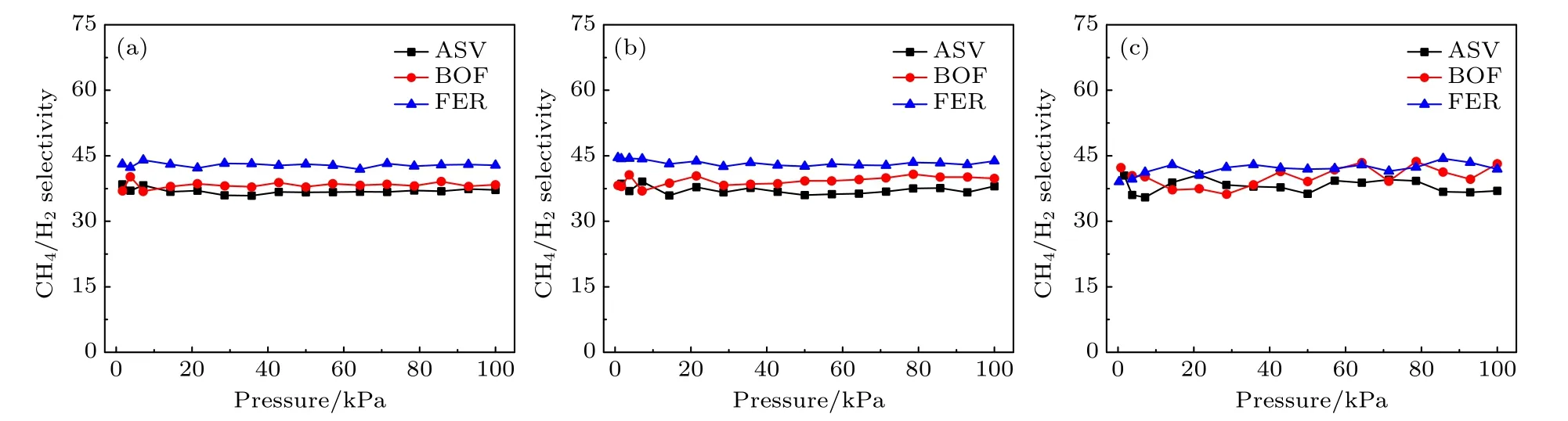
图8 压力对三种气体组份的CH4选择性的影响 (a) y CH4/yH2 = 0.05∶0.95; (b) y CH4/yH2 = 0.5∶0.5; (c) y CH4/yH2 = 0.95∶0.05Fig.8.Influence of pressure on CH4 selectivity for three gas compositions: (a) y CH4/yH2 = 0.05∶0.95; (b) y CH4/yH2 = 0.5∶0.5,(c) y CH4/yH2 = 0.95∶0.05.
3.4 优先吸附位点
图9描述了在温度为298 K, 压力为1 bar时CH4在3个沸石材料上的优先吸附位点.对于一维直通道沸石ASV, 甲烷分子主要分布在主孔道中心且在六元环的中心处为优先吸附位点, 而一维“S”型孔道沸石BOF未有明显的优先吸附位点.二维直通道沸石FER有两个吸附位点: 八元环孔道中心和十元环孔道中心.其中, 从图9(c)观察到甲烷分子在十元环孔道内的分布范围小于八元环,这表示甲烷分子优先占据更小孔窗的空间.
图10展示了在相同模拟条件下H2的优先吸附位点, 通过对比图9可知氢气分子和CH4具有相同的分布位置.然而存在两个不同点: 第一,H2的分布范围明显增大, 主要是由于不同分子在沸石中占据的空间不同(相同孔体积下氢气分子具有更大的活动空间); 第二, H2没有明显的优先吸附位点, 这可能归因于沸石结构对氢气分子吸附热较小.

图9 CH4在ASV, BOF和FER沿孔径方向(a), (b), (c) 和垂直于孔径方向 (d), (e), (f) 的质心密度分布Fig.9.Centroid density distribution of CH4 in ASV, BOF and FER along the aperture direction (a), (b), (c) and perpendicular to the aperture direction (d), (e), (f).
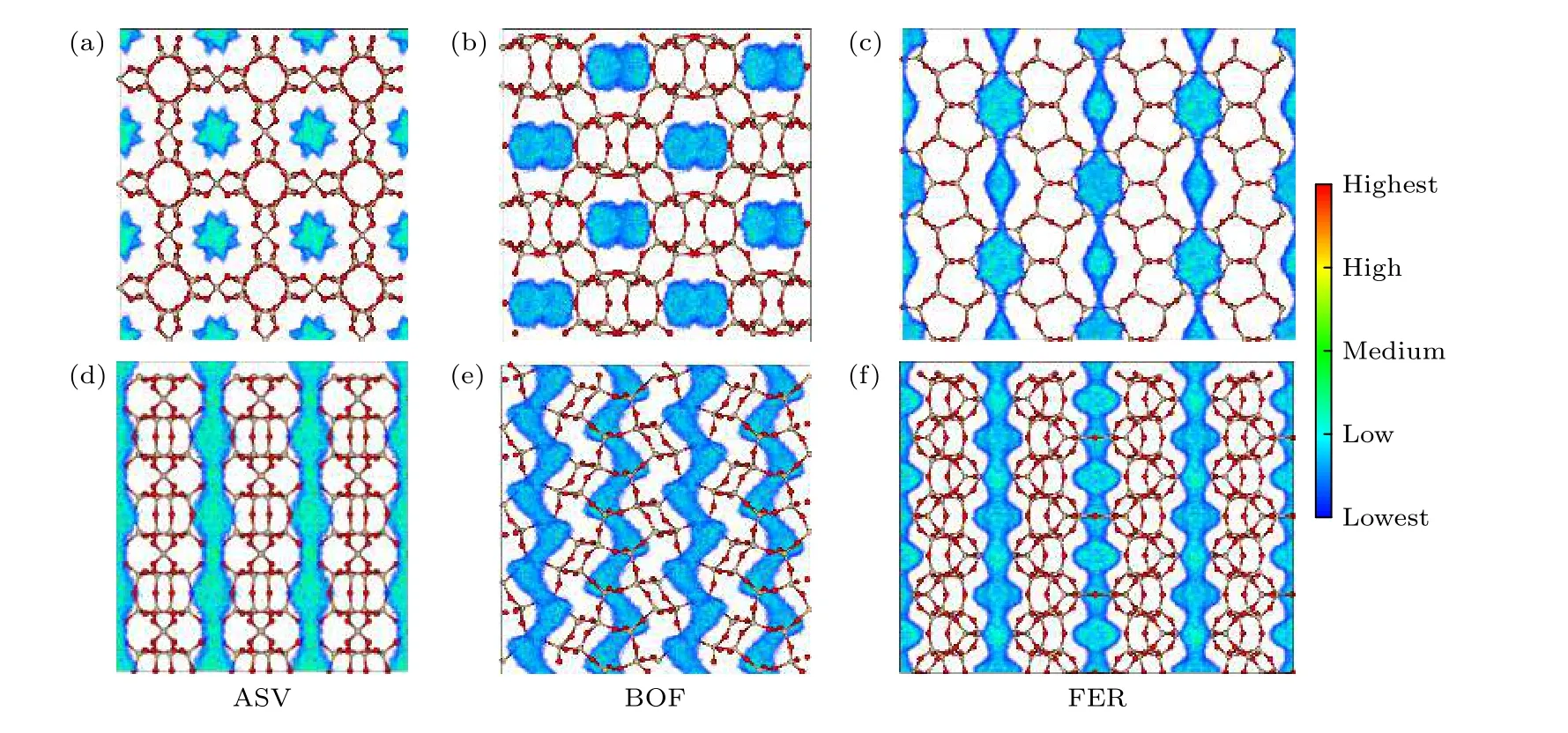
图10 H2在ASV, BOF和FER沿孔径方向(a), (b), (c) 和垂直于孔径方向 (d), (e), (f) 的质心密度分布Fig.10.Centroid density distribution of H2 in ASV, BOF and FER along the aperture direction (a), (b), (c) and perpendicular to the aperture direction (d), (e), (f).
4 结 论
本文使用基于分子模拟的高通量计算方法研究了国际沸石分子筛数据库中199个材料结构特征和CH4吸附容量以及CH4/H2吸附选择性之间的关联性.结果表明, 当LCD为6 Å, ASA为1400—2100 m2·g—1以及POAV在0.2—0.3 cm3·g—1区间时, 沸石结构对甲烷分子的吸附容量和吸附选择性最好.此外, 还发现沸石分子筛的LCD和Porosity以及等摩尔甲烷/氢气混合组份的甲烷吸附选择性和单组份的甲烷吸附量存在正相关性.结合吸附质分子与超微孔尺寸特征选择了3个沸石并详细研究它们对CH4和H2的吸附分离性能.基于GCMC模拟, 本文获得了超微孔沸石分子筛ASV, BOF和BEF在不同条件下的吸附等温线和等量吸附热等物理量, 并对比探究了它们的吸附分离性能.结果表明, 在相同外界环境下, 沸石孔结构(表面积和孔体积)对甲烷吸附量的影响高于能量效应(吸附热).通过对CH4/H2混合组份的模拟研究发现, 沸石材料对CH4的吸附选择性与体相压力和进料比无关, 从而表现出该材料在不同环境下具有优先筛选甲烷分子的能力.通过研究CH4和H2在沸石上的质心密度分布, 进一步讨论了超微孔沸石对气体分子的吸附分离行为, 结果表明甲烷分子优先占据更小孔窗的空间, 而氢气的分布范围更大但是未存在优先吸附位点.这些结果为预测其他沸石材料对不同气体分子的吸附与分离性能提供依据参考和研究思路.
