通过醚的α-位C(sp3)—H键官能化合成醚类衍生物的研究进展
2021-08-13马金凤周爱华
马金凤, 王 敏, 周爱华*
(1. 江苏大学 药学院,江苏 镇江 212001; 2. 中国科学院 微生物研究所,北京 100101)
近年来,通过不活泼醚的α-位C—H键官能化,直接使用未预官能团化的醚和其他分子发生反应来制备醚的各种衍生物已引起了人们广泛的关注。由于这种反应不需要对醚进行预官能化,实现了以更短的合成路线和更高的原子利用效率来获得目标分子,为直接利用醚为合成原料来制备复杂的有机含醚结构化合物提供了一条新的方法和途径[1-2]。
尽管简单的环状醚如四氢呋喃、二恶烷、四氢吡喃(THP)等和非环醚已被作为交叉偶联反应原料已被广泛用于α-位C—H键官能化反应,但对它们进行进一步的研究仍然具有必要性,因为醚结构不仅存在于普通的有机化合物中,还广泛分布于天然产物、药物和其他生物活性分子等复杂分子中。例如短裸甲藻产生的神经毒素(Brevetoxin B)、治疗丙型肝炎病毒(HCV)感染的Sofosbuvir、兴奋剂Zylofuramine、肾上腺素受体拮抗剂Idazoxan等(Chart 1)[3-6]。因此,通过醚的α-C(sp3)—H直接官能化反应,建立醚结构和其他分子的连接是非常有意义的课题。本综述通过收集近年来醚的直接α-C(sp3)—H官能化反应的论文报道,依据反应特点分类为金属催化、无金属催化、光催化以及电催化及其他等4类进行了综述。
Chart 1
近年来,在简单醚的α-C(sp3)—H直接官能化反应中,采用过渡金属催化作为一种有力、直接的方法,已经引起了研究人员的广泛关注。2017年,Lan等[7]报道了铁催化的醚与α,β-不饱和酮之间的偶联反应(Scheme 1)。在氮气气氛、115 ℃加热条件下,以DTBP为氧化剂,10 mol%Fe2(CO)9为催化剂,TMEDA为配体,醚与三氟乙醇为共溶剂,实现了环状和线性醚与不同的α-和β-取代的乙烯基酮良好偶联,获得了较高收率的醚衍生物。
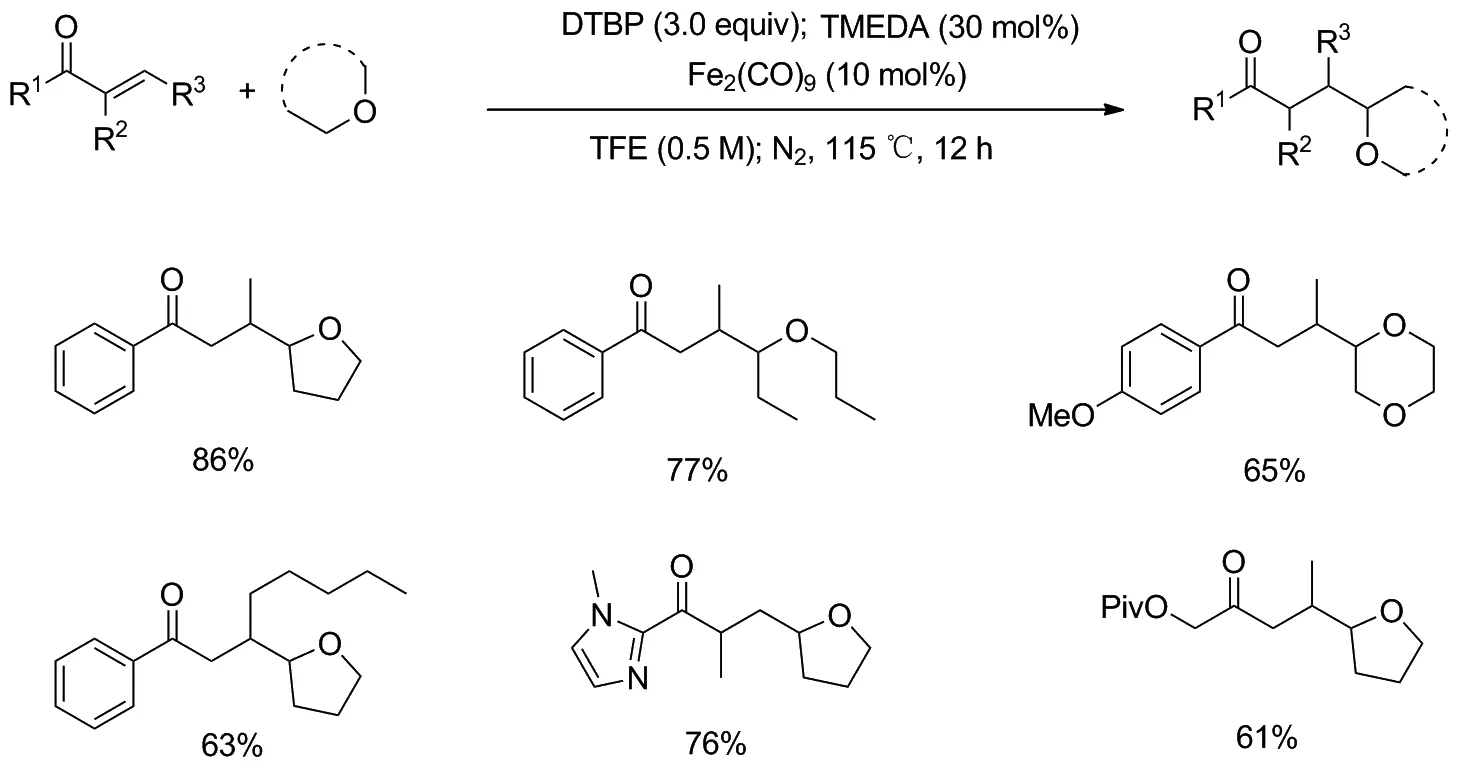
Scheme 1
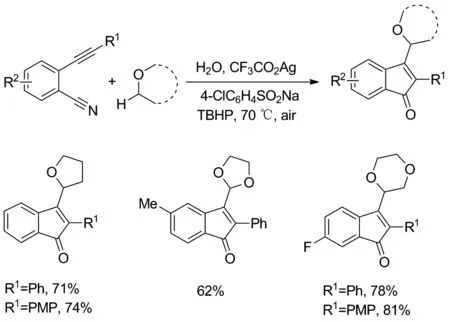
Scheme 2

Scheme 3
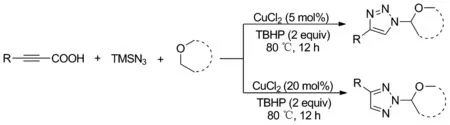
Scheme 4
2018年,Zhu等[8]报道了在银/TBHP催化体系下实现的环醚与2-炔基苯腈的偶联环化反应(Scheme 2)。以CF3CO2Ag和叔丁基过氧化氢(TBHP, 70%的水溶液)为催化氧化体系,亚磺酸盐作为添加剂,实现自由基中继环化反应,完成了环醚的α-C(sp3)—H键官能化,以良好的产率合成了大范围的3-烷基化1-茚酮。
2019年,魏伟课题组[9]报道了铜催化的炔烃、TMSN3和醚的三组分反应(Scheme 3)。该反应通过改变催化剂CuCl的含量,成功实现了N1-和N2-烷氧基化的1,2,3-三唑的区域选择性合成。当CuCl含量为 5 mol%时,主要得到N1-氧烷基-1,2,3-三氮唑,当CuCl的用量增加到 20 mol%时,主要得到N2-氧烷基-1,2,3-三氮唑。反应发现含有给电子基团和吸电子基团的各种芳族炔烃都可以顺利进行反应,得到高收率目标产物。醚、环状醚和线性醚均适用于该反应,且环状醚显示出比线性醚更好的活性。
同年,魏伟课题组[10]又报道了铜催化的炔基羧酸、TMSN3和醚的三组分脱羧环加成反应,同样通过改变催化剂CuCl2的含量来选择性构建N1-和N2-氧烷基取代-1,2,3-三氮唑(Scheme 4)。由于该反应使用固体炔基羧酸而不是低分子量和低沸点的炔烃,使得反应操作更加安全、简单和高效,更具应用价值。
2019年,罗军课题组[11]通过自由基交叉脱羧偶联过程在环醚a-位直接进行了烯基化反应(Scheme 5a)。反应以10%molNiCl2为催化剂,1.2 eq.的DTBP为自由基引发剂和氧化剂,1.2 eq.的K2CO3为添加碱作为最优反应条件,适用于各种芳基丙酸和环醚之间的偶联反应。为了探索反应机理,加入了典型的自由基清除剂2,2,6,6-四甲基哌啶氧化物(TEMPO),完全抑制了反应,几乎没有检测到任何所需的产物,这表明该反应是通过自由基程序进行的(Scheme 5b)。
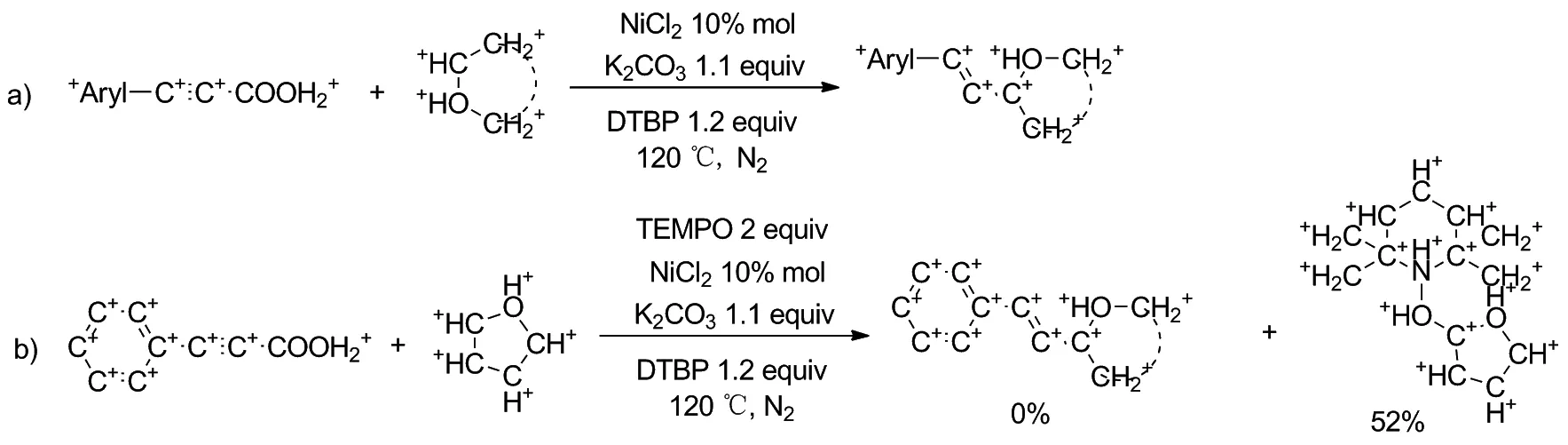
Scheme 5

Scheme 6
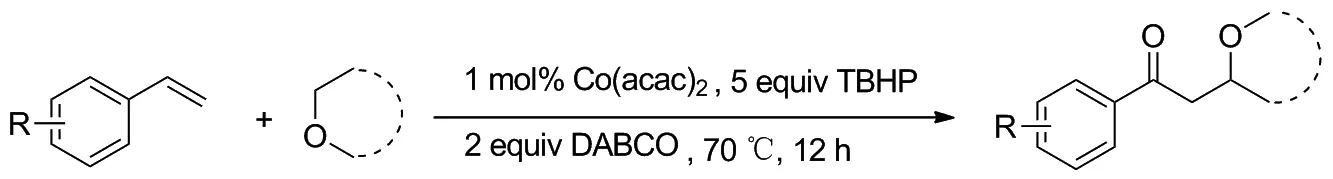
Scheme 7
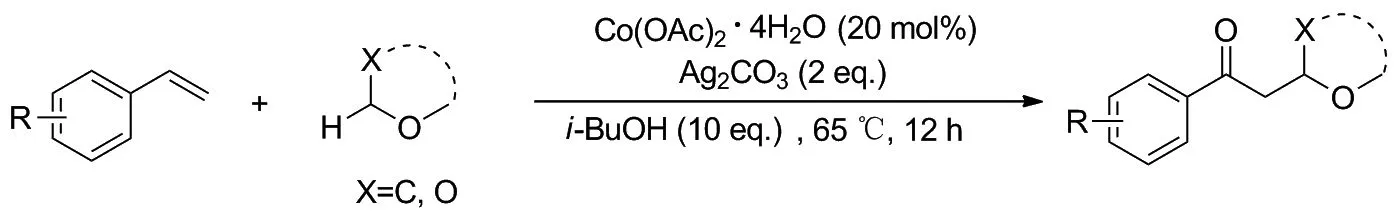
Scheme 8
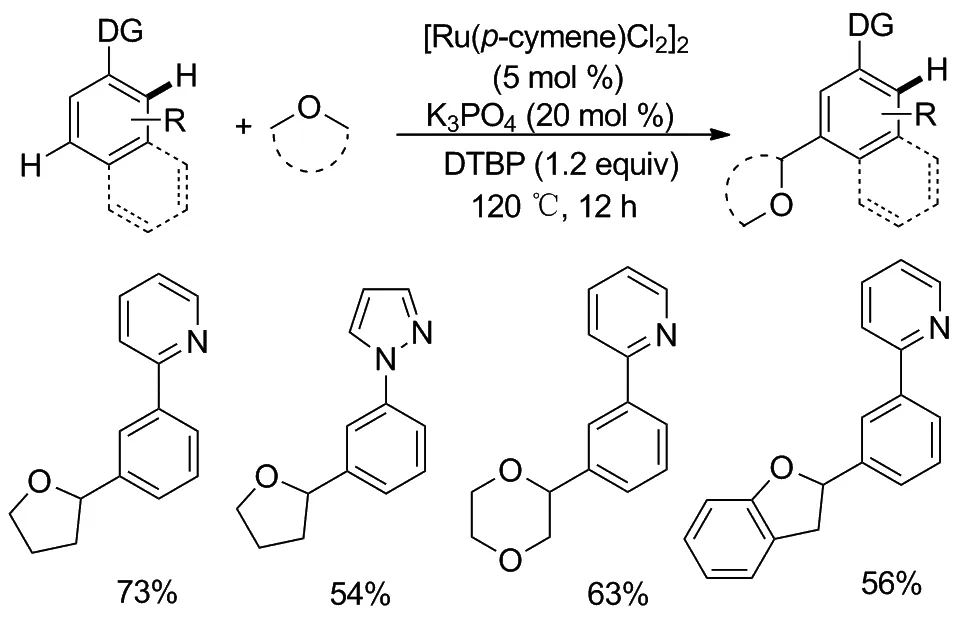
Scheme 9

Scheme 10
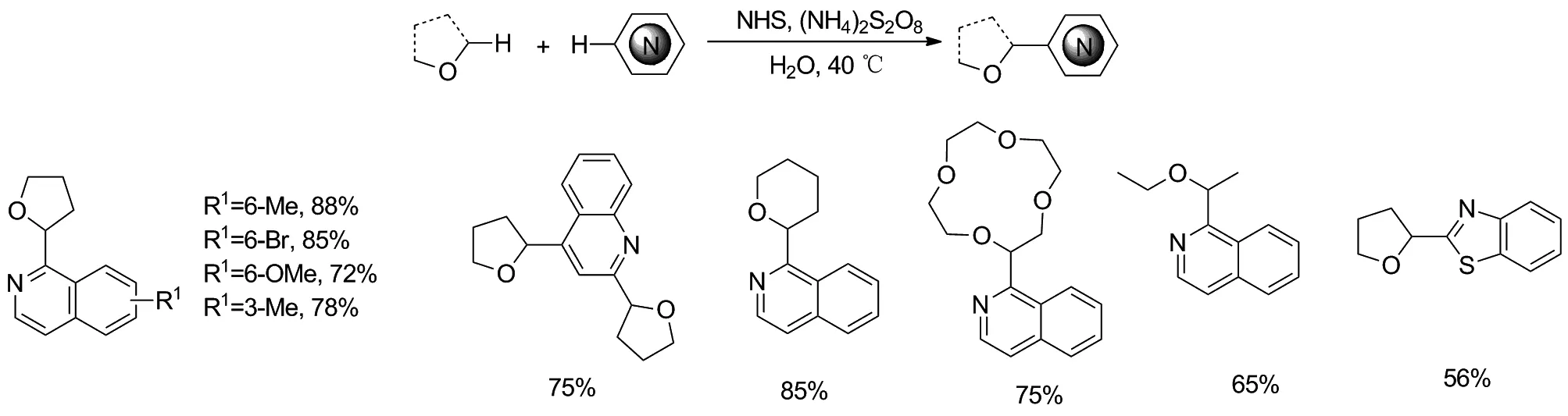
Scheme 11
Scheme 12
Scheme 13
同年,该课题组[12]又采用钯催化,实现了酰腙、芳基卤化物和环醚的三组分交叉偶联(Scheme 6a)。该反应由于产物1a和2a的极性太接近,无法通过硅胶柱色谱分离,所以其后又将混合产物进一步氢化,获得了一系列纯净的产物(2a, Scheme 6a)。
2020年,刘兰涛课题组[13]发表了钴催化的苯乙烯和醚的氧化烷基化反应,该反应通过醚a-位C(sp3) —H键官能化来构建了C—C键,为合成γ-醚酮化合物提供了一种快速有效的方法(Scheme 7)。 2019年,李东课题组[14]也报道了钴催化的苯乙烯与醚的双官能化反应,从而得到氧烷基化产物(Scheme 8)。不同的是该反应使用了稳定的无机银盐Ag2CO3代替有机过氧化物TBHP作为氧化剂,而相同的是二反应都表现出良好的区域选择性和官能团耐受性,为制备γ-醚酮提供了具有实用价值的新方法。
钌具有独特的催化性能,它不仅能促进邻位(间位或对位)C—H键的官能化,还能促进间位或对位的C—H键的官能化。基于钌催化的间位C—H键官能化的自由基机理,2020年,李刚课题组[15]公布了钌催化的芳烃与环醚的间位脱氢烷基化反应(Scheme 9)。反应在120 ℃条件下,普通环醚作为烷基化试剂和溶剂,[Ru(p-cymene)Cl2]2作为催化剂,DTBP作为自由基引发剂和氧化剂,K3PO4作为促进剂,实现了芳烃与醚的间位选择性脱氢烷基化反应,为在芳环的间位引入环醚结构提供了一种方便有效的合成方法。

Scheme 14

Scheme 15
无金属的醚α-C(sp3)—H官能化反应具有较好的环境友好性,因反应过程无需特殊金属催化剂或者助催化剂,在有机合成中受到了越来越多的关注,为用简单的起始原料构建复杂的有机化合物提供了强大的工具。
2017年,郭灿成课题组[16]开发了K2S2O8促进的α,β-不饱和羧酸与环醚的氧化脱羧烷氧基化反应(Scheme 10)。反应在常压下,通过加成、氧化和脱羧过程一步形成C—C和C=O键,从而获得中等至较好的收率酮产物。反应的机理研究表明,在热条件下K2S2O8夺取环醚α-C(sp3)—H键的上H,反应经历自由基途径而完成。
2017年王伟课题组[17]报道了一种新的无金属催化的交叉脱氢偶联(CDC)反应,该反应采用N-羟基琥珀酰亚胺(NHS)作为介导物,直接将多种醚连到杂芳环上(Scheme 11)。NHS介导的CDC反应条件温和,具有较宽的官能团耐受性。并且能够使多种醚,直接与多种杂环分子相连。该方法对环境无害,成本效益高,具有工业化的潜力。
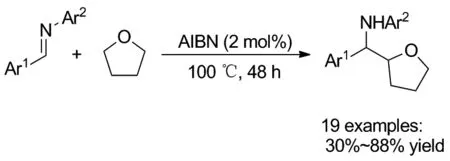
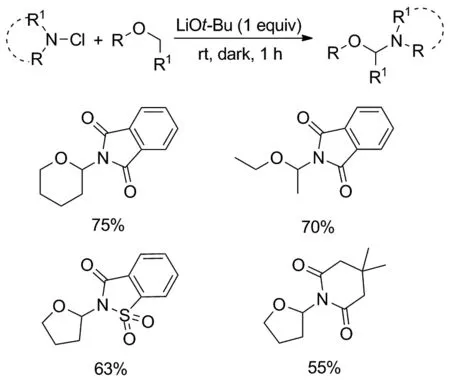
无金属催化的醚α-C(sp3)—H官能化反应在多数情况下,需要使用产生自由基的试剂或过氧化剂,以确保连续生成自由基并完成反应。2017年岳发恭课题组[18]报道了无需使用任何氧化剂、金属盐、催化剂或紫外线照射,仅在少量AIBN(2 mol%)的存在下,就完成的THF和其他环状醚与各种亚胺直接反应(Scheme 12)。在2019年,Laulhé课题组[19]也报道了无需外部自由基引发剂,热或光,就能完成环状和非环醚的新型无金属催化的区域选择性α-胺化反应(Scheme 13)。该反应采用N-氯酰亚胺作为胺化剂,叔丁醇锂作为碱,在室温下黑暗中反应1 h,以良好到优异的产率合成了一系列的半氨基醚,为半氨基醚得合成提供了一种新途径。
2018年,林东恩课题组[20]报道了嘌呤与烷基醚的自由基氧化偶合反应,这是以碘离子催化的自由基反应(Scheme 14)。研究发现,氧化剂(TBHP)和催化剂(n-Bu4NI)的协同组合对于偶联的成功至关重要,缺乏其中任何一种反应都会失败。该反应成功地将烷基醚进行了无金属胺化,以较好的产率获得9-烷基嘌呤衍生物,为制备含有嘌呤环结构单元的化合物提供了一条高效、绿色的途径。
同年,Sun等[21]采用环状高价碘试剂1-氰基-1,2-苯碘氧基-3-(1H)-酮作为氰基试剂和氧化剂,过氧苯甲酸叔丁酯(TBPB)作为引发剂,完成了醚a位的C(sp3)—H键上的氰化反应(Scheme 15)。在中,为进一步开发高价碘(III)试剂作为无金属存在下的官能团转移试剂提供了希望。
2019年,Wang等[22]报道了喹啉酮与醚的无过渡金属存在下的交叉脱氢偶联(CDC)反应(Scheme 16a)。反应以DTBP作为氧化剂,DMSO作为溶剂,120 ℃下反应8 h为最优条件来合成3-烷基喹啉酮。该反应是通过氧化剂DTBP加热分解为叔丁氧基自由基后,与醚进一步反应,通过C(sp3)—H键的氢拔取使醚生成了醚自由基中间体进行后续与喹啉酮的偶联(Scheme 16b),避免了醚的过多预活化步骤,使反应在温和条件下获得良好的收率,具有较短的合成步骤和原子经济性。

Scheme 16
Scheme 17
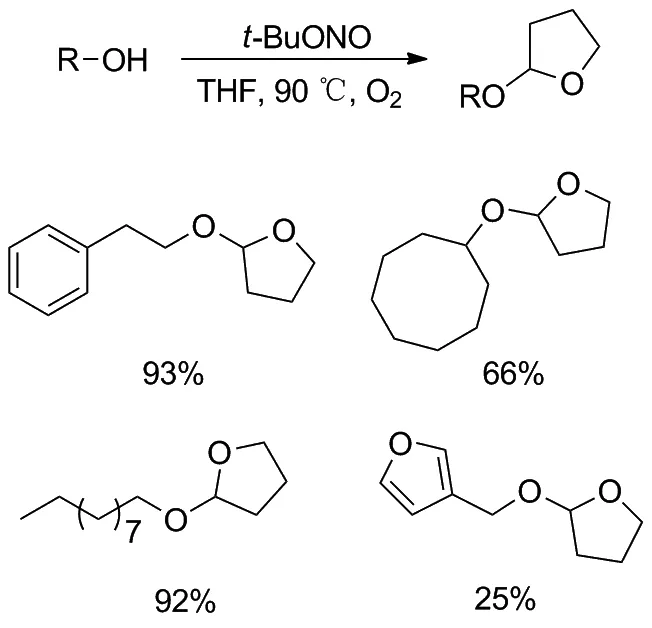
亚硝酸叔丁酯(t-BuONO)也可以介导无金属存在下的醚α-C(sp3)—H官能化反应。2020年,
Bi等[23]报道了在亚硝酸叔丁酯存在下,醇的无金属催化的四氢呋喃基化(Scheme 17)。该方法不仅操作简单、条件温和,而且具有良好的官能团耐受性,是一种较具吸引力的醇类保护方法。
近年来,由于光催化反应具有高效环保、条件温和、低能耗和操作简便的优点,特别是可见光促进的反应广受合成化学家的关注。不同的过渡金属盐(铱、钌、铑等)、有机染料(曙红Y、玫瑰红、亚甲蓝、吖啶红等)、多相催化剂被开发用作光催化剂,得到了人们广泛的研究,还开发了各种使用能够吸收可见光的基底的无光催化剂方法。
3.1 过渡金属类光催化剂催化的醚α-C(sp3)—H官能化反应
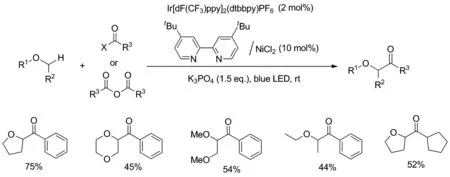
2017年,Sun等[24]采用铱基光催化剂和镍络合物组成的二元催化体系实现了醚和酰卤的直接偶联(Scheme 18)。反应采用THF和苯甲酰氯作为模型底物,探索出反应的最优条件:在室温可见蓝光照射下,采用2 mmol%Ir[dF(CF3)ppy]2(dtbbpy)PF6作为光催化剂,10 mmol% 的镍络合物(NiCl2为镍源4,4′-二叔丁基-2,2′-联吡啶为配体组成)以及1.5 eq.的K3PO4作为碱,反应将获得75%产率的目标产物。并且在优化的反应条件下,环状和非环醚与酰氯或酸酐都可以合成α-酰化醚。
2018年,Yoshida课题组[25]报道了芳烃和四氢呋喃交叉脱氢偶联反应(Scheme 19)。反应采用其开发的TiO2光催化剂和Al2O3负载Pd-Au双金属催化剂组成的新型复合催化剂来完成,在不需要消耗任何氧化剂或其他额外的化学品前提下,实现了环醚和芳烃的CDC反应。
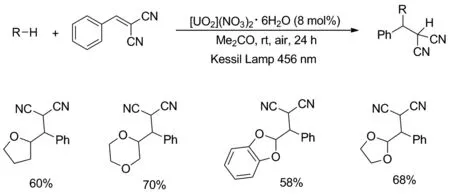
2019年,Ravelli课题组[26]公布了环醚通过自由基加成到2-亚苄基丙二腈上的双键上(Scheme 20)。反应选择了硝酸铀酰六水合物[UO2](NO3)2·6H2O作为光催化剂,在可见蓝光照射下,完成了C—H键到C—C键的直接转化,得到较高产率的加成产物。
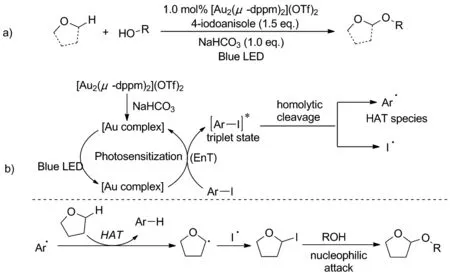
2020年,Hashmi课题组[27]通过使用碘代苯和原位形成的金络合物在可见光照射下实现了醚与醇的C(sp3)—H交叉脱氢偶联反应(Scheme 21a)。反应机理是:在蓝色发光二极管照射下,二聚金催化剂[Au2(μ-dppm)2](OTf)2和碳酸氢钠原位形成的新的金络合物可被激发,随后碘苯通过能量转移过程转变为光激发的三重态,发生均解裂解,生成芳基自由基和碘自由基。芳基自由基通过氢原子转移过程被THF捕获,生成的THF自由基又可与碘自由基进行重组形成α-卤代醚,随后被醇攻击得到相应的缩醛,完成醚α-C(sp3)—H官能化(Scheme 21b)。
Scheme 18
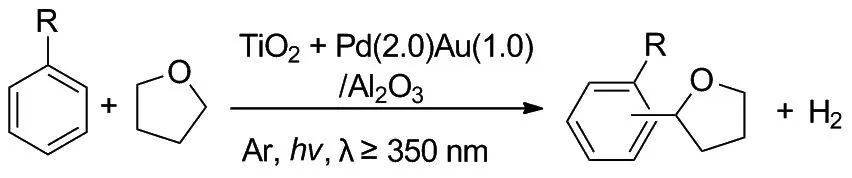
Scheme 19
Scheme 20
Scheme 21
Scheme 22
Scheme 23
3.2 非金属类光催化剂催化的醚α-C(sp3)—H官能化反应
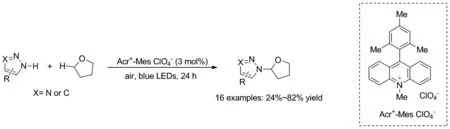
2017年,雷爱文课题组[28]开发了一种由可见光催化介导的四氢呋喃和唑的氧化交叉偶联反应(Scheme 22)。反应采用各种唑类为胺化试剂,使用Acr+-Mes ClO4-作为光催化剂,空气作为氧化剂,在蓝光照射下合成了多种四氢呋喃的胺化产物,也为N-取代的唑类化合物合成提供了新的绿色途径。
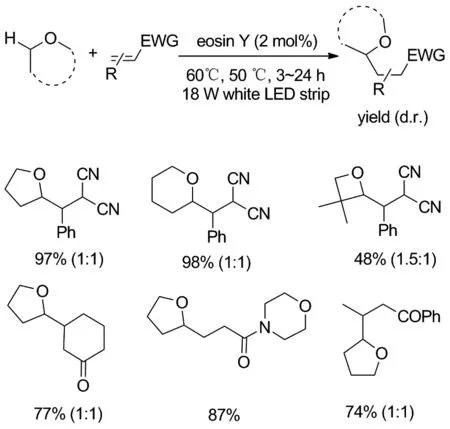
2018年,Fan等[29]开发了以曙红Y为催化剂的可见光介导的醚α-C(sp3)—H官能化反应(Scheme 23)。这是首次采用氧杂蒽染料作为直接氢原子转移光催化剂的例子。该反应以四氢呋喃(THF)作为底物和溶剂,与二氰基缺电子烯烃进行模型研究,在探索出了反应的最优条件后,对其他环醚类和缺电子烯烃进行的烷基化反应进行拓展,证明了反应具有广泛的底物范围。这种基于曙红Y的光催化氢原子转移策略有望以可持续的方式实现各种天然C—H键的官能化。
2019年,Wei等[30]报道了喹喔啉与简单醚的交叉脱氢偶联反应(Scheme 24)。反应在室温3 W蓝色灯光照射下,采用Rose Bengal作为光催化剂,DABCO作为碱,TBHP作为氧化剂,喹喔啉-2-酮衍生物和简单醚作为底物,获得各种3-氧化烷基化喹喔啉-2(1H)-酮醚化物,是一种原子经济且环境友好的反应途径。
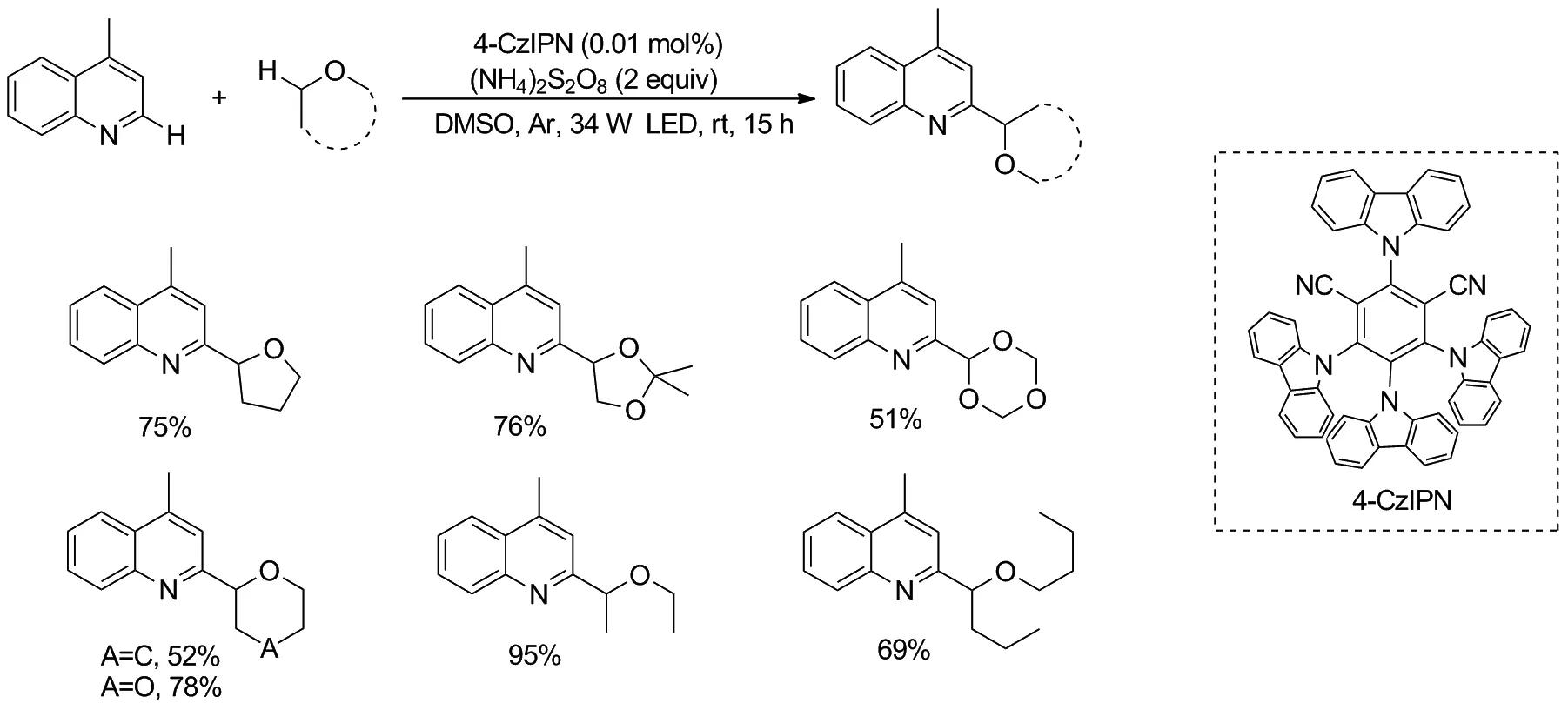
2020年,Tian等[31]报道了在无酸条件下的醚与N-杂芳烃的交叉脱氢偶联反应(Scheme 25)。反应使用廉价的无机过氧化物(NH4)2S2O8作为氧化剂,4-CzIPN作为能量转移的光催化剂,在蓝光照射的下,实现了未活化的醚的C(sp3)—H和N-杂芳烃之间直接偶联,具有较高的原子经济性以及良好的官能团相容性,合成步骤也大为减少。
3.3 无光催化剂下醚α-C(sp3)—H官能化反应
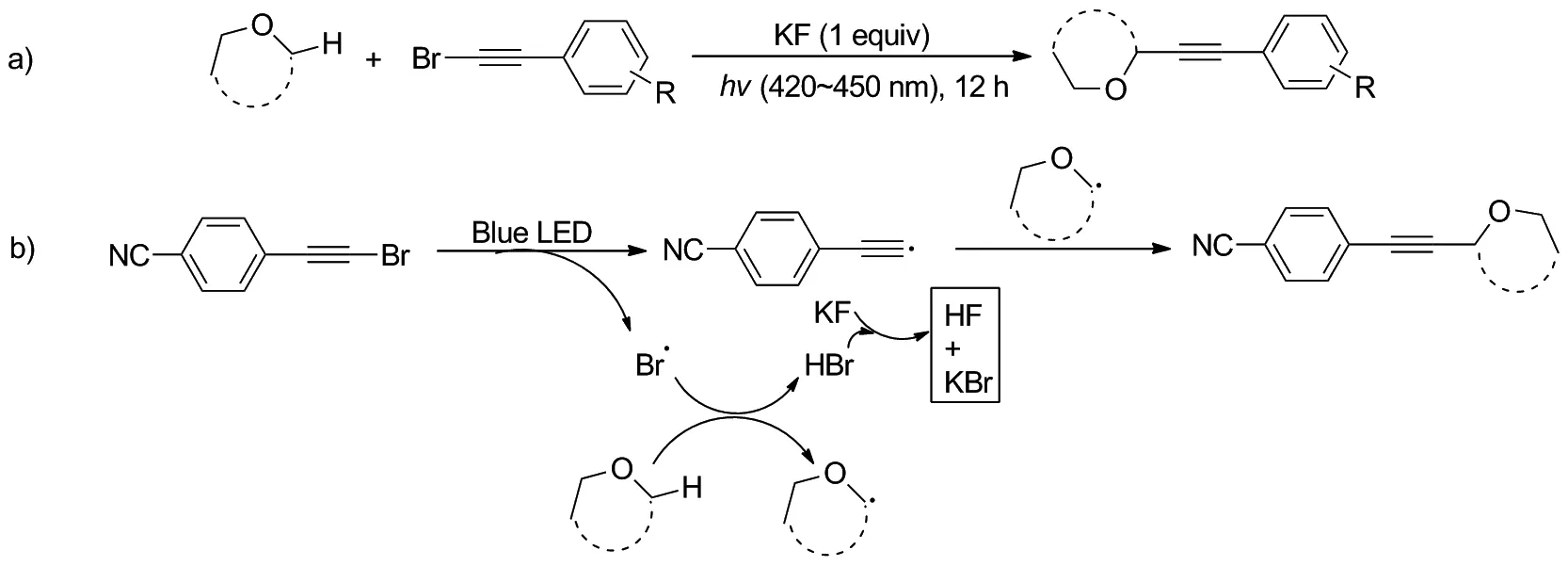
2019年,王敏课题组[32]开发了无外部光催化剂的情况下,可见光诱导的醚的α位C—H官能团化与炔基溴化物的反应(Scheme 26a)。反应仅在KF作为碱、光照及室温条件下,就可以高收率生成相应的α-炔基醚,可能的自由基进程是:在可见光(蓝色LED, 420~425 nm)照射下触发炔基溴化物裂解生成炔基自由基和Br自由基,形成的Br自由基通过醚的α-位C(sp3)—H键断裂与醚反应生成醚自由基,随后其与炔基自由基炔基化得到最终产物(Scheme 26b)。
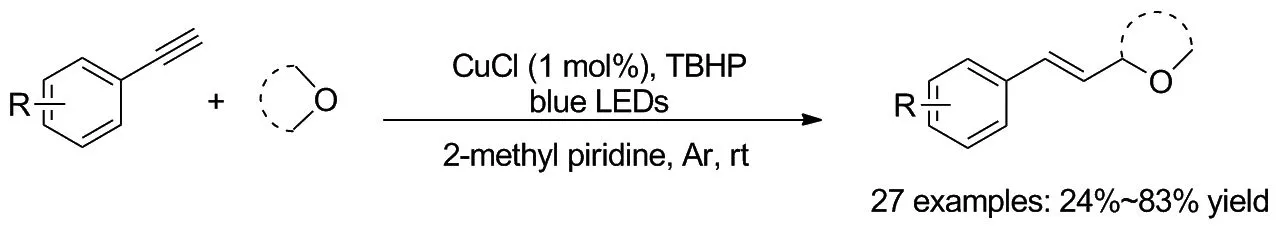
2020年,吴骊珠课题组[33]报道了环醚和苯乙炔的光氧化还原合成2-乙烯基环醚衍生物的方法(Scheme 27)。反应是以末端炔烃被CuCl活化形成Cu(I)-乙炔化物络合物作为光催化剂,被光激发后能够将电子传递至TBHP并生成t-BuO·自由基,从而激活环醚的α-C(sp3)—H键,得到所需的化合物。这种通过使用易于获得的原料和廉价的铜盐在原位形成光催化剂的方案,为炔烃的各种碳/杂原子中心自由基加成提供了新思路。

Scheme 24
Scheme 25
Scheme 26
Scheme 27
近年来,电化学脱氢氧化作为一种通用的、环境友好的合成方法,已经被用作通过直接C—H键活化偶联来构建新化学键的替代工具。电化学氧化可以通过单电子转移和随后的氢转移过程在电极表面方便地获得活性自由基物种。
2017年,雷爱文课题组[34]开发了一种在无金属催化剂和无氧化剂条件下,通过分子间氧化C(sp3)—H/N—H交叉氧化偶联直接实现在醚的α-位C—H键上连接胺的方法(Scheme 28)。反应首先在阳极发生氧化,通过单电子转移和随后的氢转移过程生成了氮自由基,然后氮自由基与醚类反应,得到交叉氧化偶联产物N1-烷基取代-1,2,3-三氮唑化合物。同时,质子氢的阴极还原导致氢气的形成。
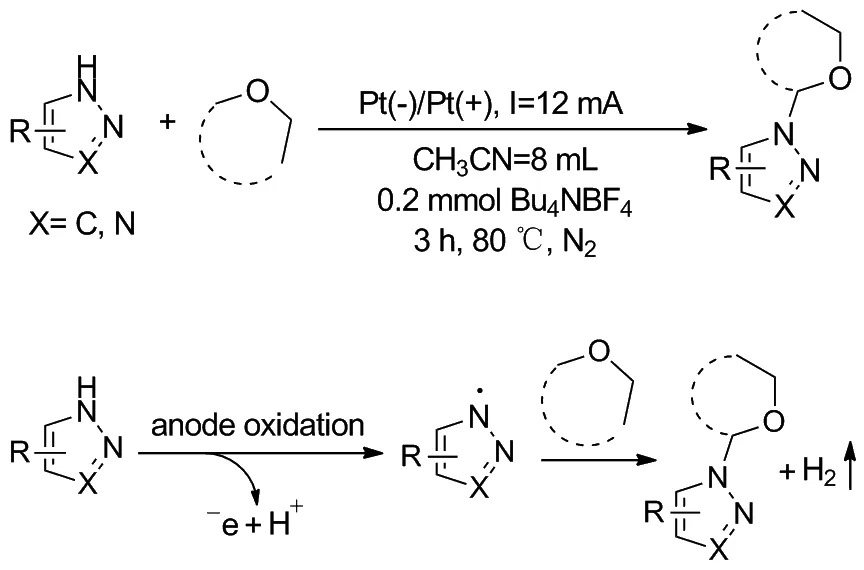
Scheme 28

Scheme 29
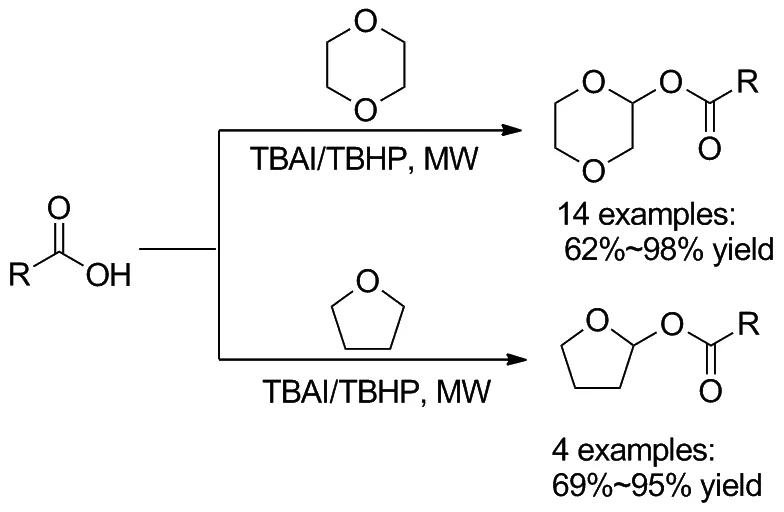
Scheme 30
2020年,Lambert课题组[35]则是通过电光催化实现了高区域选择性的醚的α-位C—H键的官能化(Scheme 29)。反应采用三氨基环丙烯离子(TAC)作为电光催化剂,通过电能和光化学能的较好结合,完成了醚与异喹啉、吡唑、嘌呤、烯烃和炔烃的无氧化剂偶联反应,实现了反应的高区域选择性。
在合成中使用微波(MAOS)已成为化学合成中的常用技术。2020年,Guerra等[36]报道了在微波辐射下环醚和羧酸的氧化偶联反应(Scheme 30)。反应采用四丁基碘化铵(TBAI)作为催化剂,叔丁基过氧化氢(TBHP)作为氧化剂,140 ℃微波照射10 min,以很好的产率得到了1,4-二恶烷-2-基酯。不过羧酸与THF之间的偶联效果却不是很好,在大多数情况下,反应会形成复杂的混合物。
环状和非环状醚结构存在于许多有机化合物、天然产物和生物活性化合物中,尽管醚结构在多数情况下是不活泼的,但是通过醚α-位C(sp3)—H官能化反应就可以使得含这些醚结构的化合物和其他的化合物发生反应生成复杂的醚衍生物,省去了醚的预官能团化过程,减少了合成的步骤,提高了合成的效率,使结构改造和醚衍生物的制备过程更具绿色环保意义。本综述总结了近3年来环醚和非环醚在不同的反应条件下,其α-位的C(sp3)—H官能化反应,这些反应的共同特点是大多经过自由基机理过程,并已在反应中通过使用自由基捕捉剂得到了验证。尽管人们在醚α-位C(sp3)—H官能化反应方面已取得了较大的发展,探索复杂醚的α-位C(sp3)—H官能化来构建新的C-C键和C-杂原子键衍生物仍然是有意义的研究课题,今后会看到更多有意义和价值的研究报道。
