磁性纳米活性炭的制备及其吸附性能研究
2021-08-13刘利军郭晨辉白雪梅段松青
韩 强, 刘利军, 郭晨辉, 白雪梅, 段松青
(山西省环境科学研究院,山西 太原 030027)
0 引言
近年来,随着工业化和城镇化的快速发展,自然资源开发强度增大,生活和工业生产污染物排放量随之增大,水污染形势十分严峻。通过饮用和食物链进入人体内的污染物会诱发多种疾病,人类五大疾病,伤寒、痢疾、胃肠炎、霍乱、传染性肝炎,均由不洁净的水引起,水中有机污染物的积蓄还会破坏水生生态系统的平衡[1]。废水处理方法一般包括物理处理法、化学处理法和生物处理法。目前,印染废水处理的方法主要有混凝法[2]、化学氧化法、电化学法、生物处理法和吸附法[3,4]。相对而言,物理吸附法在场地需求、操作管理以及处理效果等方面均有明显的优势[5,6]。活性炭因微孔发达、比表面积大、化学性稳定和吸附能力强等特点被广泛应用于化工、环保、食品、制药、催化剂载体和电极材料等领域,对于一般生物法难以去除的难降解物质具有很好的去除效果。粉末活性炭还具有吸附速率快和价格低廉的优点,但在实际使用过程中存在处理后与水难以分离、易堵塞、易流失等缺点,为此,有研究将磁性材料负载到活性炭上制备磁性吸附材料,赋予活性炭以磁性,从而可利用磁分离技术对活性炭进行分离、回收。磁性微颗粒吸附剂在化工及环境工程领域的开发与应用研究越来越受到关注,尽管利用磁性复合体材料加速污泥凝聚[7]、去除废水中染料[8]、治理酚类废水[9]等研究已取得一定的成果,但是吸附剂本身的比表面积或者是吸附容量小的缺点限制了其在实际生产中的推广应用。
鉴于工业染料污染和有机物污染在水体污染中普遍存在,本文采用磁性纳米活性炭分别处理亚甲基蓝模拟染料污染废水和苯酚模拟有机物污染废水进行试验,对其吸附动力学和吸附热力学进行研究,探讨磁性纳米活性炭处理染料污染废水和有机物污染废水的效果。
1 材料与方法
1.1 实验试剂与仪器
七水硫酸亚铁、六水氯化铁、氢氧化钠(上海晶纯试剂有限公司生产,分析纯)、市售无水活性炭(天津市大茂化学试剂厂生产)、亚甲基蓝(天津化学试剂厂生产,分析纯)、苯酚(天津化学试剂厂生产,分析纯)。
UV-9600紫外/可见分光光度计(北京北分瑞利分析仪器公司);恒温水浴振荡器(上海一恒科学仪器有限公司);PHS-3C型精密pH计(上海盛磁仪器有限公司);滚压振动磨机,HANGPING FA1604型电子天平(上海市鸿翔实验有限公司);F-Sorb2400-全自动比表面测定仪(北京金埃谱科技有限公司);VSM model 155振动样品磁强计(中国科学院物理研究所)。
1.2 磁性纳米活性炭的制备
在常温下,惰性气体氮气作为研磨环境条件,采用滚压振动磨机(规格为2.5L,电机功率为0.12kW)对活性炭进行滚压研磨30min,得到活性炭纳米颗粒(activated carbon nano-particles, nm-ACs)[10]。称19.5g硫酸亚铁和18.9g氯化铁溶于500mL去离子水,加入制备的活性炭纳米颗粒16.5g,用磁力搅拌机高速搅拌30min,高速搅拌下滴加氢氧化钠(100ml,5mol/L)溶液,把所得混合物在100℃水浴中陈化4h,冷却至常温,用去离子水反复洗涤产物,并于无水乙醇中超声波振荡20min后置于102~105℃干燥箱中真空干燥4h,得到磁性纳米活性炭复合吸附材料[11]。
1.3 磁性纳米活性炭的表征
磁性纳米活性炭的磁性、比表面积和孔隙结构分别用振动样品磁强计(VSM model 155)和F-Sorb2400-全自动比表面测定仪测定。
1.4 实验方法
1.4.1 模拟污染废水的配制及标准曲线的绘制
取10支50mL的具塞刻度试管,分别加入浓度为50mg/L的亚甲基蓝模拟染料污染废水溶液0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0mL,加入去离子水定容至50mL。用去离子水作参比,在665nm波长处测定其吸光度,记录数据,经空白校正后以浓度为横坐标,吸光度为纵坐标,绘制亚甲基蓝模拟染料污染废水的标准曲线,见图1。
取10支50mL的具塞刻度试管,分别加入浓度为10mg/L的苯酚模拟有机物污染废水溶液0、0.2、0.4、1.2、2.0、2.8、4.0、5.0、6.0、7.0mL,用适量去离子水稀释,然后加入0.5mL氯化铵—氨水缓冲溶液(pH=10.7),混匀,加1.0mL质量分数为2%的4-氨基安替比林溶液,混匀,再加1.0mL质量分数为8%铁氰化钾溶液,稀释到50ml,充分摇匀后,密闭放置10min,用去离子水作参比,在510nm波长处测定其吸光度,记录数据,经空白校正后以浓度为横坐标,吸光度为纵坐标,绘制苯酚模拟有机物污染废水的标准曲线,见图1。

图1 亚甲基蓝(左)、苯酚(右)的标准曲线
1.4.2 吸附动力学实验
取适量的磁性纳米活性炭,分别加入置有初始pH值为6.0的100mL(浓度为50mg/L、100mg/L、150mg/L)亚甲基蓝和苯酚溶液的具塞三角瓶中,在常温下于恒温水浴振荡器中振荡使其充分吸附,每隔一定时间取样测定溶液中亚甲基蓝和苯酚的剩余浓度,计算得出不同时刻的吸附量,并通过拟合伪一级和伪二级动力学方程得到相关参数。
1.4.3 等温吸附实验
向初始pH值为6.0的100mL系统浓度梯度(20~500mg/L)的亚甲基蓝和苯酚溶液的具塞三角瓶中加入适量的磁性纳米活性炭,调节恒温振荡器温度使其分别在20℃、30℃、40℃下振荡12h达到吸附平衡后,测定溶液中亚甲基蓝和苯酚的残留浓度,计算平衡吸附量,并通过拟合L模型和F模型得到相关参数。
1.4.4 磁性纳米活性炭对亚甲基蓝和苯酚的吸附及其磁分离脱附再生实验
(1)磁性纳米活性炭的吸附实验
分别取50mL适当浓度的亚甲基蓝和苯酚溶液于150mL具塞三角瓶中,加入定量磁性纳米活性炭,置于一定温度的恒温水浴振荡器中,以200r/min的振速振荡一定时间,使其充分吸附。吸附完成后,得到的混合溶液用0.45μm滤膜过滤,利用UV-9600紫外/可见分光光度计分别在665nm和510nm波长处测量吸光度,通过标准曲线确定溶液中亚甲基蓝或苯酚剩余浓度,运用公式(1)和(2)分别计算吸附量及吸附率:
(1)
(2)
式中:η1为吸附率;C为溶液中剩余吸附质浓度(mg/L);C0为吸附前溶液初始浓度(mg/L);q为吸附剂对吸附质的吸附量(mg/g);V为溶液体积(L);m为吸附剂质量(g)。
(2)磁性纳米活性炭的磁分离脱附再生
本实验采用磁分离法对吸附饱和的磁性纳米活性炭进行脱附再生。首先将吸附饱和后的磁性纳米活性炭吸附质混合物在60℃下进行干燥,接着用无水乙醇、去离子水依次充分洗脱,102~105℃下干燥4h后,进行再次吸附,通过比较再生前与再生后的饱和吸附量考察其再生效果。磁性纳米活性炭的再生效率可以通过公式(3)计算得到:
(3)
式中:q′为再生后磁性纳米活性炭的饱和吸附量(mg/g);q0为再生前磁性纳米活性炭的饱和吸附量(mg/g);η2为磁性纳米活性炭的再生效率。
2 实验结果与讨论
2.1 磁性纳米活性炭的表征
纯活性炭、铁氧化物和磁性纳米活性炭等材料的表征参数(表1)由VSM model 155振动样品磁强计(常温,外加磁场强度-20000~20000oe)和F-Sorb2400-全自动比表面测定仪测定得到。

表1 吸附材料表征参数
由表1可知,常温制备的磁性纳米活性炭比饱和磁化强度为7.65emu/g,具有较好的磁性,适用于溶液中磁诱导的固液分离。相比于纯活性炭,磁性纳米活性炭的比表面积和平均孔容较小,平均孔径有所增大;磁性纳米活性炭的比饱和磁化强度、平均孔径和平均孔容都介于活性炭和铁氧化物之间。这是由于铁氧化物的比表面积和平均孔容都很小,所以与活性炭结合后导致了其比表面积和平均孔容的下降;而铁氧化物的平均孔径较大,与活性炭结合后导致了其平均孔径的增大。
2.2 磁性纳米活性炭的吸附能力
2.2.1 吸附时间对吸附率的影响
在25℃,pH为6.0的实验条件下,选取浓度为50mg/L的亚甲基蓝溶液和10mg/L的苯酚溶液,加入定量的磁性纳米活性炭,分别置于恒温水浴振荡器中,200r/min振荡不同时间,研究吸附时间对吸附过程的影响,结果见图2。

图2 吸附时间对亚甲基蓝(左)、苯酚(右)吸附率的影响
由图2可知,磁性纳米活性炭对亚甲基蓝的吸附率在30min内随着吸附时间的延长缓慢增大,30min后磁性纳米活性炭对亚甲基蓝的吸附率维持在93.5%~95.7%,吸附过程达到平衡。磁性纳米活性炭对苯酚的吸附率在30min内随着吸附时间的延长明显增大,30min后磁性纳米活性炭对苯酚的吸附率维持在95.7%~95.9%,吸附过程达到平衡。因此,在一定时间范围内磁性纳米活性炭的吸附能力随吸附时间的延长而增大[12],然后趋于平衡。这是由于吸附反应初期,吸附材料上可供吸附的点位较多,吸附质与吸附剂表面吸附质浓度梯度较大,推动吸附反应的进行;随着吸附时间的增加,吸附剂剩余活性吸附点位逐渐减少,吸附过程趋于饱和。
2.2.2 吸附质初始浓度对吸附率的影响
在25℃,pH为6.0的实验条件下,分别选取初始浓度为5、10、15、20、25、50、75、100、125和150mg/L的亚甲基蓝和苯酚溶液,加入定量的磁性纳米活性炭,200r/min振荡30min,研究溶液初始浓度对吸附过程的影响,结果见图3。

图3 亚甲基蓝(左)、苯酚(右)初始浓度对吸附率的影响
由图3可知,当亚甲基蓝的初始浓度在100mg/L以下时,吸附率变化不大,维持在96%左右;当亚甲基蓝溶液的初始浓度>100mg/L后,吸附率随浓度的增大而逐渐减小。苯酚溶液的初始浓度在10mg/L以下时,随着初始浓度的增大,吸附率增加明显;当苯酚溶液的初始浓度超过10mg/L后,吸附率高达95.8%,若继续增大初始浓度,吸附率几乎不再增加。当吸附剂投加量一定时,吸附质存在最适浓度,这是由于体系中能提供的吸附活性点位数量有限,吸附质浓度高于其最大饱和吸附量时,吸附剂将不能吸附更多吸附质,所以苯酚溶液的初始浓度超过10mg/L后,吸附量达到饱和,吸附率趋于稳定,而亚甲基蓝溶液的初始浓度>100mg/L后,吸附率持续降低。
2.2.3 溶液pH值对吸附率的影响
在25℃的实验条件下,分别选取浓度为50mg/L的亚甲基蓝和10mg/L的苯酚溶液,梯度设置溶液的pH值,200r/min振荡30min,研究溶液pH值对吸附过程的影响,结果见图4。
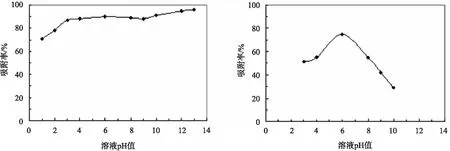
图4 pH值对亚甲基蓝(左)、苯酚(右)吸附率的影响
由图4可知,当亚甲基蓝溶液的pH值在3.0~9.0时,吸附率变化较小,当pH值在1.0~3.0和9.0~13.0时,吸附率随pH值升高而增大,但变化幅度较小。对于苯酚溶液,当pH值在3.0~6.0时,吸附率随溶液pH值的增大而逐渐增大;pH值在6.0时,吸附率最大,为76.1%;当pH值在6.0~10.0时,吸附率随溶液pH值的增大而减小,且下降趋势较酸性条件下更明显。因此,磁性纳米活性炭对苯酚的吸附过程在中性或较酸性条件下更容易[13]。溶液pH是影响吸附材料吸附性能的重要因素,因为它可以影响吸附质和吸附剂的表面电荷性质与官能团的存在形式。亚甲基蓝是阳离子型染料,在水中带正电荷,Fe3O4的等电点为6.5[14],因此当溶液pH>6.5时,磁性活性炭颗粒表面大量吸附位点处于去质子化状态,表现为位点的负电荷增加,故在碱性条件下更有利于阳离子型染料吸附;而pH值为3.0~13.0时,磁性生物活性炭对亚甲基蓝溶液的吸附性能均较强,说明该吸附剂对亚甲基蓝溶液有较宽的pH吸附范围。苯酚在水中电离呈弱酸性[15],对pH变化条件下磁性纳米活性炭的吸附过程较为敏感,吸附率存在峰值。
2.2.4 吸附动力学
为了研究磁性纳米活性炭在吸附过程中的吸附效率和磁性纳米活性炭规模化应用的可行性,选择伪一级动力学模型、伪二级动力学模型和颗粒内扩散方程对动力学实验数据进行拟合。
伪一级动力学模型和伪二级动力学模型是研究吸附动力学过程最常用的两种模型,其应用前提是吸附过程为伪化学反应过程。伪一级动力学模型假设吸附速率受扩散步骤的控制,伪二级动力学模型假设吸附速率受化学吸附控制为主,且涉及到吸附剂与吸附质之间的电子共用或转移。其线性表达式分别为[16]:
In(qe-qt)=Inqe-k1t
(4)
(5)
式中:k1、k2分别为伪一级动力学速率常数(min-1)和伪二级吸附速率常数(g/(mg·min);qe是平衡吸附量(mg/g);qt是t时的吸附量(mg/g)。
若吸附符合伪一级动力学模型,则In(qe-qt)对t作图为一条直线;若吸附符合伪二级动力学模型,则t/qt对t作图为一条直线。
颗粒内扩散在溶液中吸附质传递到固相过程中的作用不容忽视,颗粒内扩散方程的线性表达式为[17]:
qt=Kpt0.5+C
(6)
(7)
式中:kp是颗粒内扩散速率常数(mg·g-1·min-0.5),它与颗粒内扩散系数D有关;C是截距,反映了边界层的厚度,与边界层效应呈正相关;R是颗粒半径(cm-1)。
以qt对t0.5作图,若拟合直线通过坐标原点,说明反应速率主要受吸附质在吸附剂颗粒内扩散过程的控制;若拟合直线未通过原点,则反应速率受多个过程的综合控制。
用以上三种动力学模型或方程分别对动力学数据进行拟合,并得到拟合曲线图5~图7,各方程中的相关参数见表2。

图5 伪一级动力学方程拟合曲线

图6 伪二级动力学方程拟合曲线

图7 颗粒内扩散方程拟合曲线
由图5~图6的拟合结果可知,以t/qt-t作图得到的趋势线全部接近直线;由表2可知,伪二级动力学模型拟合得出的R2更接近于1,且伪二级动力学模型拟合得到的平衡吸附量qe2更接近实验获得的平衡吸附量qe,exp。因此,在实验室模拟条件下,伪二级动力学模型更适合描述磁性纳米活性炭对亚甲基蓝和苯酚的吸附过程[18]。由图7可知,亚甲基蓝的qt-t0.5趋势线接近于直线,但不通过原点,qt和t0.5呈现出较好的线性关系,这说明颗粒内扩散过程是磁性纳米活性炭吸附亚甲基蓝的控制步骤,但吸附过程同时受其他颗粒外扩散过程的影响;苯酚的qt-t0.5趋势线呈弯曲状态,qt和t0.5之间的线性关系较差,这说明颗粒内扩散过程不是磁性纳米活性炭吸附苯酚的控制步骤,吸附过程主要受表面吸附和液膜扩散等颗粒外扩散过程的控制。

表2 磁性纳米活性炭吸附亚甲基蓝和苯酚的动力学参数
2.2.5 等温吸附
等温吸附线是研究吸附过程的重要依据,可用来描述吸附剂与吸附质间的平衡关系、亲和力及吸附剂的吸附能力。利用Freundlich方程和Langmuir方程[19-21]分别在20℃、30℃、40℃三个温度条件下拟合磁性纳米活性炭对亚甲基蓝和苯酚的吸附过程,探讨其吸附机理。吸附等温线见图8,拟合结果及相关参数见表3。

表3 磁性纳米活性炭吸附亚甲基蓝和苯酚的等温方程拟合参数

图8 吸附等温线
Freundlich方程为经验公式,计算简便且应用广泛,公式中的n值可作为判断吸附过程是否容易发生的依据:当n值<0.5时,吸附过程较难发生;n值越大,吸附过程越容易进行。Langmuir方程假设吸附过程为单层表面吸附,所有的吸附位点具有相同的能量,且已吸附的分子之间没有作用力,吸附平衡是动态的平衡[22]。其线性表达式分别为:
(8)
(9)
式中:qe是平衡吸附量(mg/g);KF是Freundlich等温方程常数;n是与吸附热有关的常数;Ce为平衡浓度(mg/L);qmax是吸附剂的理论最大吸附量(mg/g);KL是Langmuir等温方程常数(L/mg)。
由图8可知,当溶液初始浓度较低时,随着初始浓度的增大,平衡吸附量的增大趋势较为明显;当溶液初始浓度增大到一定程度后,随着初始浓度的增大,平衡吸附量缓慢增加并趋于稳定,表明吸附剂对溶液中吸附质的吸附达到饱和。对比表3中两种方程的拟合参数,Langmuir方程的R2均大于Freundlich方程,说明磁性纳米活性炭对亚甲基蓝和苯酚的吸附行为更符合Langmuir方程,吸附过程主要是单分子层吸附,吸附过程受氢键和静电引力相互作用的影响。最大吸附量qmax与温度之间呈正相关关系,温度升高有利于吸附反应进行,磁性纳米活性炭对亚甲基蓝和苯酚的吸附均为吸热过程。
2.3 磁分离脱附再生
考虑经济环保的原则,对使用过的吸附剂进行回收再利用。磁性纳米活性炭对亚甲基蓝和苯酚吸附饱和后的磁分离脱附再生实验结果显示,磁分离脱附率可以达到30%左右,可以与其他再生方式配合用于磁性纳米活性炭的再生。制备的磁性纳米活性炭具有良好的稳定性、再生性和重复利用性,避免了二次污染的产生,在实际应用中具有重要意义。
3 结论
(1)亚甲基蓝吸附率在30min内随吸附时间的延长缓慢升高,30min后吸附率维持在93.5%~95.7%,吸附过程趋于平衡;苯酚吸附率在30min内随吸附时间的延长明显升高,30min后,吸附率维持在95.7%~95.9%,吸附过程趋于平衡。
(2)亚甲基蓝在初始浓度<100mg/L时,吸附率变化不大,维持在96%左右,初始浓度超过100mg/L后,吸附率随初始浓度的增大而逐渐降低;苯酚在初始浓度<10mg/L时,随着初始浓度的增大,吸附率升高明显,浓度超过10mg/L后,随着初始浓度的增加,吸附率稳定在95.8%左右。
(3)亚甲基蓝的吸附率随pH值升高而增大;苯酚的吸附率随pH值升高先增大后降低,当pH值为6时,吸附率最大。
(4)磁性纳米活性炭对亚甲基蓝和苯酚的吸附过程更符合伪二级动力学方程,且主要受化学作用控制;亚甲基蓝和苯酚的等温吸附过程是以化学吸附为主的吸热反应,符合Langmuir方程。
(5)磁性纳米活性炭对亚甲基蓝的吸附速率同时受颗粒内和颗粒外扩散过程的控制;磁性纳米活性炭对苯酚的吸附速率受表面吸附和液膜扩散等颗粒外扩散过程的控制。
(6)磁性纳米活性炭的磁学性能较好,可采用磁分离方法与其他再生方式相配合的方式,进行磁性纳米活性炭的再生。
