锂离子电池负极材料用纳米铁酸锌的制备及研究进展
2021-08-13马悦鹏郝百川严红燕
马悦鹏,李 慧,郝百川,严红燕,王 乐
1)华北理工大学电气工程学院,唐山 063210
2)华北理工大学冶金与能源学院,唐山 063210
锂离子电池因具有循环性能好等优良性能而被广泛应用[1]。目前,金属硫/氧化物、合金材料、硅/锡基材料以及各种碳材料等新型高性能负极材料成为研究热点[2-3]。以石墨为负极材料的传统锂离子电池在充放电过程中层间距易发生改变,引起石墨粉化和剥落[4],且在石墨表面会产生锂枝晶[5],缩短锂离子电池的使用寿命,降低循环稳定性能。此外,碳负极材料比容量的实际值与理论值(372 mAh·g−1)接近,无法满足在某些领域的应用。
新型锂离子电池的开发研究在当今时代愈发重要。锂离子电池的负极材料常采用过渡金属氧化物[6],其理论比容量高、电化学性能活跃、环保性能优良[7-8],具有很大的发展空间和研究价值。纳米材料因具备表面效应、体积效应、量子尺寸效应、宏观量子隧道效应等[9]独特性质,在实际应用与理论研究上有极大的价值,逐渐成为当今科技发展的前沿。传统铁酸锌具有较高的比容量、工作安全以及环保等特点,在充当电池的负极材料方面有着很大的发展空间,可作为新型锂离子电池的备选材料之一。本文综述了水热法、溶剂热法、静电纺丝技术、共沉淀法等ZnFe2O4制备工艺,并研究了不同工艺制备的纳米ZnFe2O4形貌结构和电化学性能。
1 水热法
水热法[10]是通过对特定的设计装置进行加热,在高温高压下将一般无法溶解或难以溶解的物质进行重组。水热法所制得的粒子粉末分散性好、粒径分布较窄、形貌可控[11]。Xing等[12]将Zn(OAc)2·2H2O (0.35 g)和FeSO4·7H2O(1 g)溶于离子水后搅拌,并加入N2H4·H2O,在高压釜、180 ℃下加热一定时间,随后冷却到室温,经过滤、洗涤、干燥,制得如图1所示粒径约为200 nm的八面体结构ZnFe2O4。图2所示为该ZnFe2O4电极材料的电化学性能。如图所示,当电流密度为60 mA·g−1时,循环80圈后,ZnFe2O4电极材料的可逆比容量为910 mAh·g−1;当电流密度增大到1000 mA·g−1时,循环300圈后,其可逆比容量达到730 mAh·g−1,证明八面体结构的ZnFe2O4具有优良的电化学性能。

图1 典型ZnFe2O4八面体显微形貌(a),单个ZnFe2O4晶粒显微形貌(b)和{111}面封闭ZnFe2O4八面体结构模型(c)[12]Fig.1 Representative scanning electron microscope (SEM)image of ZnFe2O4 octahedrons (a),SEM image of the individual ZnFe2O4 particle (b),and the structure model of ZnFe2O4 octahedrons enclosed by {111} face (c)[12]
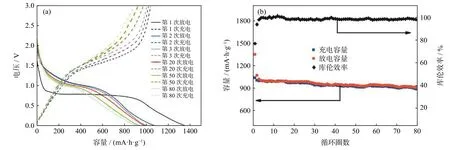
图2 ZnFe2O4电极材料电化学性能:(a)选定循环的放电/充电曲线;(b)放电/充电容量和库仑效率与循环次数的关系曲线[12]Fig.2 Electrochemical performance of the ZnFe2O4 electrode materials: (a)the discharge/charge profiles for the selected cycles;(b)the discharge/charge capacity and coulombic efficiency as a function of cycle number[12]
Xie等[13]将石墨置于去离子水中,经超声波处理后,缓慢加入1 mmol Zn(NO3)2·6H2O和2 mmol Fe(NO3)3·6H2O,搅拌后加入KOH并倒入高压釜,置于电炉中加热,所得产物经分离、洗涤、干燥后得到ZnFe2O4/G。实验结果表明,在首次充电过程中,当电流密度为400 mA·g-1时,ZnFe2O4可逆比容量达到763 mAh·g-1,循环300次后,可逆比容量降低到549 mAh·g-1,容量保持率为72%;当电流密度增大一倍后,首次充电后容量基本稳定在464 mAh·g-1,保持率为66%。该工艺很大程度上提高了ZnFe2O4结构的稳定性和导电性能,其自身的电化学性能和稳定性得到提升。此外,石墨的导电性和孔隙结构使其自身的电化学性能和稳定性得到进一步提升[14]。
Guo等[15]将(NH4)2Fe(SO4)2·6H2O、ZnSO4·7H2O和葡萄糖在180 ℃进行水热反应24 h,然后将漂洗产物在600 ℃的空气中退火2 h,合成ZnFe2O4中空微球。实验结果表明,在首次充放电过程中,ZnFe2O4总容量达到1200 mAh·g-1;在随后的循环中,当电流密度为65 mA·g-1时,循环50圈,其可逆容量稳定在900 mAh·g-1;当电流密度提升到650 mA·g-1时,其容量仍可达到500 mAh·g-1,说明合成的ZnFe2O4中空微球具有优良的电化学性能及稳定性能。此外,该方法制备的ZnFe2O4特有中空结构提升了材料的容量,同时也增强了材料的稳定性。
2 溶剂热法
溶剂热法是在密闭体系内以及一定温度和溶液的自生压力下,以有机物或非水溶媒为溶剂的合成方法。有机溶剂相较于其他溶剂沸点较高,因此溶剂热法可以在更高的温度下进行反应,所得产物的形貌、结晶度、尺寸更加容易控制[16]。
廖丽霞等[4]将ZnCl2和FeCl3·6H2O溶于乙二醇,加入适量尿素,搅拌后置于反应釜中得到纳米ZnFe2O4,对所制备的材料进行了扫描电子显微镜 (scanning electron microscope,SEM)和透射电子显微镜(transmission electron microscope,TEM)观察,结果如图3所示,该材料为纳微分级多孔尖晶石状,粒径约250 nm。该ZnFe2O4材料的循环性能曲线如图4所示,电解液与活性材料的接触能力因特有的多孔结构而增强,Li+扩散路径明显缩短,大倍率放电性能显著提高[17]。首次脱嵌锂后,比容量为850 mAh·g−1,库伦效率稳定在99.5%;电流密度为50 mA·g−1时,循环100次后,可逆比容量保持率为87.2%(813.5 mAh·g−1),库伦效率仍高于95%;当电流密度增大到400 mA·g−1时,其比容量约为355 mAh·g−1,表现出较高的倍率性能。采用该法制备得到的纳米ZnFe2O4具有比容量高、循环稳定好等优点,其循环稳定性、电化学性及可逆性远优于传统商业化石墨,是一种具有较强应用前景的锂离子电池负极材料。

图3 ZnFe2O4扫描电子显微形貌(a)及透射电子显微形貌(b)[4]Fig.3 SEM (a)and TEM (b)images of ZnFe2O4[4]

图4 ZnFe2O4电极的恒流充放电曲线(a)和循环性能(b)[4]Fig.4 Charge-discharge curve (a)at the constant current and the cycling performance (b)of the ZnFe2O4 electrode[4]
韩臻臻等[18]将FeCl3·6H2O、ZnCl2和无水醋酸钠溶于乙二醇,加入通过改进Hummer法制备的石墨烯,震荡后置于高压釜中,制备得到纳米ZnFe2O4−石墨烯复合材料。当电流密度为1000 mA·g−1时,ZnFe2O4−石墨烯复合材料的比电容为180.9 F·g−1,比表面积为180 m2·g−1。该方法使电极材料表面的活性位点数量有效增加,为锂离子参与反应提供更多位置。此外,石墨烯的导电作用提高了电子传输效率,使该复合材料具有比纯铁酸锌电极更加优异的电化学性能[19]。
3 静电纺丝技术
静电纺丝技术[20]是在高压静电场力作用下,聚合物溶液或熔体发生喷射拉伸,经溶剂挥发或熔体固化,得到超细纤维的一种方法。该工艺制备所得的纳米纤维膜具有超大比表面积和极高的孔隙率,且其结构、尺寸以及形貌可控性强。
费雅倩[21]采用静电纺丝−高温煅烧的方法制备出ZnFe2O4纳米纤维,其形貌结构如图5所示。室温下对该材料进行电位区间0.01~3 V、电流密度50 mA·g−1的充放电测试,结果如图6所示。在首周的充放电过程 中,该材料具有877 mAh·g−1和1248 mAh·g−1的比容量,库伦效率为70.2%;容量在前10周的循环中衰减较快,充电容量从877 mAh·g−1下降到600 mAh·g−1左右;在随后的循环过程中,容量慢慢上升至625 mAh·g−1,并趋于稳定,库伦效率为99.2%。该材料因其连续的纤维形貌、丰富的孔隙构成和较大的比表面积,为锂离子的传输提供了良好的通道,加快了反应的进行,且纳米颗粒不易团聚,使材料的电化学性能显著提升。此外,孔隙结构的增加可提供更多活性位点和可用通道,促进离子和电解质输送[22]。

图5 ZnFe2O4纳米纤维透射电镜形貌[21]Fig.5 TEM image of ZnFe2O4 nanofibers[21]
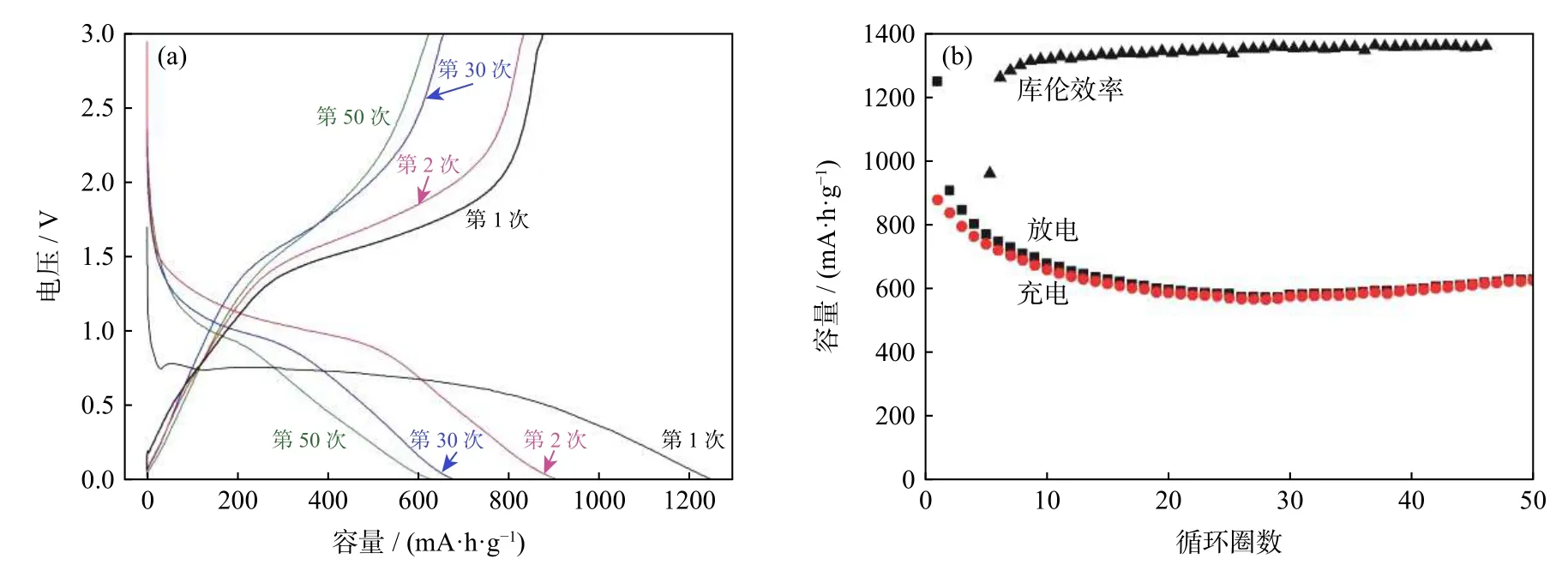
图6 ZnFe2O4纳米纤维的充放电曲线(a)和循环能图(b)[21]Fig.6 Galvanostatic charge-diacharge curve (a)and the cyclic performance curve (b)of ZnFe2O4 nanofibers[21]
曹慧[7]利用静电纺丝−多巴胺水解进行碳包覆制备了ZnFe2O4纳米纤维(ZFO@C-NF)和纳米管 (ZFO@C-NT)两种材料。当电流密度从100 mA·g−1增大到3200 mA·g−1时,ZFO@C-NF的可逆容量从920 mAh·g−1衰减到678 mAh·g−1,ZFO@C-NT的可逆容量从979 mAh·g−1衰减到539 mAh·g−1;当电流密度恢复到100 mA·g−1时,ZFO@C-NF和ZFO@C-NT的可逆比容量分别为1064 mAh·g−1和1047 mAh·g−1。在较高的电流密度下,两种材料仍具有可观的可逆比容量,同时在测试中两种材料呈现出了良好的倍率性能和循环性能,ZFO@C-NT的管状结构为Li+提供了良好的传输路径,使锂离子的传输效率加快。碳层的包覆不仅提升了材料的导电性,而且增强了材料结构的稳定性,有效阻止了充放电过程中团聚现象的发生[23]。
Teh等[24]将聚乙烯吡咯烷酮(PVP)溶解在无水乙醇中,在剧烈搅拌下,将Zn(CH3COO)2·2H2O和Fe(NO3)3·9H2O混合在去离子水和乙酸中,添加适量的PVP/乙醇溶液,在室温下剧烈搅拌,获得均匀溶液;将前体溶液装入注射器中,针头连接到高压电源,通过注射泵以恒定流速喷射溶液,将初纺纤维加热,制得深棕色ZnFe2O4纳米纤维网。研究表明,ZnFe2O4纳米纤维首次充放电容量为925 mAh·g−1,当电流密度达到60 mA·g−1,循环30圈,ZnFe2O4纳米纤维仍具有733 mAh·g−1的稳定容量,库仑效率高于95%,甚至随着循环的进行略有增加。实验发现,当金属前体的质量保持恒定,增大PVP的用量达到一定比例时,在热解过程中,前体中金属离子会因为PVP的增多,发生部分聚集而造成纤维的断裂,从而得ZnFe2O4纳米棒,在相同电流密度下循环相同圈 数,纳米棒只有200 mAh·g−1左右的可逆比容量。
4 其他方法
4.1 化学共沉淀法
Zhong等[25]将FeSO4·7H2O和ZnCl2水溶液注入H2C2O4中,经离心、去离子水和无水乙醇洗涤、真空干燥,将沉淀物转移到管式炉中,并在773 K空气中退火制得纳米棒状ZnFe2O4,其形貌如图7所示,其充放电测试结果如图8所示。在电流密度达到100 mA·g−1,循环50圈后,材料的可逆比容量仍可达到983 mAh·g−1;当电流密度从2000 mA·g−1逐渐下降到200 mA·g−1时,其可逆比容量容量从483 mAh·g−1上升到750 mAh·g−1,随后保持稳定。纳米棒是由一个个ZnFe2O4小颗粒堆积而成,其独特的纳米结构不仅可以提供高孔隙率,有效地承受充电/放电过程中的体积变化,而且可以有效地缩短Li+扩散的路径,有助于改善电化学性能。此外,化学共沉淀法制备的纳米ZnFe2O4具有颗粒均匀、粒径小、活性好、分散性好等特点[26]。

图7 采用草酸溶液制备的 ZnFe2O4 显微形貌:(a)乙醇体积分数 0%;(b)乙醇体积分数 50%;(c)乙醇体积分数 100%[25]Fig.7 SEM images of ZnFe2O4 prepared with the oxalic acid solution: (a) ethanol volume fraction 0%; (b) ethanol volume fraction 50%;(c) ethanol volume fraction 100%[25]

图8 ZnFe2O4循环性能(a)和速率性能(b)[25]Fig.8 Cycling performance (a)and rate performance (b)of ZnFe2O4[25]
4.2 液相辅助合成法
Jia等[27]将Fe(NO3)3·9H2O在氩气气氛下加热,除去结晶水,得到Fe(NO3)3;将1-氟-3-甲基咪唑鎓四氟硼酸盐(BMIMBF4)和乙烯醇的混合物作溶剂介质,将Zn(O2CCH3)2和Fe(NO3)3溶解在上述溶剂中,转移至聚四氟乙烯浸渍高压釜中,经离心、去离子水和乙醇交替洗涤、真空干燥,将所得固体产物在氩气氛下煅烧,制备得到纳米颗粒状ZnFe2O4/C复合材料,其形貌如图9所示,其充放电测试结果如图10所示。当电流密度达到20 A·g−1时,纳米颗粒状ZnFe2O4/C复合材料容量依然能够维持在216 mAh·g−1左右;在500 mA·g−1的电流密度下,循环充放电190次之后,复合材料容量依然能保持在1091 mAh·g−1。因为纳米颗粒状ZnFe2O4/C复合材料的粒径仅有40~80 nm,在脱嵌锂的过程中,纳米颗粒状复合材料的体积效应得到了很好地遏制,具有良好的循环稳定性能。此外,碳层的包覆增加了材料的比表面积,增加活性位点的数目,缩短了锂离子的传输路径,使材料的导电性能提高[28]。

图9 ZnFe2O4/C复合材料高分辨显微形貌[27]Fig.9 High resolution TEM images of the ZnFe2O4/C composites[27]
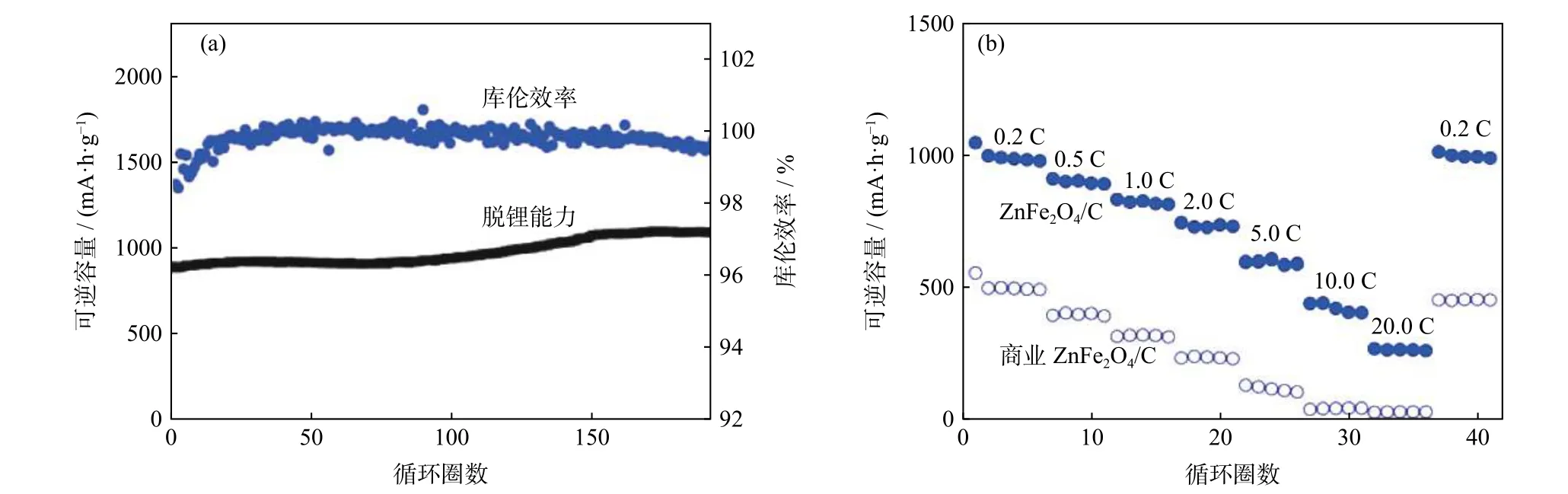
图10 ZnFe2O4/C复合材料恒定电流循环的脱锂能力和库伦效率(a)及可逆容量曲线(截止电压:0.01 V和3.00 V)(b)[27]Fig.10 De-lithiation capacity and coulombic efficiency at the constant current cycling (a)and the reversible capacity curves of the ZnFe2O4/C composite materials at the different specific currents (cut-off voltages: 0.01 V and 3.00 V)(b)[27]
4.3 固相反应法
Bai等[29]将ZnCl2、FeCl2·6H20和NaOH在 玛瑙研钵中均匀研磨2 h,取混合粉末溶解在烧杯中,常温磁力搅拌24 h,将产物离心、过滤,在120 ℃下烘干12 h,研磨压片,最后置于马弗炉中煅烧,制得尖晶石结构ZnFe2O4粉体材料(粒径约为500 nm),比表面积为136.7 m2·g−1,显微形貌如图11所示。电化学测试结果如图12所示,当电流密度为60 mA·g−1时,从第1周期到第30周期,ZnFe2O4电极的充电容量从601 mAh·g−1衰减到465 mAh·g−1,容量保持率为77.4%,显示出了较好的储锂容量和循环性能。

图11 固相法制得的ZnFe2O4显微形貌[29]Fig.11 SEM image of ZnFe2O4 prepared by solid-state method[29]
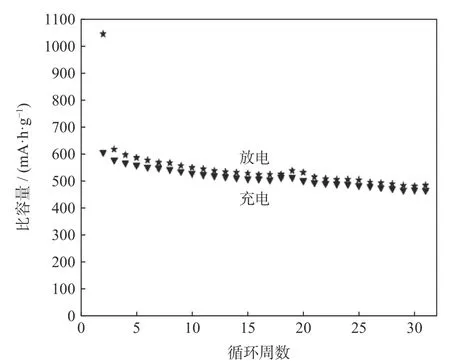
图12 固相法制得的ZnFe2O4循环稳定性(电压3.00~0.05 V、电流密度60 mA·g−1)[29]Fig.12 Cyclic stability of ZnFe2O4 prepared by solid phase method at the voltage range of 3.00~0.05 V and the current density of 60 mA·g−1[29]
5 结语与展望
运用水热法制备的纳米铁酸锌产物分散性好,采用溶剂热法制备纳米铁酸锌的生产成本低并且制作过程较简便,利用静电纺丝技术制备纳米铁酸锌实现了对产物尺寸、形貌的可控,通过共沉淀法制备纳米铁酸锌可以使原料细化和混合均匀。尽管各种制备方法对铁酸锌性能均有所提升,但仍存在缺陷:水热法对原料的纯度要求高,复杂的制作过程限制了其在工业上的大规模生产;共沉淀法中沉淀剂的加入可能会使局部产物浓度过高,引起团聚或组织不均匀;静电纺丝技术在纤维结构调控方面还存在不足。铁酸锌的开发与研究处于起步阶段,为实现其大规模的工业化生产,对于铁酸锌性能的改进有待进一步地研究与探讨。
(1)铁酸锌基锂离子电池在充放电过程中,由于自身导电性差以及体积效应限制了该材料电化学性能的发挥。通过改变材料本身的形貌结构,控制孔径大小,或与碳复合等方法都能在一定程度上提升ZnFe2O4的电化学性能,将材料制备成纳米尺度颗粒可以显著缩短锂离子的扩散路径。
(2)在反复充放电过程中,铁酸锌纳米材料会因为较高的比表面积和高表面能发生团聚,导致电极的活性降低。材料本身的转换反应带来的体积膨胀所导致的粉化以及脱落会影响电极的循环稳定性能,成为限制其发展的真正原因。
(3)利用材料结构设计、复合化等手段来提高材料的稳定性,以阻止由于反复充放电所带来的体积效应。
