新型磁性螯合纳米材料对水中Cd2+的吸附性能
2021-08-11郭晓婧张志毅郭掌珍
郭晓婧 张志毅 郭掌珍
(山西农业大学资源与环境学院,山西 太谷 030801)
随着城市工业化的发展,大量的废水排放使得重金属污染已经发展成为普遍存在的全球性问题。镉(Cd)是一种具有较强毒性的重金属,易通过食物链富集,并可在环境中经代谢转化或与其他污染物通过联合作用表现出复杂的毒性作用[1-2]。因此,水体Cd污染控制引起了科学家的广泛关注。目前,废水中重金属的去除方法主要有化学沉淀法、混凝法、离子交换法、膜过滤法、生物法和吸附法等[3-4],其中,吸附法因处理工艺简单、吸附效能高、能耗少、成本低等优点,得到了广泛应用[5],开发高效吸附剂成为近年研究的热点。常见的吸附剂包括生物炭[6]、粘土矿物[7]、离子交换树脂[8]等。而理想的吸附剂应具备环境友好、吸附性能高、选择性好的特点,并且易于从环境介质中移除,同时具有一定的再生性能[3]。
Fe3O4等磁性纳米粒子比表面积大、易于分离,可通过表面修饰或包裹等方法改善性能,接枝多种官能团,用于吸附水体中的生物分子[9]、有机污染物[10]和重金属离子[11]等,成为当前环境修复材料的热点。当前,主要采用表面活性剂、聚合物、天然矿物、生物炭等材料,以及多材料复合等方式对磁性材料进行修饰[12-14],其中,SiO2因易于功能化,且具有良好的热稳定性和化学稳定性常被用于包覆纳米Fe3O4,改善Fe3O4易团聚、易氧化等缺点[15]。同时为提升SiO2包覆的核壳结构磁性纳米Fe3O4材料吸附的性能、效率和选择性,通常会进一步进行表面修饰或功能化,如氨基功能化、羧基功能化和硫醇功能化等[16-17]。二乙基二硫代氨基甲酸钠(diethyldithiocarbamate,DDTC)是一种含硫原子的重金属捕集剂,可与金属元素形成稳定的螯合物,常被用于水中重金属的感应或检测[18-19]。近年来,DDTC也被用于吸附材料的修饰和改性,以增强吸附材料对重金属的选择吸附性能[19-20]。有研究表明,DDTC和聚苯胺修饰可有效提高纳米Fe3O4对水介质中Hg、As和Pb的吸附去除能力[19];海泡石-DDTC复合体被证明是一种潜在的土壤重金属镉修复材料[21]。但有关Fe3O4@SiO2经DDTC改性后形成的磁性螯合纳米材料对Cd吸附性能的报道尚鲜见。
本研究采用螯合剂DDTC对Fe3O4@SiO2进行表面修饰,制备一种新型磁性螯合纳米吸附剂(Fe3O4@SiO2-DDTC),采用扫描电镜(scanning electron microscope,SEM)、X射线衍射(X-ray diffraction,XRD)、振动磁强计(vibrating sample magnetometer,VSM)及傅里叶红外(fourier transform infrared spectrometry,FT-IR)等对材料进行表征,结合X射线光电子能谱分析(X-ray photoelectron spectroscopy,XPS)吸附机理,并进行批次试验研究不同吸附条件对吸附过程的影响,以期为磁性材料应用于Cd污染废水处理提供参考,为水中Cd2+的去除提供一种高效、经济的解决途径。
1 材料与方法
1.1 试验材料
FeCl2·4H2O、FeCl3·6H2O、氨水、正硅酸乙酯(tetraethyl orthosilicate,TEOS)、聚乙二醇 4000(macrogol 4000,PEG 4000)、NaOH、HNO3、NaCl、KCl、MgCl2、CaCl2和无水乙醇均为分析纯,购自天津市科密欧化学试剂有限公司;DDTC,优级纯,购自上海展云化工有限公司。
1.2 试验设计
1.2.1 Fe3O4@SiO2-DDTC的制备 参考文献[22],采用碱性共沉淀法制备得到Fe3O4。取20 g PEG 4000溶于100 mL去离子水中,11.68 g FeCl3·6H2O和4.3 g FeCl2·4H2O分别溶于50 mL去离子水中,并与50 mL PEG 4000溶液混合,移入反应瓶中,在90℃氮气保护条件下,逐滴加入氨水与剩余PEG 4000溶液至pH值为碱性,剧烈机械搅拌(200 r·min-1)2 h得到黑色悬浊液,在外加磁场作用下将黑色Fe3O4颗粒从溶液中分离,并先后用超纯水和无水乙醇清洗数次,最后放入真空干燥箱中60℃烘干,研磨保存备用。
称取0.5 g Fe3O4超声分散于175 mL醇/水(V/V=6∶1)溶液中,滴加3 mL氨水,控制反应温度为30℃,转速为200 r·min-1,搅拌30 min后,缓慢滴加2.5 mL TEOS,得到由硅层包覆的Fe3O4(Fe3O4@SiO2)。最后,逐滴加入50 mL 0.09 mol·L-1DDTC(1.0 g)溶液进行改性,反应6 h,将得到的黑褐色颗粒用去离子水和无水乙醇分别清洗6次以上,60℃真空烘干备用。
1.2.2 吸附试验 将Cd(NO3)2溶于去离子水中,配制得到浓度为1 g·L-1的Cd2+贮备液,用HNO3和NaOH调节溶液pH值为7.0,配置40 mL 20 mg·L-1的Cd2+使用液于50 mL离心管中,加入20 mg Fe3O4@SiO2-DDTC或Fe3O4@SiO2后在气浴恒温振荡箱内以180 r·min-1的速度持续振荡12 h,强磁分离,并取上清液测定溶液中Cd2+的剩余浓度。
批次试验中用控制变量法考察不同反应条件对吸附的影响。溶液pH值设定为3、4、5、6、7、8;选用Na+、Mg2+两种离子,离子强度分别设置为0(CK)、0.005、0.01、0.05、0.1 mol·L-1,考察共存离子强度对吸附性能的影响;在不同时间点取样(5、10、25、40、60、120、240、480、720、1 440 min)进行吸附动力学试验探究;在不同温度条件下(25、35、45℃),探究不同Cd2+溶液初始浓度(5、10、20、30、50、100 mg·L-1)对吸附性能的影响。
1.2.3 Fe3O4@SiO2-DDTC再生试验 按1.2.2所述方法进行吸附试验,用含4%硫脲的0.5 mol·L-1HNO3溶液作为洗脱剂,对磁回收得到吸附材料进行解吸,并用去离子水洗涤数次,烘干后再次吸附,重复4次吸附-脱附试验考察其重用性能。
1.3 测定项目与方法
1.3.1 材料表征 SEM分析:采用SU8220型场发射扫描电子显微镜(日本,日立)扫描Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-DDTC三种材料,样品喷金处理,观察结构特征和粒径大小;FT-IR分析:采用溴化钾粉末压片法,用Tensor 27型傅里叶红外仪(德国,布鲁克)对材料表面官能团进行表征,分辨率4 cm-1,扫描范围500~4 000 cm-1;XRD分析:采用D8 Advance型X射线衍射仪(德国,布鲁克)分析材料晶体结构,以2°·min-1扫描,角度范围10~90°;VSM分析:用Ppms Dynacool型振动样品磁强计系统(美国,Quantum Deign)记录材料的磁滞回线;XPS分析:采用EscaLab 250Xi型X射线光电子能谱仪(美国,Thermo Fisher)对样品元素进行测定分析[22]。
1.3.2 重金属含量测定 用5300DV电感耦合等离子体发射光谱仪(美国,PerkinElmer)测定溶液中Cd2+的浓度[12]。试验设置3个平行,取算术平均值根据公式计算吸附试验中Cd2+的去除率(R,%)和吸附量(qe,mg·g-1):
(1)
(2)
式中,C0为溶液中Cd2+的初始质量浓度,mg·L-1;Ce为吸附达到平衡时溶液中Cd2+的浓度,mg·L-1;V为溶液体积,mL;m为吸附剂的重量,mg。
1.4 数据分析
1.4.1 吸附动力学模型 为了研究Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附材料对Cd2+的吸附过程的吸附机制,用准一级动力学(3)和准二级动力学模型(4)进行拟合:
qt=qe(1-e-tK1)
(3)
(4)
式中,qe为吸附平衡时的吸附容量,mg·g-1;qt为吸附时间为t时的吸附容量,mg·g-1;t为吸附时间,min;K1为一级吸附速率常数,min-1;K2为二级吸附速率常数,g·mg-1·min-1。
1.4.2 吸附等温线模型 采用Langmuir(5)和Freundlich(6)等温吸附模型对试验数据进行拟合:
(5)
(6)
式中,Ce为吸附达到平衡时溶液中Cd2+的浓度,mg·L-1;qe为吸附平衡时吸附剂对溶液中Cd2+的吸附量,mg·g-1;qm为吸附剂单层最大吸附量,为mg·g-1;KL和KF分别为Langmuir和Freundlich的吸附常数,单位分别为L·mg-1和(mg·g-1)(L·mg-1)1/n;n为非均质系数,随材料的不均匀性发生变化。
以上试验数据均用Origin软件拟合并作图。
2 结果与分析
2.1 材料的表征
2.1.1 XRD分析 由图1可知,吸附剂具有较高的结晶性,Fe3O4在30.1°、35.4°、43.1°、53.4°、56.9°、62.5°处出现特征衍射峰,证实了Fe3O4的方尖晶石结构,且这些特征衍射峰在Fe3O4@SiO2、Fe3O4@SiO2-DDTC样品中均可观察到。

图1 不同纳米材料的XRD
2.1.2 SEM分析 由图2可知,3种材料均呈球状颗粒,且因具有超顺磁性,有明显的团聚现象,这与类似研究结果一致[23-24]。为定量分析3种材料的粒径大小,运用Imagej软件统计60颗以上颗粒,绘制粒径分布直方图,得到Fe3O4@SiO2-DDTC的粒径为115~125 nm,标准差为13 nm,约75%的颗粒在该粒径范围内。Fe3O4和Fe3O4@SiO2的粒径依次为19~23 nm和37~47 nm。由Fe3O4@SiO2的EDS光谱图(图2-d)可知,Fe3O4@SiO2含有C、O、Fe、Si等元素,证实材料中硅层的存在。由图2-e可知,Fe3O4@SiO2-DDTC中形成了新的S元素峰,可能与DDTC改性作用有关[20]。

图2 不同纳米材料的SEM和EDS
2.1.3 FT-IR分析 纳米材料Fe3O4、Fe3O4@SiO2及Fe3O4@SiO2-DDTC在吸附前FT-IR分析结果如图3所示。527和1 635 cm-1附近的振动带归属于Fe-O键的拉伸振动[22, 25],与Fe3O4相比,Fe3O4@SiO2的Fe-O吸收峰强度减弱,可能是由于官能团负载到Fe3O4表面。3 430 cm-1附近的宽峰为-OH的弯曲振动峰[26],与样品表面吸附水有关。Fe3O4@SiO2光谱图显示在1 098 cm-1附近出现Si-O-Si的反对称伸缩振动峰,470 cm-1附近出现Si-O-Si的弯曲振动峰[27],进一步表明Fe3O4表面成功包覆SiO2。Fe3O4@SiO2-DDTC光谱图中出现DDTC的特有官能团,1 010 cm-1附近的增强峰归属于C=S振动峰,931 cm-1附近对应C-S的拉伸振动吸收峰,1 512 cm-1附近的弱振动峰对应C=N振动峰[20, 28-29],表明DDTC成功连接到Fe3O4@SiO2表面;而吸附了Cd2+的Fe3O4@SiO2-DDTC光谱图显示931和1 010 cm-1处的特征吸收峰强度降低,表明Cd2+离子可能和材料中的-CSS形成了多硫螯合物[29]。

注:a:Fe3O4;b:Fe3O4@SiO2;c:Fe3O4@SiO2-DDTC;d:吸附Cd后的Fe3O4@SiO2-DDTC。
2.1.4 磁滞回线分析 由图4可知,Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2-DDTC的饱和磁化强度分别为61.06、42.45和25.74 emu·g-1[30],且3种材料在室温下无磁滞效应和矫顽力,表明材料具有超顺磁性,易于在外加磁场作用下从溶液中分离出来[31]。
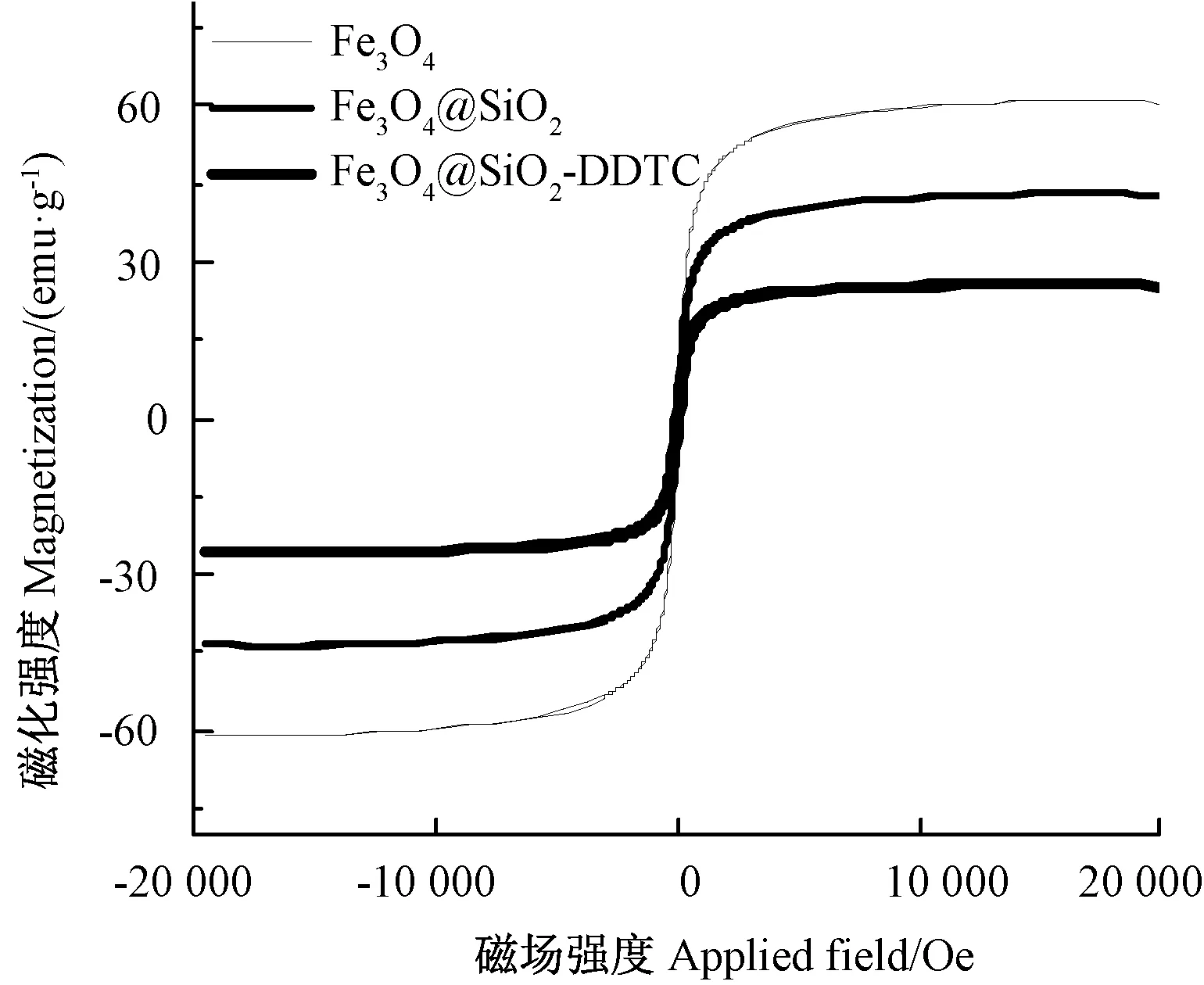
图4 不同纳米材料的磁滞回线
2.2 初始溶液pH值对吸附的影响
由图5可知,pH值从3增加到4,Fe3O4@SiO2-DDTC对Cd2+的吸附量从3.41 mg·g-1迅速增加到24.01 mg·g-1。pH值在4~7范围内,吸附量呈缓慢增加趋缓,且在pH值接近7时达到最大吸附量(31.76 mg·g-1)。此后,随着pH值的增加,吸附量开始下降。吸附去除率在pH值3时最小(3.41%),pH值7时最大(80.63%)。Fe3O4@SiO2对Cd2+的吸附也存在类似趋势。在低pH值(3~4)范围内,吸附剂的吸附能力较弱可能是因为pH值较低时,溶液中过多的H+导致功能基团的质子化,进而通过静电排斥作用,阻止了Cd2+与吸附剂的接触配合;随着pH值升高,H+浓度相应降低,官能团质子化降低,进而导致官能团中可用结合位点增加,因此吸附量增加;但当pH值进一步增加并达到8时,溶液中的Cd2+逐渐水解沉淀为Cd(OH)2、Cd(OH)3-、Cd(OH)4-,影响了Cd2+的吸附去除[23, 32]。

图5 pH值对Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附效果的影响
2.3 共存离子强度对吸附的影响
不同种类、不同浓度干扰离子(Na+、Mg2+)对吸附的影响见图6。结果表明,不同离子存在条件下,Fe3O4@SiO2和Fe3O4@SiO2-DDTC的平衡吸附量均略低于无干扰离子的空白组(CK),且Mg2+的抑制作用比Na+略明显,这可能是因为Mg2+与Cd2+离子结构相似,有一定竞争吸附作用[33]。总体来说,这2种阳离子与Cd2+的竞争吸附能力较小,即在Na+和Mg2+等干扰离子存在的条件下,材料优先吸附Cd2+。
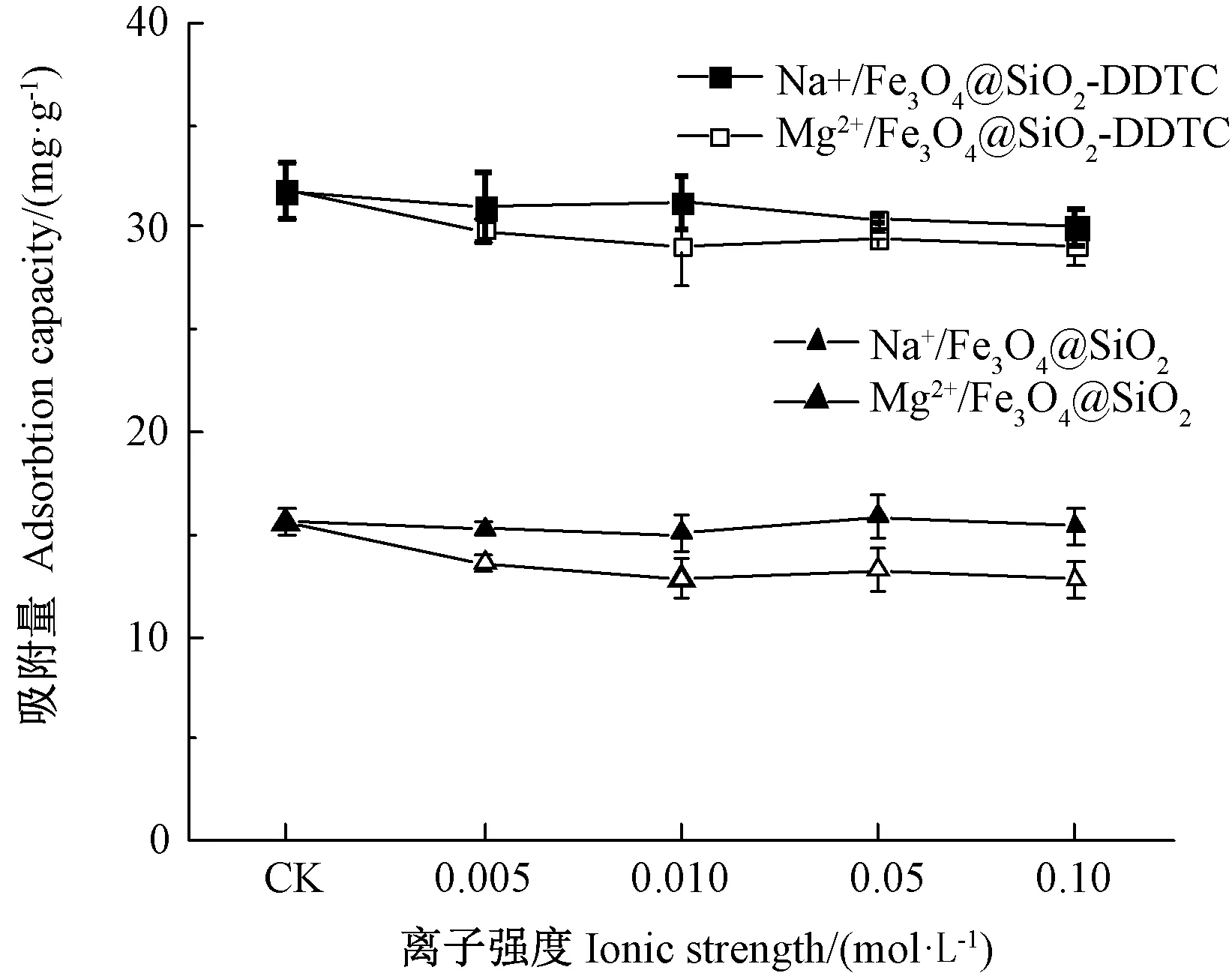
图6 干扰离子种类及强度对Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附Cd2+的影响
2.4 吸附动力学特征
由图7可知,Fe3O4@SiO2和Fe3O4@SiO2-DDTC 2种材料对Cd2+的吸附量先随反应时间增加而增加,后趋于平衡。在反应开始5 min内吸附量分别达到吸附平衡量的72%、82%以上,并分别在反应1和2 h后基本达到吸附平衡。这是因为在反应初期材料表面有大量的空置吸附点位,溶液中的Cd2+快速与活性点位结合;随着吸附反应的进行,材料表面的活性点位被填满,加之材料在水中的集聚现象也会增加Cd2+与活性点位结合的难度[31],因此吸附速率逐渐降低后达到平衡。Fe3O4@SiO2-DDTC的最大吸附量是31.79 mg·g-1,约为Fe3O4@SiO2的2倍,说明DDTC的改性作用明显。

图7 吸附时间对Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附性能的影响
2种动力学模型的拟合结果如表1所示,准二级动力学模型的R2(>0.99)高于准一级动力学模型R2,且准二级动力学模型得到的理论最大吸附量(31.81 mg·g-1) 更接近试验结果(31.79 mg·g-1),因此,Fe3O4@SiO2-DDTC对水中Cd2+的吸附更符合准二级动力学模型,说明化学吸附为其主要吸附机理,吸附过程受准二级动力学过程控制[34-35]。另外,材料表面具有多个官能团,可以作为螯合反应的配体与Cd2+结合,表明该材料的吸附过程是以络合为主的化学吸附。

表1 准一级和准二级吸附动力学拟合参数
2.5 等温吸附曲线
纳米材料对Cd2+的吸附等温线见图8,吸附参数见表2。由图8可知,随着吸附平衡时Cd2+浓度的增加,吸附量先快速增加后趋于平衡。由表2可知,Langmuir和Freundlich拟合模型均与Fe3O4@SiO2和Fe3O4@SiO2-DDTC吸附Cd2+试验数据具有良好的相关性,其中Fe3O4@SiO2-DDTC模型拟合R2均大于0.9,但Langmuir模型的R2相较于Freundlich更高,说明前者更适合用来描述Fe3O4@SiO2-DDTC对Cd2+的吸附行为。结果提示吸附剂对Cd2+的吸附主要以均质吸附剂表面的单分子层吸附为主,与近期类似材料的研究结果一致[12, 36]。根据Langmuir模型拟合得到不同温度下(25、35、45℃)Fe3O4@SiO2-DDTC的最高吸附量分别为37.20、41.13、45.52 mg·g-1。Freundlich等温吸附模型吸附强度变量(1/n)<1,说明吸附反应容易进行。

图8 Fe3O4@SiO2-DDTC吸附Cd2+的等温模型拟合

表2 Langmuir和Freundlich等温吸附模型拟合参数
2.6 再生试验
本研究选用硫脲-硝酸溶液作为洗脱液,4次吸附-脱附试验结果如图9所示。随着循环次数的增加,Fe3O4@SiO2-DDTC对Cd2+的吸附能力有所下降,重复使用4次后吸附量仍可达到25.84 mg·g-1,与初次吸附相比下降了20%。表明硫脲对Cd2+有较强的螯合能力,对研究材料具有良好的洗脱效果。此外,吸附能力的下降可能与解吸过程中材料的损失或材料吸附的Cd2+未能被完全洗脱有关。

图9 Fe3O4@SiO2-DDTC的重复使用性能
2.7 XPS分析
为深入分析Fe3O4@SiO2-DDTC对Cd2+的吸附机理,对吸附前后的样品进行XPS分析,如图 10所示。除检测到Fe3O4@SiO2-DDTC中C、O、S、Si等的特征峰外,Cd/Fe3O4@SiO2-DDTC的全谱图中还出现信号较强的Cd3d轨道特征峰,说明Fe3O4@SiO2-DDTC材料表面含有Cd2+,即Fe3O4@SiO2-DDTC成功吸附了Cd2+;同时吸附后材料的Na1s峰消失,证明DDTC中的Na+与Cd2+发生了离子交换。为进一步探索吸附材料可能的活性点位,对S2p峰进行分峰拟合,如图10-b所示,材料吸附Cd2+后,C=S和C-S中S2p1/2和S2p3/2的结合能均增加0.1 eV,证明-CSS中的2个S原子都参与了配位,形成了多硫螯合物[37]。
3 讨论
本试验XRD分析表明,Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2-DDTC 3种材料均存在Fe3O4的特征衍射峰,表明TEOS和DDTC的修饰保留了Fe3O4的立方尖晶石结构,这与Ren等[38]和Liu等[22]的研究结果类似。SEM图显示3种材料粒径大小排序为Fe3O4 本研究中,Fe3O4@SiO2-DDTC在反应5 min内即可实现对溶液中Cd2+的快速吸附,为应急快速处理水体Cd污染提供了可能。且Fe3O4@SiO2-DDTC对Cd2+的理论最大吸附量为45.52 mg·g-1,高于表3中所列的部分材料,吸附性能较好,具有较大的研究潜力。吸附特征研究表明,Fe3O4@SiO2-DDTC对Cd2+的吸附符合准二级动力学模型和Langmuir等温吸附方程,以单分子层化学吸附为主,并伴随有静电相互作用。为提高材料利用率,进一步探究其再生性能。硫脲是一种有机含硫化合物,所具有的硫代羰基(C=S)与重金属有较强的螯合作用[28, 41],因此本研究选用硫脲-硝酸溶液作为洗脱液,解吸试验表明硫脲酸溶液对Fe3O4@SiO2-DDTC吸附的Cd2+洗脱效果良好,说明该材料能够实现再生利用。Fe3O4@SiO2-DDTC对水中Cd2+具有良好的吸附性能,今后可进一步试验用于实际污水或土壤重金属处理的研究中。 表3 各种吸附剂对Cd2+吸附能力的比较 本研究制备了一种新型磁性螯合纳米材料(Fe3O4@SiO2-DDTC),呈均匀球状颗粒,粒径约为115~125 nm。磁滞回线分析表明该材料具有良好的磁响应性,可通过外加磁场实现固液快速分离。Fe3O4@SiO2-DDTC对Cd2+的吸附过程符合准二级动力学模型和Langmuir等温吸附方程;吸附机制包括络合螯合反应、离子交换和静电相互作用。Fe3O4@SiO2-DDTC再生效果良好,经硫脲-硝酸溶液解吸4次后仍有较高吸附能力,可以实现重复利用。
4 结论
