响应面法优化酶提取柿子多糖工艺研究
2021-08-11句荣辉朱建晨
王 辉,句荣辉,王 丽,朱建晨
(北京农业职业学院,北京 102442)
0 引言
柿果色泽鲜艳、味甜多汁,含有丰富的糖、维C、胡萝卜素及多种矿物质和生物活性成分,具有较高的营养和药用价值[1]。近年来,关于活性多糖的研究已经成为继基因组学、酶学之后的又一个研究热点[2]。酶法提取是近年来发展较快的新型提取方法,具有高效性、提取时间短、能耗低等特点,已经广泛应用于天然化合物及生物活性成分等提取中[3-4],多糖具有免疫调节、抗肿瘤、降低血糖血脂、抗辐射、抗菌抗病毒、保护肝脏等保健作用[4]。开发提取柿子中多糖资源,具有极其重要的现实意义。
多糖是一类大分子化合物,主要由单糖或其衍生物通过聚合形成,是具有生命的生物体机体活动所必需的有机物质,并起着维持生物体各项机能运转的作用[5]。目前在世界范围内发现有300 多种天然多糖,其更多的药理活性逐渐被发现,科学试验研究表明,多糖具有抗氧化、抗病毒、调节免疫、抗疲劳等功能,同时也是新型健康食品的优良功能营养基料[6-7]。20 世纪初期,科研人员就开始研究各种生物多糖的化学机构、理化性质、功能作用,再到活性分析,成为了近期的研究热点[8-10]。
酶的专一高效特点使其成为目前研究热点,酶法提取多糖,也在众多材料中应用广泛。常见的酶有纤维素酶、木瓜蛋白酶、淀粉酶、果胶酶、复合酶等,酶处理法条件较柔和、健康环保、效率较高,但是酶制剂生产技术高,使用成本较高[11]。酶提取过程中有温度、pH 值、时间、酶的种类及添加量等条件因素对提取率有较大影响。酶法提取柿子多糖节能、省时,与水提法相比提高了多糖得率[12-14]。
1 材料和方法
1.1 材料与仪器
1.1.1 材料
选自房山区张坊镇磨盘柿,采后脱水干燥至恒质量后粉碎,过0.25 mm 筛筛选,置于干燥器中密封保存备用。干制方法会不同程度地引起多糖结构和及生物活性的改变,但是对多糖提取率和抗氧化活性影响都较小[15-16]。
1.1.2 试剂
木瓜蛋白酶、纤维素酶、酸性蛋白酶、果胶酶、菠萝蛋白酶、浓硫酸、无水葡萄糖、苯酚,均为分析纯化学试剂。
1.1.3 仪器
FA1104N 型万分之一天平,上海菁海仪器有限公司产品;HC-3018 型高速离心机,安徽中科中佳科学仪器有限公司产品;QL-866 型旋涡振荡仪,海门市其林贝尔仪器制造有限公司产品;T6 型紫外可见分光光度计,新世纪北京普析通用仪器有限责任公司产品;DHG-9053A 型电热鼓风干燥箱,上海一恒科技有限公司产品;HH-4 型数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司产品;YB-250 型高速多功能粉碎机,永康市速锋工贸有限公司产品。
1.2 试验方法
1.2.1 前处理
称取2 g 柿子粉→料液比→加酶→混匀1 min→酶解→96 ℃下灭酶15 min→以转速4 000 r/min 离心10 min→取上清液。
1.2.2 葡萄糖标准曲线的制作
分别吸取0,0.2,0.4,0.6,0.8,1.0 mL 的葡萄糖工作液于具塞试管中,补水至1.0 mL,加入1.0 mL苯酚溶液,然后快速加入5.0 mL 硫酸,静置10 min,用漩涡振荡器混匀,置于30 ℃水浴中反应10 min,于波长490 nm 处测定吸光度。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,制作葡萄糖标准曲线。得到回归方程为:Y=0.008 3X-0.026 3。
1.2.3 硫酸苯酚法测定多糖含量
吸取稀释后的溶液1.0 mL,加入1.0 mL苯酚溶液,然后快速加入5.0 mL硫酸,静置10 min,用漩涡振荡器混匀,置于30 ℃水浴中反应10 min,于波长490 nm 处测定吸光度。
1.2.4 试验设计
单因素试验设计:以采用单因素试验研究酶、酶添加量、料液比、酶解温度及酶解时间对柿子多糖提取效果的影响。
响应面试验设计在单因素试验的基础上,采用响应曲面法对柿子多糖的提取工艺进行优化,通过拟合二次多项式方程,计算出最优工艺组合和在此条件下柿子多糖得率的最大理论值。
根据Box-behnken 试验设计原理,依据单因素试验结果,酶添加量(X1)、料液比(X2)、酶解温度(X3)、酶解时间(X4)为自变量,以+1、0、-1 分别代表自变量的高、中、低水平,以柿子多糖得率为指标,进行响应曲面分析。
响应面因素与水平设计见表1。

表1 响应面因素与水平设计
1.2.5 计算公式
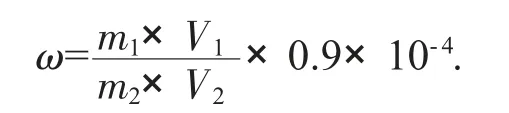
式中:m1——从标准曲线上查得样品测定液中含糖量,μg;
V1——样品定容体积,mL;
V2——比色测定时所移取样品测定液体积,mL;
m2——样品质量,g;
0.9——葡萄糖换算成葡聚糖的校正系数。
2 结果与分析
2.1 单因素结果
2.1.1 不同单酶对多糖得率的影响
称取2 g 柿子粉→料液比1∶20→调pH 值→加入不同的酶15%(分别加纤维素酶、胰蛋白酶、果胶酶、木瓜蛋白酶、菠萝蛋白酶、木聚糖酶、酸性蛋白酶、中性蛋白酶、碱性蛋白酶)→45 ℃下水浴酶解2 h→95 ℃下灭酶10 min→离心去渣→取上清液测定多糖得率。
不同单酶对柿子多糖得率的影响见图1。

图1 不同单酶对柿子多糖得率的影响
在固定条件下,由图1 可知,木瓜蛋白酶提取柿子多糖得率最高。由此可见,最佳的酶种类为木瓜蛋白酶。
2.1.2 酶添加量对柿子多糖得率的影响
称取2 g 柿子粉→料液比1∶20→调pH 值为7→不同酶添加量(0,10%,15%,20%,25%)加入酶→45 ℃下水浴酶解2 h→95 ℃下灭酶10 min→离心去渣→取上清液测定多糖得率。
不同酶添加量对柿子多糖得率的影响见图2。

图2 不同酶添加量对柿子多糖得率的影响
在固定条件下,由图2 可知,随着酶添加量的不断增加,柿子多糖得率不断增加,酶添加量为30%时,多糖得率最高。加酶后的得率比不加酶的得率高。
2.1.3 料液比对柿子多糖得率的影响
称取2 g 柿子粉→调pH 值为7→分别配制不同料液比(1∶10,1∶15,1∶20,1∶25,1∶30)→加入15%酶→45 ℃下水浴酶解2 h→95 ℃下灭酶10 min→离心去渣→取上清液测定多糖得率。
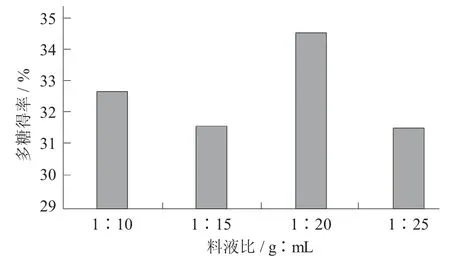
图3 料液比对柿子多糖得率的影响
在固定条件下,由图3 可知,在料液比为1∶20 时,多糖得率达到最高值,当料液比超过1∶20时,多糖得率增幅不明显。可见继续增加料液比对进一步提高多糖得率的意义不大,所以最佳料液比选择1∶20。
2.1.4 酶解温度对柿子多糖得率的影响
称取2 g 柿子粉→料液比1∶20→调pH 值为7→加入酶15%→在(40,45,50,55,60 ℃)下水浴酶解4 h→95 ℃下灭酶10 min→离心去渣→取上清液测定多糖得率。
酶解温度对柿子多糖得率的影响见图4。
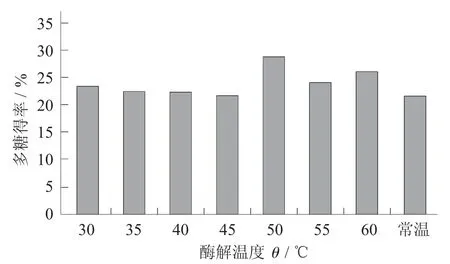
图4 酶解温度对柿子多糖得率的影响
在固定条件下,由图4 可知,在提取过程中,在一定时间内提取的时间越长,多糖溶解于热水中就越充分,原因可能为在高温环境中,随时间延长多糖稳定性逐渐降低,导致一部分多糖降解,同时热作用加大了柿子细胞壁的破坏,使细胞内的多糖容易浸出,但在温度为50 ℃时,多糖得率达到最高值。因此,酶解温度为50 ℃左右。
2.1.5 酶解时间对柿子多糖得率的影响
称取2 g 柿子粉→料液比1∶20→调pH 值为7→加入15%酶→在45 ℃下水浴酶解(0.5,1.0,1.5,2.0,2.5,3.0 h)→95 ℃下灭酶10 min→离心去渣→取上清液测定多糖得率。
酶解时间对柿子多糖得率的影响见图5。
2.3 两组患者手术中、手术后并发症比较 观察组和对照组手术均顺利完成,手术中及手术后无并发症发生,均无中转开腹,两组手术中、手术后并发症差异无统计学意义(P>0.05)。
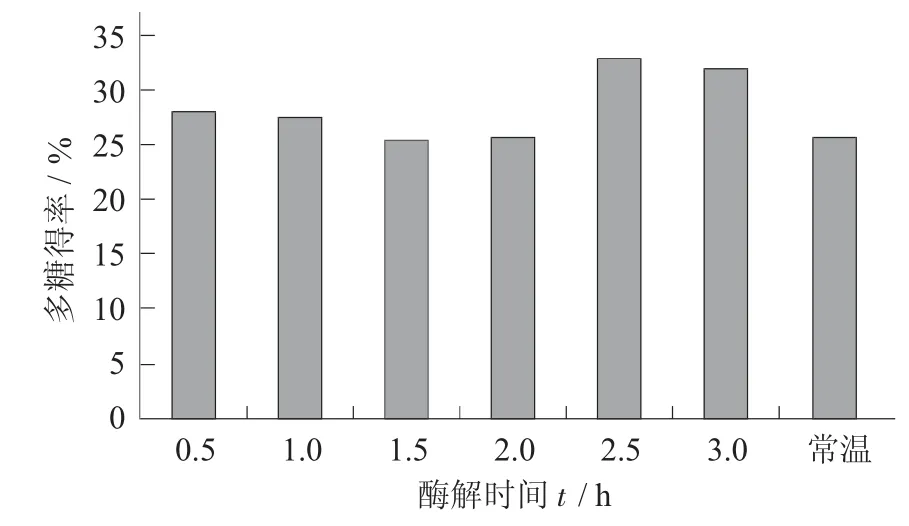
图5 酶解时间对柿子多糖得率的影响
在固定条件下,由图5 可知,在酶解时间2.5 h时,多糖得率到达最高值,之后多糖得率开始下降。可能是柿子多糖提取液在酸性条件下时间的延长产生降解,适当延长提取时间,有利于细胞内有效成分的释放,因此以2.5 h 左右为参考值。
2.2 响应面优化试验
响应面试验设计与结果见表2,多糖得率回归方程模型方差分析见表3。
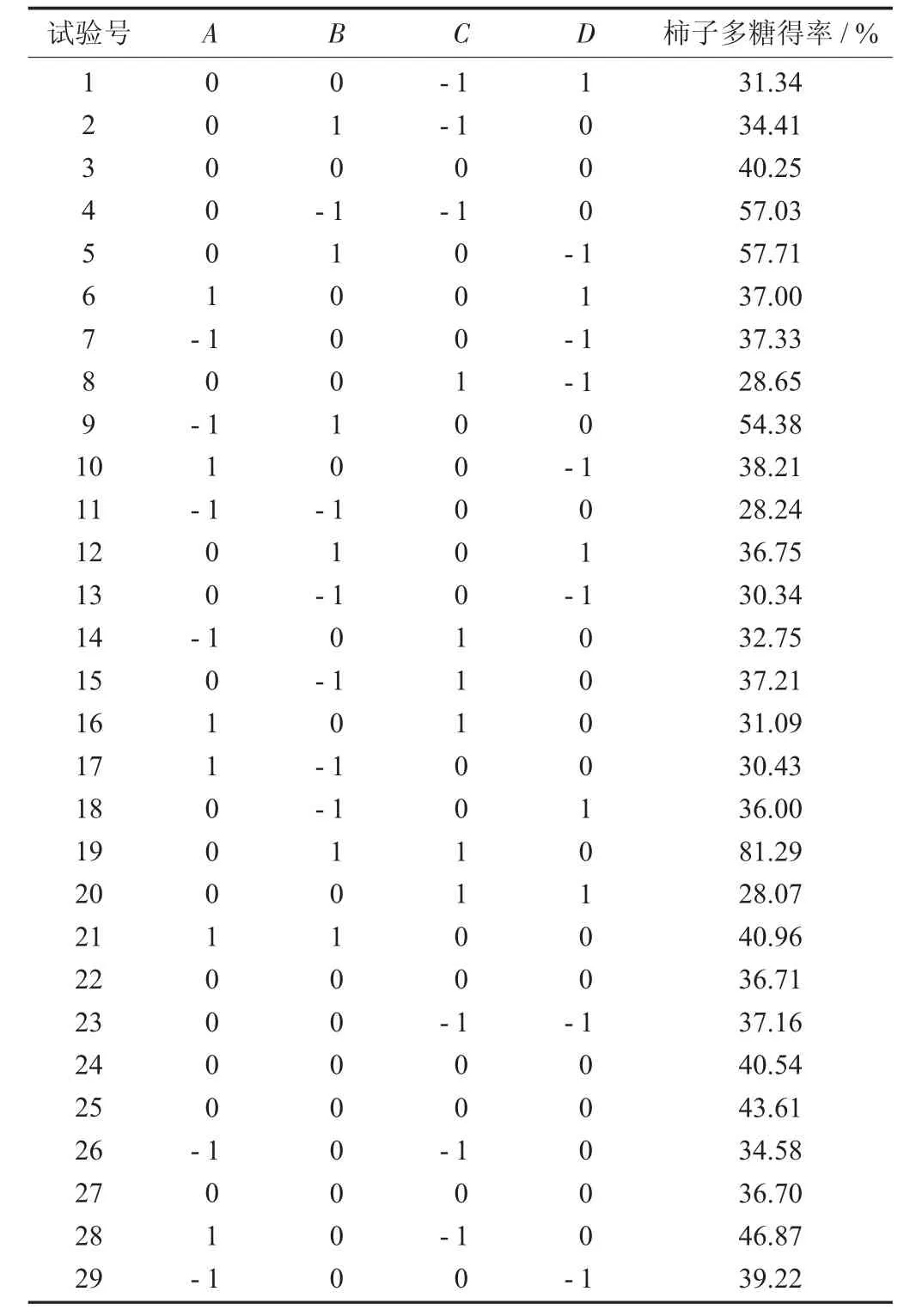
表2 响应面试验设计与结果
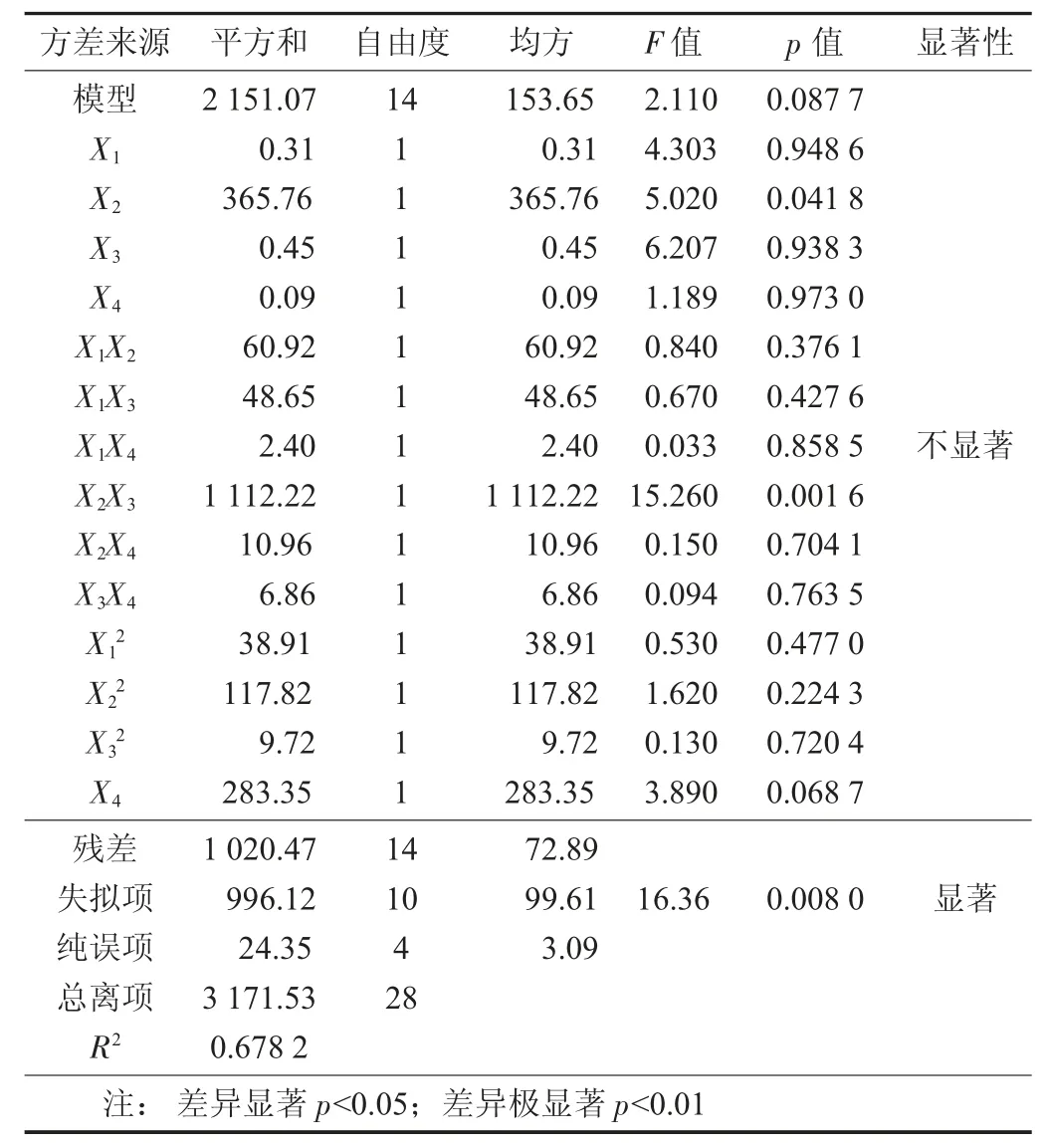
表3 多糖得率回归方程模型方差分析
2.3 响应面试验结果及方差分析
响应面分析法可以帮助建立一个或多个测定指标与关键影响因素之间的关系模型,并可以进行定量分析。从方差分析表3 可知,由试验数据所得模型的F 值为2.11,p 值为0.087 7,表示该模型不显著。利用软件对表2 中试验数据进行二次线性回归拟合,建立多糖得率回归模型,获得评价指标响应值对自变量X1X2X3X4二次多项式回归方程:
多糖得率=40.41-0.16X1+5.52X2-0.19X3-0.085X4-3.90X1X2-3.49X1X3-0.78X1X4+16.68X2X3-1.66X2X4+1.31X3X4-2.45X12+4.26X22+1.22X32-6.61X42.
由此可知,各影响因素与响应值的关系并不是简单的线性关系。方程的失拟度F 值为13.36,表示相对于绝对误差而言,失拟度显著,说明该回归方程未能较好地描述各因素与响应值之间的真实关系。模型的校正系数R2=0.678 2,说明该模型能解释67.82%响应值的变化。在所选取各因素水平范围内,由F 值的大小可以知道,影响因素主次顺序为酶解温度(X3)>料液比(X2)>酶解时间(X4)>酶添加量(X1)。交互作用主次顺序为X2X3>X1X2>X1X3>X2X4>X3X4>X1X4。
2.4 试验因素交互作用对响应值影响的分析
酶添加量与料液比交互作用见图6,酶添加量与酶解温度交互作用见图7,酶添加量与酶解时间交互作用见图8。

图7 酶添加量与酶解温度交互作用
响应面图可以较为直观地看出任意2 个交互项对柿子多糖得率的影响规律。各图显示酶添加量、料液比、酶解温度和酶解时间中任意2 个变量编码为零水平时,其余2 个变量对多糖得率的影响。
由图6~图11 曲面图可知其坡度较缓,说明两者大交互作用不太显著,图6~图8 可知酶添加量与料液比、酶解温度、酶解时间之间的交互作用,料液比在刚开始增加时,多糖得率也随之增大,随着酶解温度的提高多糖得率也在增大。酶解时间和酶添加量之间有个最高值,可能是过长的酶解时间会使溶出的多糖结构遭到破坏,而加酶的多少并没有很好地提高多糖得率,从而使多糖得率下降。
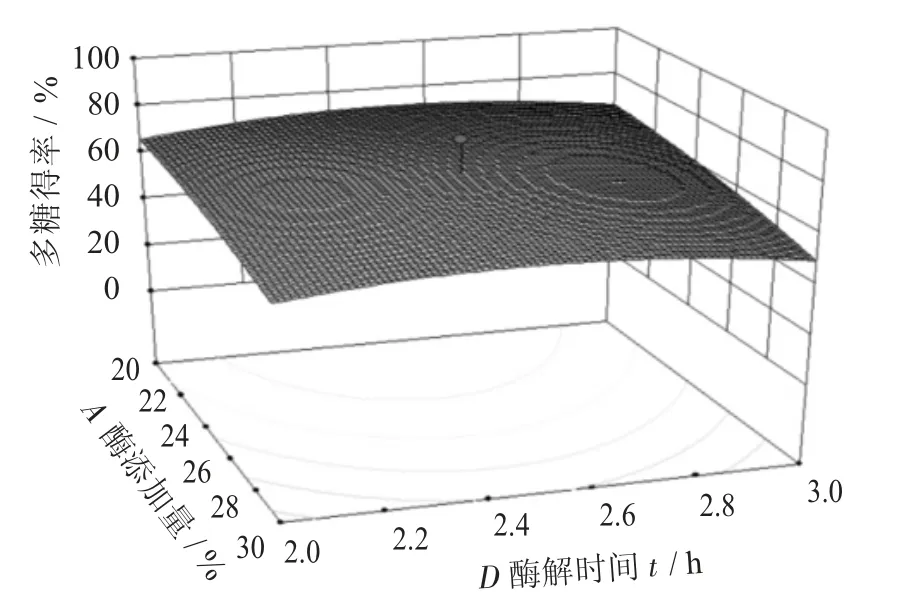
图8 酶添加量与酶解时间交互作用
料液比与酶解温度交互作用见图9,料液比与酶解时间交互作用见图10,酶解温度与酶解时间交互作用见图11。

图9 料液比与酶解温度交互作用
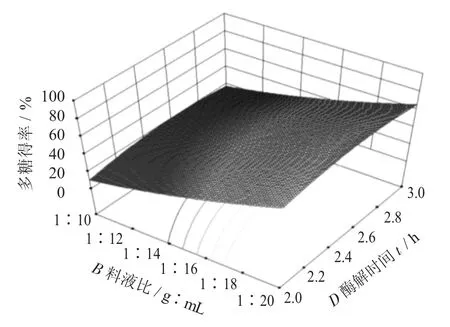
图10 料液比与酶解时间交互作用
由图9~图11 可知,料液比与酶解温度、酶解时间之间的交互作用,在试验中未能得出其最高值,通过料液比的不同,酶作用时间延长,酶的活力会相对下降,温度的升高为酶促反应提供了能量,可以增加多糖得率。由图11 可知,酶解温度与酶解时间之间的交互作用,随着温度和时间的递增,多糖得率也随之增加。
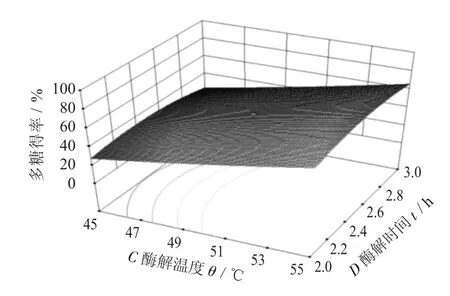
图11 酶解温度与酶解时间交互作用
3 结论
研究了柿子多糖的提取工艺,采用传统的水提法获得的磨盘柿多糖得率仅为57.21%,在此工艺条件下,柿子多糖得率为81.29%。酶法借助了酶的作用加快细胞壁组分水解并破坏其结构,促进多糖等活性成分的释放,提高得率。得出柿子多糖的最佳提取工艺条件为酶添加量25%,料液比1∶20,酶解温度55 ℃,酶解时间2.5 h,此条件下得到的实际多糖提取率为81.29%,较水提法提高了42.09%。通过和其他试验结果对比其结果具有一定的可靠性,该法提取柿子多糖含量高、快速、稳定,合理可行,优化的工艺条件可用于柿子多糖的提取。
北京市房山区拥有有极为丰富的柿子资源,对于其中多糖的研究开发利用有着得天独厚的资源优势。目前,我国对天然产物多糖提取及相关生物活性已有了一定程度的研究。但总体来说,对于柿子多糖的提取方法研究还不是很多;柿子多糖的化学组成结构与其生物活性之间存在怎样关系的研究也较少。因此,应广泛参考国内外其他天然产物多糖提取的方法,总结出相对合理的经验,在柿子多糖提取中融入现代新的提取技术,创新升级,从而提高柿子多糖得率。通过研究柿子多糖生物活性及其作用机制,了解多糖的生物活性与人体健康之间的关系,为实现柿子多糖的功能化、产业化、规模化生产提供理论研究依据。
