蝴蝶兰‘红箭’组织培养快繁技术
2021-08-11陈春
陈 春
(福建省林业科技试验中心,福建 南靖 363600)
蝴蝶兰(Phalaenopsisspp.)属于兰科蝴蝶兰属,因其具有很高的观赏价值与经济价值,被称为“兰中皇后”,可作为盆栽和鲜切花销售,深受消费者青睐[1-3]。蝴蝶兰‘红箭’是以‘瑞丽美人’为母本、‘台林红天使’为父本,通过人工杂交的方法选育出的新品系(良种编号:闽R-SC-DR-026-2015)。该品种是蝴蝶兰大红花系列,株型整齐,叶片挺立匀称,花序排列对称整齐,花型丰满圆润,花色鲜红,色泽艳丽、均衡,花瓣边缘略带白边,唇瓣深红无杂色,柱头花粉苞片雪白,平均花梗长达100 cm以上,最长可达110 cm,花梗粗壮,尤其适合作为鲜切花品种;具有花期长、耐低温等优点,适合作为国内市场的年销花,市场应用前景广阔。
蝴蝶兰组织培养已有较多的报道[4-15],但不同的蝴蝶兰品种,其培养条件差别也较大[4,15],研究结果有较大的不同。而‘红箭’组织培养技术未见报道。为此,本研究对蝴蝶兰新品种‘红箭’的诱导、增殖、生根培养及组培苗移栽等关键环节开展系统研究,以期建立其组织培养快繁技术体系,为蝴蝶兰新品种‘红箭’种苗规模化生产及推广应用提供有力的技术支持。
1 材料与方法
1.1 试验材料
‘红箭’是漳州森晖兰花产业有限公司和福建省林业科技试验中心共同培育的蝴蝶兰新品种。2019年3月从温室大棚中选取花朵无畸形、无病虫害的花梗作为外植体。
1.2 试验方法
1.2.1 外植体的消毒 用剪刀将花梗上的花朵剪掉,将外植体用稀释过的洗衣粉溶液浸泡10 min,再用自来水冲洗30 min,放置于超净工作台上备用。具体消毒方法(表1):将75 %酒精倒入外植体的烧杯中轻轻震荡消毒30、45、60 s,之后用无菌水清洗外植体3~5遍;然后用0.1 % 升汞消毒,消毒时间设置为15、20、25、30 min,最后以无菌水震荡冲洗5~6遍。将消毒后的外植体切成2 cm左右且带芽点的小段,接种到诱导培养基中,每个消毒处理接30个外植体,3次重复。培养20 d后观察、统计并计算污染率、死亡率、存活率。污染率/% = 污染外植体数/接种总外植体数×100;死亡率/%=死亡的外植体数/接种总外植体数×100;存活率/%=100-污染率-死亡率。
1.2.2 不定芽的诱导培养 不定芽诱导的基础培养基为MS+蔗糖30 g·L-1,应用L9(34)正交试验设计方法,6-BA质量浓度为:3.0、5.0、7.0 mg·L-1;Ad(腺嘌呤)质量浓度为:0、5.0、10.0 mg·L-1,NAA质量浓度为:0、0.3、0.6 mg·L-1,各处理因子水平见表2。每个处理接种30瓶,每瓶接种1个外植体,3次重复。30 d后,观察并分析不定芽的萌发及生长状况,进行正交试验方差分析,筛选‘红箭’的最佳诱导培养基。诱导率=萌发的外植体数/接入的总外植体数。
1.2.3 不定芽的增殖培养 增殖培养基础培养基为MS+香蕉80 g·L-1+土豆80 g·L-1+蔗糖30 g·L-1,附加不同质量浓度的6-BA(分别为4.0、5.0、6.0、7.0 mg·L-1)和NAA(分别为0.2、0.4、0.6 mg·L-1)(表4)。每个处理接30个不定芽,3次重复。培养50 d后,分析不定芽的增殖系数并观察其生长情况。增殖系数=总不定芽数/接种的不定芽数。
1.2.4 生根诱导培养 不定芽生长至2~3 cm且有3个叶片以上时,接种到生根壮苗培养基中。生根基础培养基为1/2 MS+香蕉80 g·L-1+土豆80 g·L-1+活性炭1.5 g·L-1+蔗糖20 g·L-1,附加不同质量浓度NAA(0.2、0.4、0.6 mg·L-1)和IBA(0.2、0.4、0.6 mg·L-1),具体组合见表5。每种培养基接种30瓶,每瓶接种10个不定芽,3次重复。45 d时,统计平均根数、平均根长、平均生根率。平均生根率/%=培养45 d时的生根苗数/接种的芽数×100。
1.2.5 炼苗及移栽 ‘红箭’的组培苗根长至3 cm以上且长出3片叶子时即可炼苗及出瓶移栽[7-8]。炼苗7 d后,可将组培苗移栽到不同的基质中进行栽培,基质分别为水苔、树皮、水苔∶树皮=2∶1、水苔∶树皮=1∶1,共4个处理(表6),每个处理移栽30株组培生根苗,3次重复。组培苗移栽后应浇透水,并注意保持一定湿度,放置在温室大棚中栽培40 d时,统计成活率,并观察植株的生长情况。
1.3 培养及栽培条件
组织培养时,培养基均添加琼脂7.0 g·L-1,pH值均调至5.60~5.80,培养室温度控制在22~25 ℃,光照强度为2500~3000 lx,光照的周期控制在10~12 h·d-1。炼苗及移栽时,白天温度为25~28 ℃,夜间温度为20~22 ℃。
2 结果与分析
2.1 消毒时间对‘红箭’外植体无菌体系建立的影响
由表1可知,不同酒精和升汞的消毒时间对花梗污染率和死亡率的影响显著。当酒精消毒时间少于60 s时,随着酒精和升汞消毒时间的延长,污染率均呈下降趋势;升汞消毒时间达30 min时,外植体开始出现死亡现象。处理12(酒精消毒时间为60 s和升汞消毒时间为30 min)的死亡率最高,达44.9%;处理11(酒精消毒60 s,升汞消毒25 min)的污染率最低,但有一部分外植体死亡,死亡率为28.0%,存活率50.4%;而处理7(酒精消毒45 s、升汞消毒25 min)的外植体污染率为23.5%,死亡率为0,存活率高达76.5%。因此本试验筛选出‘红箭’的最适消毒方法为处理7。
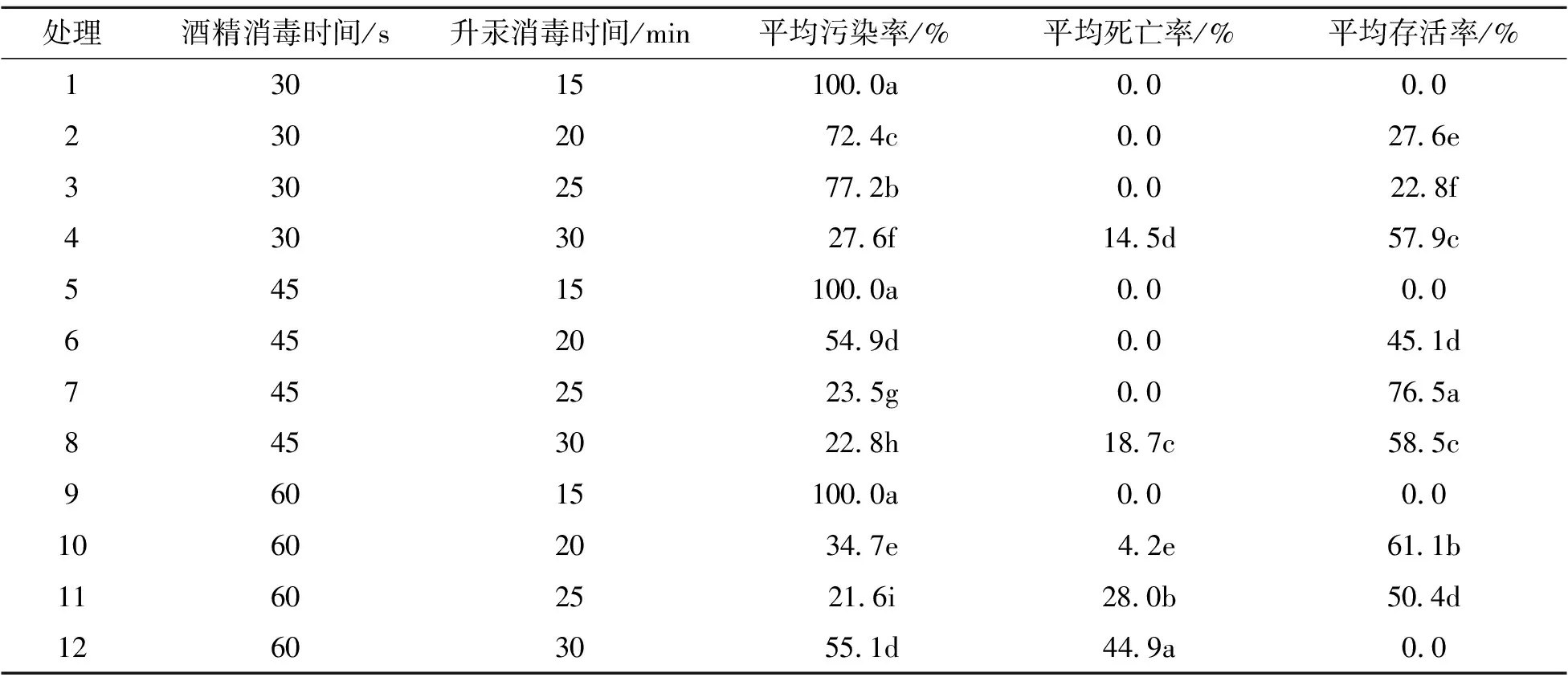
表1 消毒时间对花梗诱导的影响
2.2 植物生长调节剂对花梗诱导的影响
将消毒后的‘红箭’花梗接种到不定芽萌发诱导的培养基上,15 d左右不定芽开始萌发。正交试验结果(表2)表明,不同的植物生长调节剂组合,‘红箭’梗诱导率不同,添加一定浓度的6-BA、Ad、NAA有利于‘红箭’不定芽的诱导。9组处理中,处理5的平均诱导率最高,为84.6%。‘红箭’梗诱导培养基的最佳组合为A2B2C3,也就是MS+6-BA 5.0 mg·L-1+Ad 5.0 mg·L-1+NAA 0.6 mg·L-1+蔗糖30 g·L-1。3个因子A(6-BA)、B(Ad)、C(NAA)对‘红箭’的花梗诱导率的影响不同,其影响力为A>B>C,6-BA对‘红箭’花梗不定芽的诱导影响最大,其次为Ad,最后是NAA。方差分析结果(表3)显示,6-BA、Ad、NAA 3个因子对‘红箭’的诱导率的影响均极显著(P<0.01)。
2.3 不同浓度的6-BA与NAA组合对不定芽增殖的影响
从表4可以看出,当NAA质量浓度相同时,不同质量浓度6-BA的增殖系数差异显著,随6-BA质量浓度增加,增殖系数也随着增大,6-BA质量浓度7.0 mg·L-1时,增殖系数达4.36,然而此时的不定芽叶色转浅,叶片未展开,芽弱而小。综合增殖系数及苗木的生长状态,6-BA的质量浓度为6.0 mg·L-1较为适宜。当6-BA质量浓度为6.0 mg·L-1时,NAA质量浓度在0.2、0.4 mg·L-1时的增殖系数最高,且显著优于其它处理;NAA 0.2 mg·L-1时不定芽增殖系数为3.51,叶色深绿,叶片适中,芽粗壮。
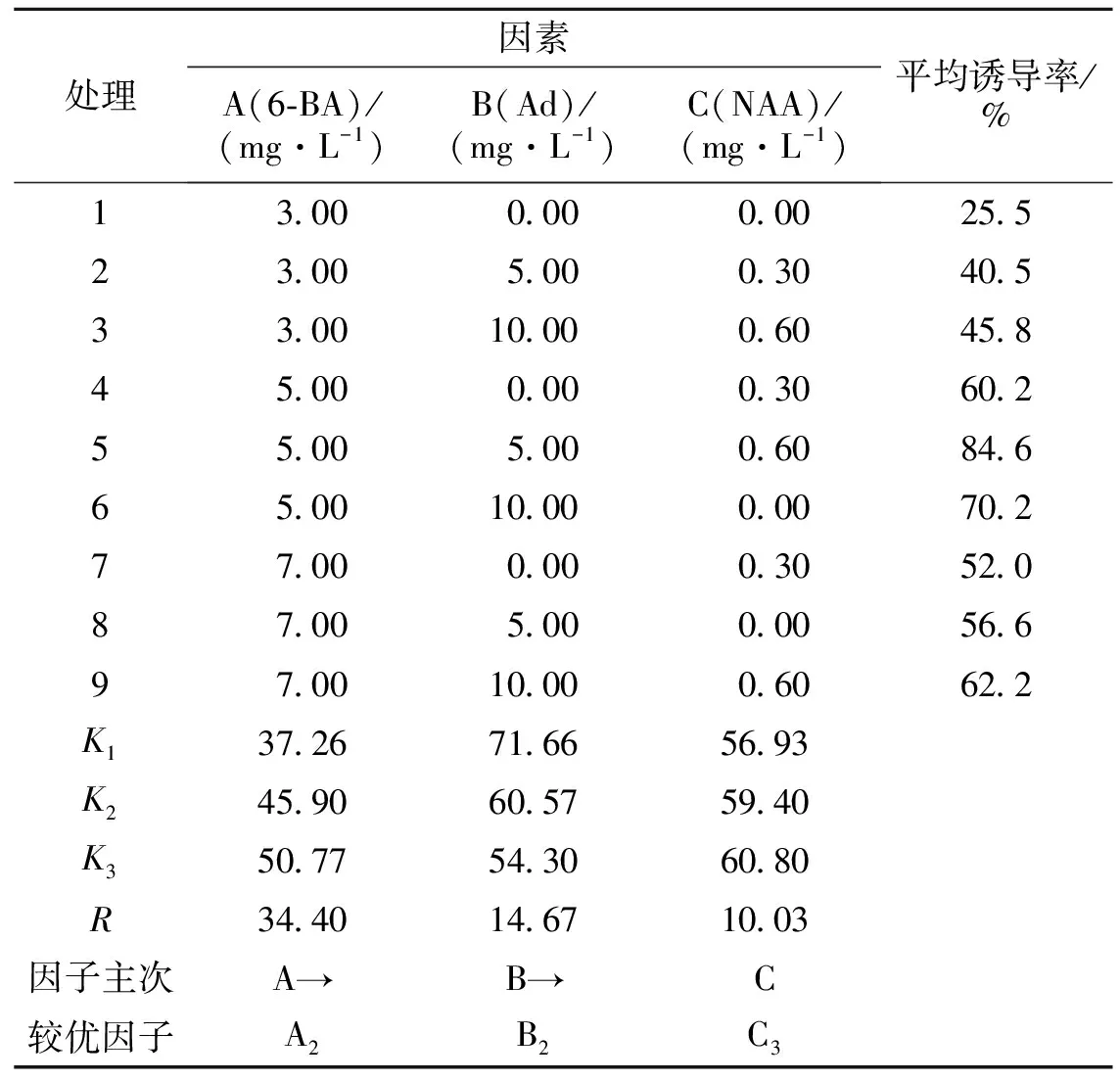
表2 花梗不定芽诱导培养正交试验结果
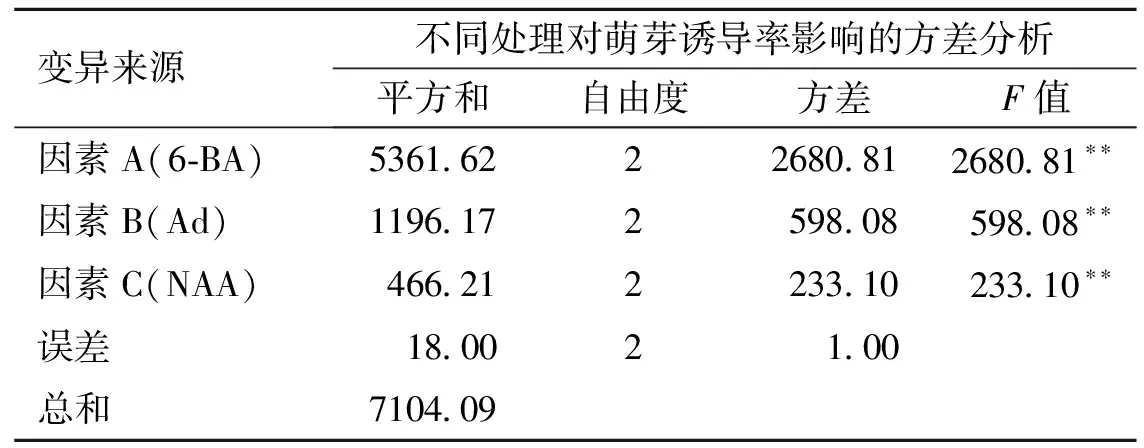
表3 诱导培养正交试验方差分析
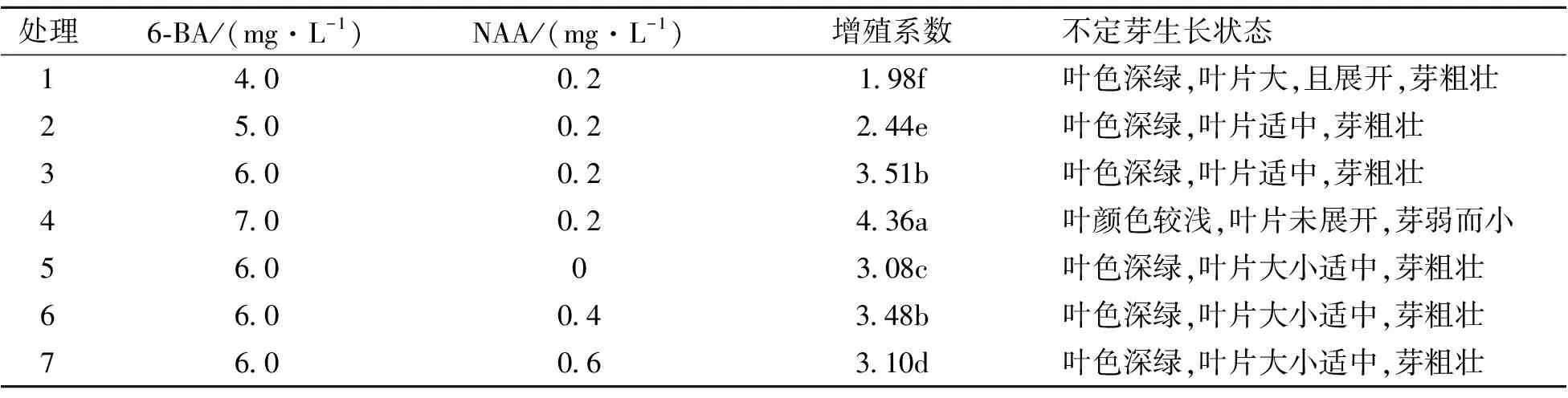
表4 不同浓度的6-BA与NAA组合对不定芽增殖的影响
2.4 不同浓度的NAA、IBA对红箭生根的影响
不定芽生根培养约25 d时,可看到绿色根点长出,50 d时统计平均根数、平均根长、平均生根率以及观察生根苗的生长情况。从表5可以看出,NAA和IBA均可以促进根的生成,虽然生根率均达100%,但附加IBA时,平均根数和根长均显著高于附加NAA的处理。IBA质量浓度为0.4 mg·L-1时,平均根数最多,达4.20条;平均根长最长,达3.88 cm。综上,‘红箭’生根培养基为1/2 MS+IBA 0.4 mg·L-1+香蕉80 g·L-1+土豆80 g·L-1+活性炭1.5 g·L-1+蔗糖20 g·L-1。
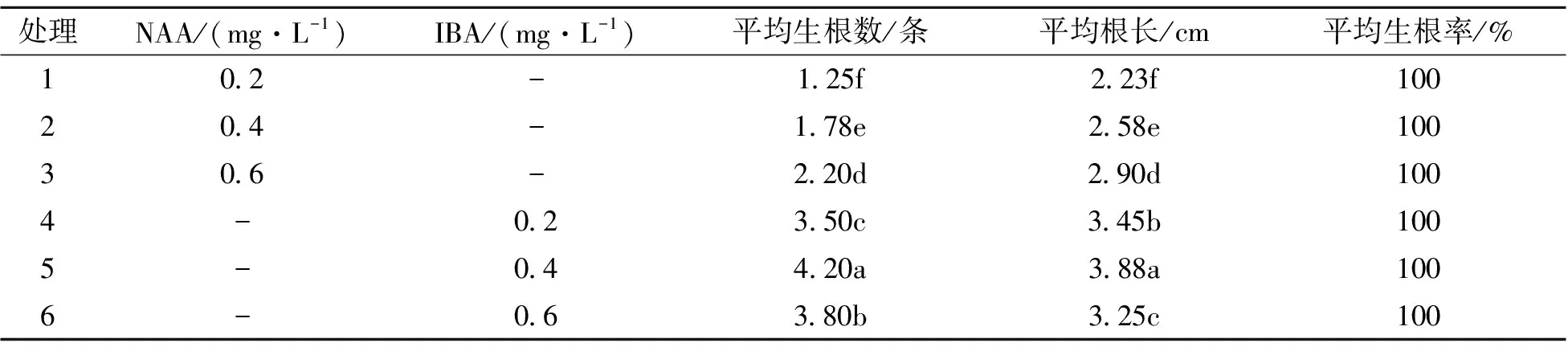
表5 不同浓度的NAA、IBA对生根的影响
2.5 不同基质对组培苗移栽成活率的影响
移栽40 d后观察并分析移栽成活率。由表6可知,基质对移栽成活率的影响呈显著差异。以水苔为基质时,‘红箭’组培苗移栽成活率最高,达95.2%;在水苔中添加一定比例的树皮,组培苗移栽的成活率降低;随着水苔比例降低,成活率呈下降趋势。这可能是因为蝴蝶兰的根是气生根,疏松、透气、保肥保水性好的基质适合其生长,而水苔基质柔软性好,且保水性和肥力强,因此本试验选择水苔作为组培苗移栽的基质。

表6 不同基质对组培苗移栽成活率的影响
3 结论与讨论
本试验确定了蝴蝶兰‘红箭’花梗的最佳消毒处理为75%酒精消毒45 s后,0.1%升汞消毒25 min;最佳诱导培养基为MS+6-BA 5.0 mg·L-1+Ad 5.0 mg·L-1+NAA 0.6 mg·L-1+蔗糖30 g·L-1,诱导率达83.5%;最佳增殖培养基为MS+6-BA 7.0 mg·L-1+Ad 5.0 mg·L-1+NAA 0.2 mg·L-1+香蕉80 g·L-1+土豆80 g·L-1+蔗糖30 g·L-1,增殖系数达3.36;最佳生根诱导培养基为1/2 MS+NAA 0.5 mg·L-1+香蕉80 g·L-1+土豆80 g·L-1+活性炭 1.0 g·L-1+蔗糖15 g·L-1,生根率达100%;蝴蝶兰组培苗在以水苔为基质中,移栽成活率可达95.2%。
蝴蝶兰植物组织培养无菌体系建立的成功与否主要取决于污染率的控制[4]。本试验通过选择合适的外植体,采用优化酒精与升汞消毒的时间,降低外植体的污染率和死亡率,这与宋火元[16]的研究相一致。
本试验应用正交试验,对花梗不定芽诱导培养基进行较全面的优化,发现‘红箭’梗诱导培养基的最佳培养基为MS+6-BA 5.0 mg·L-1+Ad 5.0 mg﹒L-1+NAA 0.6 mg·L-1+蔗糖30 g·L-1,这个结果与已建立的组培体系的其它蝴蝶兰品种的的培养基不一致[8-12],这也进一步说明了蝴蝶兰不同品种的组织培养条件差别较大。
