福建省猪源BVDV流行病学检测分析及其对CSFV抗体的影响
2021-08-10曾亮明张体银刘毅发余勋信林秋敏刘小龙傅光华白泉阳张渊魁
徐 磊,曾亮明,张体银,刘毅发,杨 慧,余勋信,林秋敏,刘小龙,傅光华,白泉阳,黄 瑜*,张渊魁
(1.福建农业职业技术学院,福建 福州 350119;2.福建省农业科学院 畜牧兽医研究所,福建 福州 350013;3.兆丰华生物科技(福州)有限公司,福建 福州350014;4.福州海关技术中心,福建 福州 350001;5.派生特(福州)生物科技有限公司,福建 福州 350500;6.兆丰华生物科技(南京)有限公司,江苏 南京 211102)
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)呈全球性分布,有2个基因型,即BVDV-1与BVDV-2,和猪瘟(classical swine fever,CSF)病毒、羊边界病毒同属于黄病毒科瘟病毒属[1]。BVDV感染宿主广泛,可感染牛、猪、羊、骆驼、鹿和多种野生动物,感染宿主的不同及BVDV毒株遗传背景的不同会引起不同的临床症状[2-4]。猪感染BVDV能引起持续性感染、免疫抑制,常不表现出临床症状或仅表现为亚临床症状,出现类似于温和型CSF的临床症状和病理变化,其致病机理与临床类型较为复杂,对猪群危害很大[5-6]。近年来,有研究新发现不同于BVDV-1、BVDV-2的BVDV毒株,被研究者划分为BVDV-3,由于BVDV与CSF病毒(CSF virus,CSFV)存在广泛的交叉抗原和血清学交叉反应,这些都给猪源牛病毒性腹泻病(bovine viral diarrhea,BVD)和CSF的防控带来了新的挑战[7-8]。
目前,各国主要采取对持续性感染动物的检测和淘汰方法防控BVDV[9-10]。本课题组前期已建立了猪源BVDV特异性抗体和病原检测方法,敏感性高、特异性强、重复性好,适合用于猪源BVDV的血清学与病原学监测[11-13]。基于此,本研究采用已建立的ELISA方法[11]和RT-PCR方法[12]分别进行福建省猪源BVDV血清学和病原学检测,并采用间接血凝试验(indirect hemagglutination assay,IHA)进行CSFV抗体检测,以期了解福建省猪源BVDV流行与分布情况及其对CSFV抗体影响,为深入开展猪源BVDV的研究奠定基础。
1 材料与方法
1.1 病毒BVDV Oregon C24V株及NADL株均由中国兽医药品监察所提供;CSFV由兆丰华生物科技(福州)有限公司提供。
1.2 主要试剂及仪器兔抗CSFV高免血清、CSFV抗体阴性的猪抗BVDV阳性及阴性血清均由福建省农业科学院畜牧兽医研究所提供;HRP-兔抗猪IgG为Rockland公司产品;马血清为Gibco公司产品;酶标板为Corning Costar公司产品;TRIzol Reagent购自Invitrogen公司;M-MLV Reverse Transcriptase、Ribonuclease Inhibitor购自宝生物工程(大连)有限公司;CSFV IHA抗体检测试剂盒购自中国农业科学院兰州兽医研究所;质粒提取试剂盒、pGM-T快连载体、T4DNA ligase、Top 10感受态细胞购自天根生化科技(北京)有限公司;全自动酶标仪为美国BIO RAD公司产品;PCR扩增仪为Eppendorf Mastercycler Gradient AG22331。
1.3 样品来源16 537份猪血样分别来自于福建省的福州、宁德、莆田、漳州、泉州、龙岩、厦门、三明、南平共9个地市的293个猪场,包括7 068份CSF疫苗免疫后28 d母猪血样和9 469份CSF疫苗二免后28 d仔猪血样。其中,母猪血样包含4 897份临床健康母猪血样和2 171份疑似猪瘟母猪血样;仔猪血样包含6 359份临床健康仔猪血样和3 110份疑似猪瘟仔猪血样。
1.4 福建省猪源BVDV抗体检测猪血样经离心分离血清,得到16 537份猪血清样品,按照本课题组已建立的猪源BVDV抗体ELISA检测方法[11]开展福建省猪源BVDV抗体检测。
试验步骤主要包括抗原包被(BVDV Oregon C24V株与NADL株联合包被)、洗涤、封闭、加阻断抗体(兔抗CSFV高免血清)、加待检猪血清样品、洗涤、加酶标二抗(HRP-兔抗猪IgG)、洗涤、加底物显色、终止反应。用酶标仪读取吸光度D450 nm值,若待检猪血清样品D450 nm值≥0.28,判为BVDV抗体阳性;否则判为BVDV抗体阴性。
统计BVDV抗体阳性率数据,采用χ2检验(chi-square test)分析,P<0.05为差异显著。
1.5 福建省猪群CSFV抗体检测猪血样经离心分离血清,得到16 537份猪血清样品,按照CSFV IHA抗体检测试剂盒操作步骤进行福建省猪群CSFV IHA抗体效价测定,IHA测定结果以log2x表示。若待检猪血清样品CSFV IHA抗体效价(log2x)≥4,判为CSFV抗体阳性;否则判为CSFV抗体阴性。
所得CSFV IHA抗体效价(log2x)数据以中位数(P25,P75)表示,采用Mann-Whitney U检验分析,P<0.05为差异显著。并统计CSFV抗体阳性率数据,采用χ2检验分析,P<0.05为差异显著。
1.6 福建省猪群BVDV和CSFV抗体水平的相关性分析统计在不同CSFV IHA抗体效价(log2x)中BVDV抗体阳性猪与BVDV抗体阴性猪的各自百分数,采用χ2检验分析,P<0.05为差异显著。并采用Spearman相关系数对CSFV IHA抗体效价(log2x)与BVDV抗体(D450 nm值)的相关性进行分析,以P<0.05为差异显著有统计学意义。
1.7 猪源BVDV的抗原检测从样品中随机抽取临床健康母猪血样100份、疑似猪瘟母猪血样100份、临床健康仔猪血样100份和疑似猪瘟仔猪血样100份,共400份猪血样,提取血样白细胞待检。
依据本课题组已建立的猪源BVDV特异性RT-PCR方法[12],合成特异性引物序列(P1:5′-tagccatgcccttagtaggact-3′,P2:5′-attccatgtgccatgtacagcag-3′),扩增片段289 bp。对所提取白细胞进行BVDV抗原检测,每次检测均设立BVDV Oregon C24V与NADL株、CSFV作为对照。对经凝胶成像扫描仪观察为目的片段大小的PCR产物,进行克隆、测序,将测序结果与已发表的BVDV的5′-UTR序列的相应区域作同源性比较。并统计BVDV阳性率数据,采用χ2检验分析,P<0.05为差异显著。
1.8 猪源BVDV抗原与抗体检测结果分析将1.7中400份猪血样的BVDV抗原检测结果及这些猪血样在1.4中对应的BVDV抗体检测结果进行数据统计,并以“抗体-/抗原-”表示猪源BVDV抗体与抗原均为阴性的样品结果,而“抗体-/抗原+”、“抗体+/抗原-”与“抗体+/抗原+”的表示方法与此一致。所得数据采用χ2检验分析不同临床类型猪中上述BVDV抗体+/-/抗原+/-的各项占比,P<0.05为差异显著。
2 结果
2.1 福建省猪源BVDV抗体检测16 537份猪血清样品经本课题组已建立的猪源BVDV抗体ELISA检测方法[11]测定,结果显示福建省猪群BVDV抗体阳性率为35.6%(5 891/16 537),猪场BVDV抗体阳性率为89.4%(262/293),9个地市BVDV抗体阳性率为100.0%(9/9)。其中,在福建省9个地市的猪群BVDV抗体阳性率中,南平市最高为39.5%(790/2 002),厦门市最低为21.0%(239/1 138);在福建省9个地市的猪场BVDV抗体阳性率中,莆田市为100.0%(28/28)、漳州市为100.0%(33/33)、泉州市为100.0%(29/29)和厦门市为100.0%(21/21)均最高,宁德市最低为73.1%(19/26)(表1)。
分别统计母猪与仔猪BVDV抗体阳性率数据,经χ2检验分析显示,福建省及其9个地市的母猪BVDV抗体阳性率均分别显著高于仔猪(P<0.05)。福建省母猪与仔猪BVDV抗体阳性率分别为44.1%(3 118/7 068)与29.3%(2 773/9 469)。其中,在福建省9个地市的母猪BVDV抗体阳性率中,福州市最高为52.9%(599/1 132),厦门市最低为25.2%(122/485);在福建省9个地市的仔猪BVDV抗体阳性率中,南平市最高为35.3%(431/1 220),厦门市最低为17.9%(117/653)(表1)。
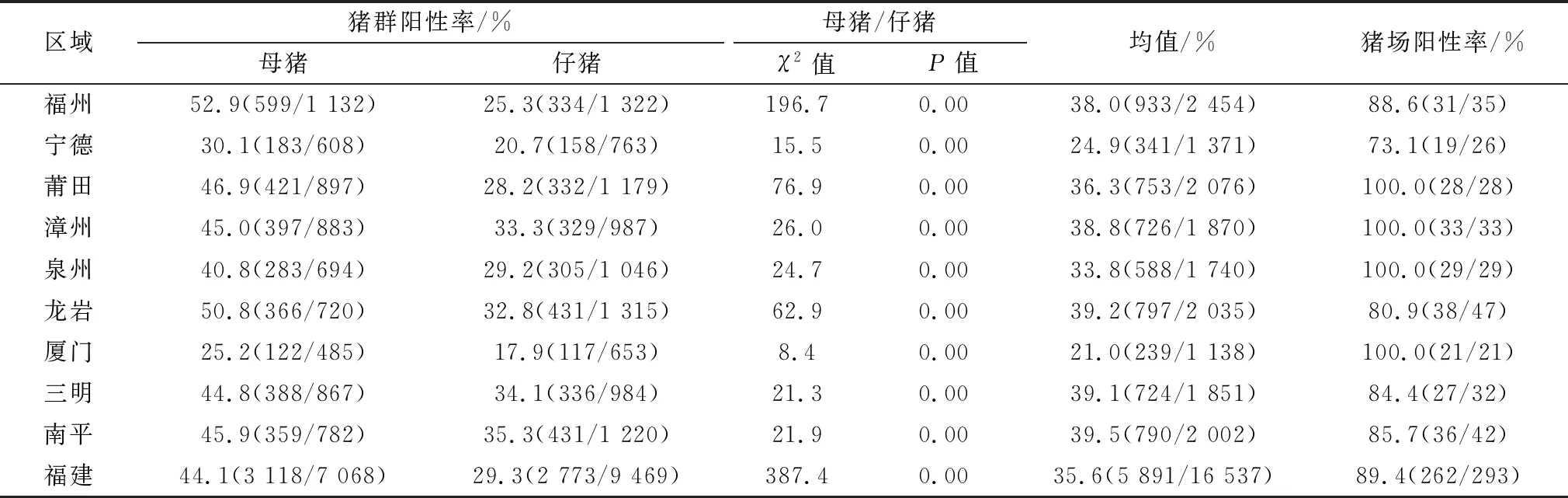
表1 福建省猪源BVDV抗体检测结果
分别统计临床健康与疑似猪瘟猪群的BVDV抗体阳性率数据,经χ2检验分析显示,福建省及其9个地市疑似猪瘟母猪与仔猪的BVDV抗体阳性率均分别显著高于临床健康母猪与仔猪(P<0.05)。福建省临床健康母猪与疑似猪瘟母猪BVDV抗体阳性率分别为36.5%(1 789/4 897)与61.2%(1 329/2 171),福建省临床健康仔猪与疑似猪瘟仔猪BVDV抗体阳性率分别为22.8%(1 448/6 359)与42.6%(1 325/3 110)。其中,在临床健康母猪BVDV抗体阳性率中,福州市最高为46.3%(383/827),厦门市最低为14.5%(48/330);在疑似猪瘟母猪BVDV抗体阳性率中,龙岩市最高为73.1%(166/227),宁德市最低为45.6%(83/182)。在临床健康仔猪BVDV抗体阳性率中,南平市最高为31.2%(247/792),厦门市最低为7.2%(32/446);在疑似猪瘟仔猪BVDV抗体阳性率中,漳州市最高为56.6%(180/318),莆田市最低为31.9%(128/401)(表2)。
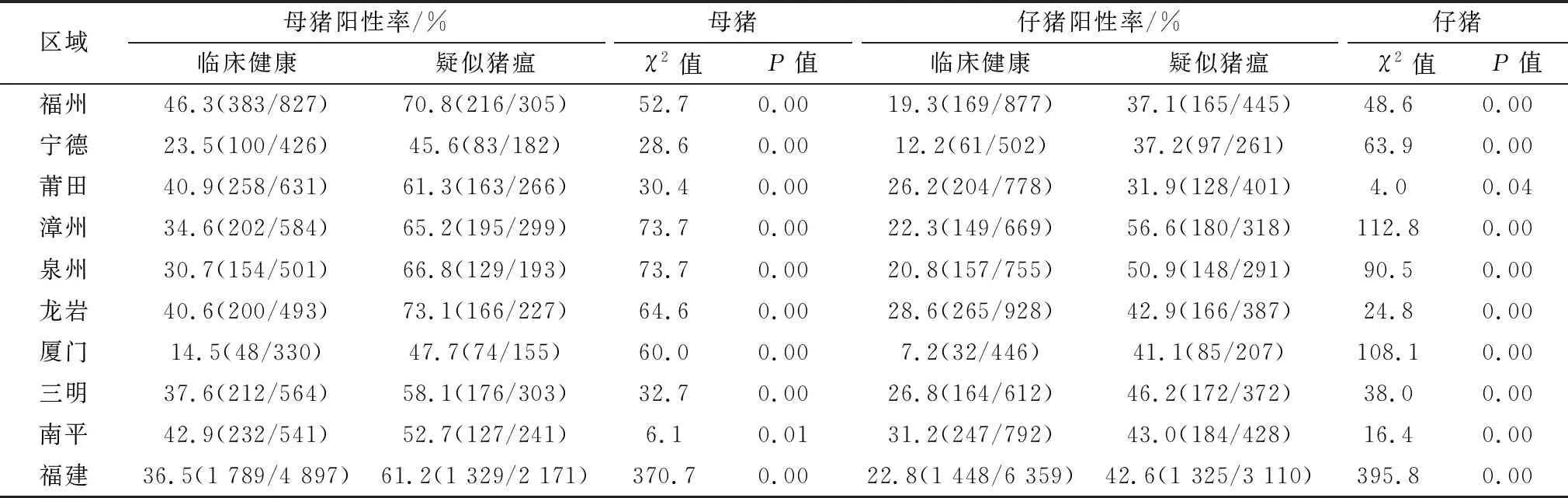
表2 临床健康猪与疑似猪瘟猪的BVDV抗体检测结果
2.2 福建省猪群CSFV抗体检测16 537份福建省猪血清样品采用CSFV IHA测定,经Mann-Whitney U检验分析显示,BVDV抗体阴性猪的CSFV IHA抗体效价(log2x)显著高于BVDV抗体阳性猪(P<0.05),BVDV抗体阴性猪与阳性猪的CSFV IHA抗体效价(log2x)中位数分别为7和3(表3)。
分别统计BVDV抗体阴性猪与阳性猪的CSFV IHA抗体阳性率数据,经χ2检验分析显示,BVDV抗体阴性猪的CSFV IHA抗体阳性率显著高于BVDV抗体阳性猪(P<0.05),BVDV抗体阴性猪与阳性猪的CSFV IHA抗体阳性率分别为86.0%(9 151/10 646)和27.3%(1 611/5 891)(表3)。

表3 福建省猪群CSFV抗体检测结果
2.3 福建省猪群BVDV和CSFV抗体水平的相关性分析统计在不同的CSFV IHA抗体效价(log2x)中BVDV抗体阳性猪与BVDV抗体阴性猪的各自百分数(图1),结果显示,在6≤CSFV IHA抗体效价(log2x)≤11区间内共有8 842份猪血清样品,其中有95.9%(8 479/8 842)的猪血清样品为BVDV抗体阴性,即:CSFV IHA抗体效价(log2x)在6~11的猪血清样品,其BVDV抗体多为阴性。
BVDV抗体阳性的猪血清样品共有5 891份,其中有88.7%(5 224/5 891)的猪血清样品CSFV IHA抗体效价(log2x)≤4(CSFV抗体水平较低),即:BVDV抗体阳性的猪血清样品,其CSFV IHA抗体效价(log2x)普遍较低(≤4)。BVDV抗体阴性的猪血清样品共有10 646份,其中有16.6%(1 769/10 646)的猪血清样品CSFV IHA抗体效价(log2x)≤4(CSFV抗体水平较低),经χ2检验分析,该百分比(16.6%)显著低于BVDV抗体阳性猪(88.7%)(χ2= 8 066.4,P<0.05)(图1)。

图1 不同CSFV IHA抗体效价中BVDV抗体阳性猪与阴性猪的各自百分数
采用Spearman相关系数对CSFV IHA抗体效价与BVDV抗体的相关性进行分析,Spearman相关分析结果显示,CSFV IHA抗体效价(log2x)与BVDV抗体(D450 nm值)呈负相关(r=-0.819,P<0.05)(表4)。

表4 猪群BVDV抗体和CSFV抗体的相关性分析
2.4 猪源BVDV的抗原检测应用本课题组已建立的猪源BVDV特异性RT-PCR方法[12]对400份样品进行检测及克隆、测序,结果显示(图2),共有61份样品RT-PCR扩增产物为289 bp大小的DNA片段,且此61份样品基因片段核苷酸序列同源性在97.6%~99.8%,与GenBank中发布的BVDV NADL株的核苷酸序列同源性为88.3%~98.1%,而与BVDV Oregon C24V株的核苷酸序列同源性在90.0%~99.2%之间。由此可见,本研究中测定的61份阳性样品的基因序列同源性较高,而猪血样BVDV阳性率为15.3%(61/400)。采用χ2检验对BVDV阳性率数据进行分析显示,猪血样BVDV阳性率由高至低依次为:疑似猪瘟母猪血样22.0%(22/100)、疑似猪瘟仔猪血样17.0%(17/100)、临床健康母猪血样13.0%(13/100)和临床健康仔猪血样9.0%(9/100),但差异不显著(χ2=7.2,P≥0.05)(表5)。

表5 猪源BVDV检测结果
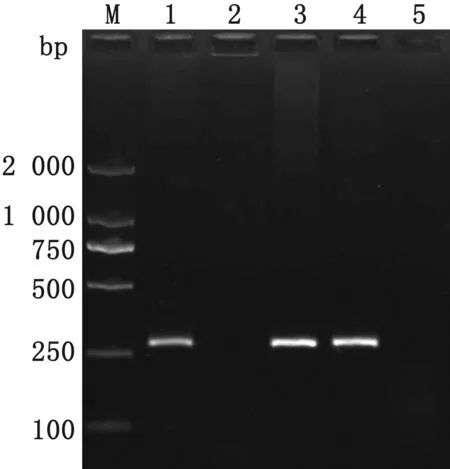
M.DL2000 DNA Marker;1.猪阳性血样RT-PCR产物;2.CSFV RT-PCR产物;3.BVDV Oregon C24V RT-PCR产物;4.BVDV NADL RT-PCR产物;5.阴性对照
2.5 猪源BVDV抗原与抗体检测结果分析将400份同时进行了猪源BVDV抗原和抗体检测的猪血样结果进行数据统计,结果显示,400份猪血样中各项占比由高至低依次为:抗体-/抗原-45.0%(180/400)、抗体+/抗原-39.8%(159/400)、抗体-/抗原+12.0%(48/400)与抗体+/抗原+3.2%(13/400)。经χ2检验分析显示,不同临床类型猪的BVDV抗体+/-/抗原+/-的构成比差异显著有统计学意义(χ2=66.2,P<0.05)。其中,100份临床健康母猪血样与100份临床健康仔猪血样中各项占比由高至低依次分别为:抗体-/抗原-(51.0%与72.0%)、抗体+/抗原-(36.0%与19.0%)、抗体-/抗原+(10.0%与7.0%)与抗体+/抗原+(3.0%与2.0%);100份疑似猪瘟母猪中各项占比由高至低依次为:抗体+/抗原-62.0%、抗体-/抗原+18.0%、抗体-/抗原-16.0%与抗体+/抗原+4.0%;100份疑似猪瘟仔猪血样中各项占比由高至低依次为:抗体+/抗原-42.0%、抗体-/抗原-41.0%、抗体-/抗原+13.0%与抗体+/抗原+4.0%(表6)。
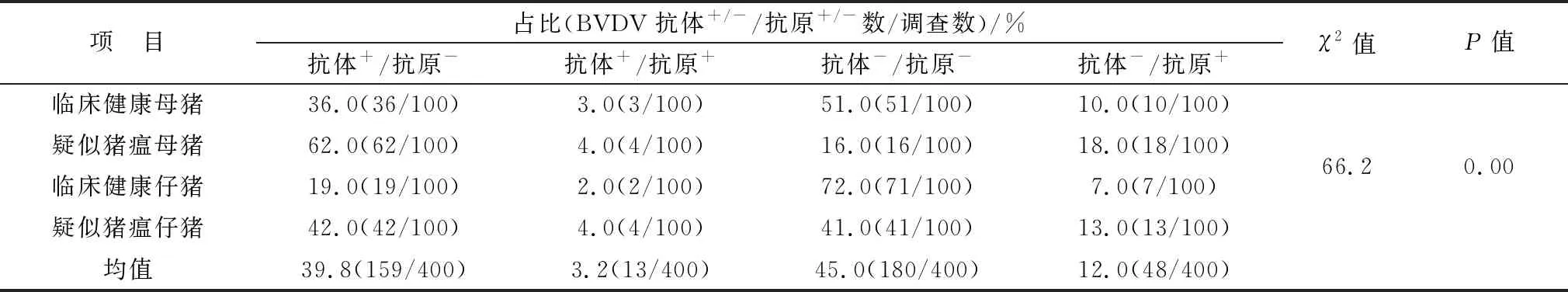
表6 猪源BVDV抗原与抗体检测结果
3 讨论
BVDV感染后,母猪会出现受孕率和产仔数下降、产死胎和流产等繁殖障碍问题;先天性感染的仔猪出生后会形成持续性感染和免疫耐受,长期带毒并成为传染源;保育猪会出现被毛粗乱、生长迟缓、腹泻、消瘦、贫血、结膜炎、多发性关节炎等症状[6,13-14],引起国内外兽医界极大关注。近年来,各国猪群BVDV感染趋势日益增加,澳大利亚、爱尔兰、德国、荷兰、挪威、丹麦和北美地区的猪源BVDV抗体阳性率达2.0%~43.0%[6,15-16]。我国猪源BVDV感染于1996年在吉林首次发现,之后福建、江西、浙江、河南、湖南、安徽、辽宁和广西等地均有猪源BVDV感染的研究报道,但主要集中在临床诊断、病原学检测方面,对猪源BVDV血清学研究相对较少[13,17]。尤其是已有研究多采用牛源BVDV抗体检测ELISA商品化试剂盒,进行猪源BVDV血清学研究,在鉴别猪源BVDV抗体与CSFV抗体的特异性上有不足[11,18]。基于此,本课题组前期建立了鉴别猪源BVDV抗体与CSFV抗体的ELISA检测方法,并对福州市部分猪群BVDV感染进行了血清学监测,发现福州市猪群BVDV抗体阳性率为34.7%[11]。但是,受区域、样本数量的限制,研究结果不能完全反映福建省猪源BVDV感染的真实情况。
本研究对福建省主要规模化猪场进行了猪源BVDV血清学检测,范围涉及9个地市,具有一定的普遍性。结果显示,福建省猪场BVDV抗体阳性率为89.4%(262/293),9个地市抗体阳性率为100.0%(9/9),说明福建省猪源BVDV感染情况较普遍。并且9个地市猪群BVDV抗体阳性率差异明显(21.0%~39.5%),平均阳性率为35.6%(5 891/16 537),其中福州(38.0%)、莆田(36.3%)、漳州(38.8%)、龙岩(39.2%)、三明(39.1%)和南平(39.5%)高于平均阳性率,应为福建省猪源BVDV感染的高流行地区。福建省及其9个地市的母猪BVDV抗体阳性率均分别显著高于仔猪(P<0.05),福建省及其9个地市疑似猪瘟母猪与仔猪的BVDV抗体阳性率均分别显著高于临床健康母猪与仔猪(P<0.05),说明母猪与疑似猪瘟猪为猪源BVDV感染的高流行群体。在本研究中,福州市猪源BVDV抗体检测结果与本课题组前期研究结果比较接近[11],说明猪源BVDV在福州市猪群普遍流行且相对稳定;而龙岩市猪群BVDV抗体阳性率高于戴爱玲课题组[14]的研究结果(28.6%),这可能源于采样时间和抗体检测方法不同。
猪源BVDV抗体对CSFV抗体的影响,不同研究有着完全不同的结果[14,18-19]。本研究对福建省16 537份猪血清样品同时进行了猪源BVDV抗体和CSFV抗体检测及分析,结果显示,BVDV抗体阴性猪的CSFV IHA抗体效价(log2x)、抗体阳性率均显著高于BVDV抗体阳性猪(P<0.05);而且CSFV IHA抗体效价(log2x)在6~11的猪血清样品,其BVDV抗体多为阴性,占比为95.9%(8 479/8 842);BVDV抗体阳性的猪血清样品,其CSFV IHA抗体效价(log2x)普遍较低(≤4),占比为88.7%(5 224/5 891);并且CSFV IHA抗体效价(log2x)与BVDV抗体(D450 nm值)呈负相关(r=-0.819,P<0.05)。结果说明,猪源BVDV感染对CSFV抗体存在抑制作用。
为进一步了解福建省猪源BVDV流行病学情况,本研究对400份猪血样同时进行了猪源BVDV血清学和分子流行病学检查,结果显示,猪血样BVDV阳性率为15.3%(61/400),与前期研究结果一致[12]。其中,相比临床健康猪的BVDV感染率为11.0%(22/200),疑似猪瘟猪有着更高的BVDV感染率为19.5%(39/200),且不同临床类型猪的BVDV抗体+/-/抗原+/-的构成比差异显著有统计学意义(χ2=66.2,P<0.05),表明疑似猪瘟猪与临床健康猪的BVDV感染情况差异明显,猪源BVDV感染在疑似猪瘟猪群中的角色有待进一步研究。对61份BVDV阳性样品的扩增产物测序结果分析表明,福建省猪源BVDV毒株的基因序列相似性较高。结果还显示,45.0%的猪呈抗体-/抗原-,说明猪未感染过BVDV;39.8%的猪呈抗体+/抗原-,说明猪产生了BVDV抗体;3.2%的猪呈抗体+/抗原+,说明猪处于病毒血症阶段。值得一提的是,12.0%的猪呈抗体-/抗原+,说明猪处于BVDV感染初期机体暂未产生抗体,或者持续感染。这类猪在临床健康猪和疑似猪瘟猪中均有存在,会长期持续排毒,是猪源BVDV的贮存库和传染源,应予以重视。
