藁本黄酮的纯化及体外抗氧化活性研究
2021-08-10韩秋菊李薇冯雅郡王晨陈仔君潘睿悦任璐罗静雯
韩秋菊,李薇,冯雅郡,王晨,陈仔君,潘睿悦,任璐,罗静雯
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
藁本为伞形科植物藁本LigusticumsinenseOliv.或辽藁本LigusticumjeholenseNakaietKitag.的干燥根茎和根[1],具有去湿除寒、缓解疼痛、抑菌抗炎、抗氧化、扩张血管、保护肝功能等功效,常用于医治风湿感冒、关节疼痛等疾病,是一种重要的中药材[2-4]。
大孔树脂具有污染低、稳定性高、选择性强、易操作等优点,常用于黄酮类化合物的分离纯化[5]。本文通过D-101大孔树脂柱层析对藁本黄酮粗提物进行纯化,并比较了纯化前后藁本黄酮的体外抗氧化活性,为更好地开发藁本资源、最大限度地利用其有效成分提供科学的理论依据。
1 实验部分
1.1 材料与仪器
藁本,产自辽宁抚顺;芦丁标准品、DPPH均为色谱纯;硝酸铝、氢氧化钠、亚硝酸钠、过氧化氢、水杨酸、盐酸、硫酸亚铁、三羟甲基氨基甲烷、无水乙醇、邻苯三酚、抗坏血酸均为分析纯。
ALC-1100.2型电子天平;Allbasic型分析研磨机;UV-2600型紫外可见分光光度计;HH-4型数显恒温水浴锅;DUG-9021A型电热恒温干燥箱;T0Z5-WS型离心机;LGJ-10型冷冻干燥机;RE-52AA型旋转蒸发器;SHB-Ш型循环水式多用真空泵。
1.2 实验方法
1.2.1 藁本黄酮的提取 取烘干的藁本样品,粉碎后过60目筛,以液料比15∶1加入75%的乙醇浸泡,超声(200 W,40 ℃,15 min),水浴(50 ℃,2 h),离心(3 000 r/min,5 min),取上清液,55 ℃浓缩,冷冻干燥,得藁本黄酮粗提物。准确称取藁本黄酮粗提物,溶于70%乙醇中制备藁本黄酮粗提液。
1.2.2 藁本黄酮含量的测定 黄酮含量按照NaNO2-Al(NO3)3-NaOH比色法测定[6]。芦丁标准曲线的线性回归方程为y=0.290 2x-0.005 1,
R2=0.999 8。
1.2.3 藁本黄酮的纯化
1.2.3.1 D-101大孔树脂的预处理 将D-101大孔树脂放入烧杯中,用95%乙醇浸泡12 h,充分溶胀后,滤除悬浮物,用95%乙醇反复冲洗,至加水不产生浑浊为止,用蒸馏水冲洗至无醇味,备用。
1.2.3.2 静态吸附与解吸实验 准确称取2.0 g预处理过的D-101大孔树脂,用滤纸吸干其表面水分,装入具塞磨口三角瓶中。加入藁本黄酮粗提液30 mL,于25 ℃、100 r/min 恒温振荡24 h,使其充分吸附,过滤,测定滤液中黄酮浓度,计算吸附率(%),考察上样液黄酮浓度和pH值对D-101大孔树脂吸附藁本黄酮性能的影响。将过滤后的树脂装入具塞磨口三角瓶中,再加入30 mL乙醇溶液,于25 ℃、100 r/min 恒温振荡24 h,使其充分解吸,过滤,测定滤液中的黄酮浓度,计算解吸率(%),考察洗脱液浓度对D-101大孔树脂解吸性能的影响。
吸附率=(C0-C1)/C0×100%
解吸率=(C2×V2)/[(C0-C1)×V0]×100%
式中C0——吸附前上样液黄酮浓度,mg/mL;
C1——吸附后滤液中黄酮浓度,mg/mL;
C2——解吸液中黄酮浓度,mg/mL;
V0——上样液体积,mL;
V2——解吸液体积,mL。
1.2.3.3 动态吸附与解吸实验 将预处理过的D-101大孔树脂装入规格为2.6 cm×50.0 cm 的玻璃层析柱中,藁本黄酮上样液按一定流速上样,测定流出液中黄酮的浓度,计算吸附率,考察上样液体积和流速对D-101大孔树脂吸附藁本黄酮性能的影响。用3 BV的水淋洗树脂柱,之后洗脱液按一定流速解吸,测定流出液中的黄酮浓度,计算解吸率,考察洗脱液流速对D-101大孔树脂解吸性能的影响及洗脱液用量。
1.2.3.4 藁本黄酮纯化工艺验证实验 按照优化后的条件纯化藁本黄酮,收集洗脱液,55 ℃浓缩,冷冻干燥。准确称取固体样品,溶于70%乙醇中,计算藁本黄酮回收率(%)和纯度(%)。
回收率=吸附率×解吸率×100%
纯度=C×V/M×100%
式中C——藁本黄酮浓度,mg/mL;
V——藁本黄酮溶液体积,mL;
M——藁本黄酮固体样品质量,mg。
1.2.4 藁本黄酮体外抗氧化实验
1.2.4.1 清除DPPH自由基 取 0.2 mmol/L DPPH 溶液2 mL,加入1 mL不同浓度的藁本黄酮样品或VC溶液、1 mL 95%乙醇,混匀,室温暗光下反应30 min,以重蒸水作参比,于517 nm测定样品吸光值,以95%乙醇为空白对照[7],计算清除率(%)。
清除率=(AC-AS)/AC×100%
式中AC——空白组吸光度;
AS——样品组吸光度。
以下清除率计算均用此式。
1.2.4.3 清除羟基自由基(·OH) 取10 mmol/L的FeSO4溶液1 mL,加入1 mL 10 mmol/L的水杨酸-乙醇溶液、1 mL不同浓度的藁本黄酮样品或VC溶液、1 mL 8.8 mmol/L的H2O2溶液,水浴(37 ℃,30 min),以重蒸水作参比,于510 nm测定样品吸光值,计算清除率[9]。
2 结果与讨论
2.1 藁本黄酮纯化工艺条件研究
2.1.1 上样液pH的影响 将藁本黄酮粗提液按图1条件调节为不同pH值的上样液,进行静态吸附实验,上样液浓度为2.0 mg/mL,结果见图1。

图1 上样液pH值对吸附率的影响Fig.1 Effect of pH value of loading solution on adsorption rate
由图1可知,pH值对吸附率的影响较大,pH值为4左右时,吸附率达到最大值,随着pH值的进一步增大,吸附率呈下降趋势,故选择上样液pH值为4。
2.1.2 上样液浓度的影响 将藁本黄酮粗提液按图2条件稀释为不同浓度的上样液,进行静态吸附实验,上样液pH为4,结果见图2。

图2 上样液浓度对吸附率的影响Fig.2 Effect of loading solution concentration on adsorption rate
由图2可知,在上样液浓度>2.5 mg/mL后,吸附率明显下降,故上样液浓度选择2.5 mg/mL。
2.1.3 上样液体积的影响 将浓度为2.5 mg/mL、pH 4的藁本黄酮上样液以2 mL/min 流速上样,按柱体积倍数分段收集流出液,测量流出液中黄酮浓度,结果见图3。
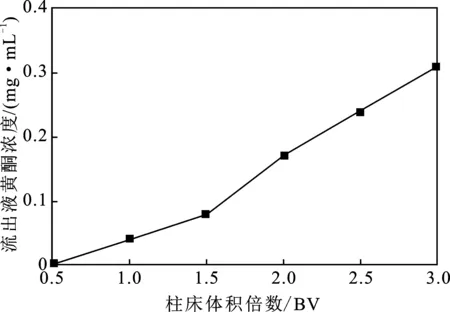
图3 上样液体积的影响Fig.3 Effect of loading solution volume
由图3可知,当上样量增加到0.5 BV 时,流出液中开始出现藁本黄酮,当上样液到2.5 BV时,测定流出液黄酮浓度为0.24 mg/mL,接近于上样液浓度的10%,此时即为曲线的泄露点,故上样液体积选择2.5 BV。
2.1.4 上样液流速的影响 分别取7组2.5 BV浓度为2.5 mg/mL、pH 4的上样液,以不同上样流速上样,进行动态吸附实验,结果见图4。
由图4可知,吸附率随上样液流速增加而减小,流速>3 mL/min后,吸附率下降明显,吸附不完全,故上样液流速选择3 mL/min。

图4 上样液流速对吸附率的影响Fig.4 Effect of loading liquid velocity on adsorption rate
2.1.5 洗脱液浓度的影响 分别以不同浓度的乙醇溶液作为洗脱液进行静态解吸实验,结果见图5。

图5 洗脱液浓度对解吸率的影响Fig.5 Effect of eluent concentration on desorption rate
由图5可知,随洗脱液浓度的增加,藁本黄酮的解吸率逐渐增大,当洗脱液的浓度为70%时,解吸率达到最大值,故洗脱液浓度选择70%。
2.1.6 洗脱液流速的影响 将 2.5 BV 浓度为 2.5 mg/mL、pH 4的上样液按3 mL/min 的流速上样,3 BV水淋洗层析柱,用70%乙醇分别按不同流速进行动态解吸实验,结果见图6。

图6 洗脱液流速对解吸率的影响Fig.6 Effect of eluent flow rate on adsorption rate
由图6可知,随洗脱液流速的增加,藁本黄酮的解吸率先略升高,当洗脱液流速为 2 mL/min 时,曲线具有最高点,继续增加洗脱液流速,解吸率下降明显,故洗脱液流速选择2 mL/min。
2.1.7 洗脱液体积的影响 将2.5 BV浓度 2.5 mg/mL、pH 4的上样液按3 mL/min 的流速上样,3 BV水淋洗层析柱,用70%乙醇以3 mL/min流速洗脱,按柱床体积对解吸液进行分段收集,测量解吸液中的黄酮浓度,结果见图7。

图7 洗脱液体积的影响Fig.7 Effect of eluent volume
由图7可知,洗脱液用量为 5 BV 时,吸附的黄酮基本被解吸完全,故洗脱液用量5 BV左右为宜。
2.1.8 纯化工艺验证 按照上述实验得到的最佳纯化工艺条件对藁本黄酮粗提液进行纯化,藁本黄酮的回收率达到81.88%,纯化后样品纯度达到71.09%,比纯化前纯度(34.76%)高出2.05倍,说明此纯化工艺效果较好。
2.2 藁本黄酮纯化前后体外抗氧化活性研究
2.2.1 对DPPH自由基清除率的测定 由图8可知,VC和粗提、纯化藁本黄酮对DPPH自由基的清除率均随样品浓度的增加呈上升趋势,清除DPPH自由基的IC50值分别为140.2,862.1,386.8 μg/mL,纯化后藁本黄酮清除DPPH自由基的能力增强,略低于VC,但明显高于粗提藁本黄酮。

图8 藁本黄酮对DPPH自由基的清除能力Fig.8 Scavenging ability of Ligusticum flavonoids on DPPH free radical

图9 藁本黄酮对超氧阴离子自由基的清除能力Fig.9 Scavenging ability of Ligusticum flavonoids on superoxide anion radical
2.2.3 对羟基自由基(·OH)清除率的测定 由图10可知,VC和粗提、纯化藁本黄酮对·OH的清除率均随样品浓度的增加呈上升趋势,清除·OH的IC50值分别为348.4,1 689.4,953.3 μg/mL,纯化后藁本黄酮清除·OH的能力增强,虽明显低于VC,但高于粗提藁本黄酮。

图10 藁本黄酮对羟基自由基的清除能力Fig.10 Scavenging ability of Ligusticum flavonoids on hydroxyl radical
3 结论
采用D-101大孔树脂对藁本黄酮粗提液进行纯化的最佳工艺为:将体积为2.5 BV、浓度2.5 mg/mL、pH 4的上样液以3 mL/min流速上样后,用体积5 BV、浓度 70%的乙醇溶液以2 mL/min流速洗脱,此条件下藁本黄酮回收率可达81.88%,样品纯度达到71.09%。
纯化前后的藁本黄酮均具有一定的体外抗氧化活性。纯化后藁本黄酮的抗氧化活性明显增强,其清除DHHP自由基、超氧阴离子自由基和羟基自由基的IC50值分别为386.8,764.0,953.3 μg/mL。
