维拉帕米对替芬泰大鼠体内药代动力学的作用
2021-08-10张爱杰杨帆龙董世奇刘鉴峰樊慧蓉
张爱杰,杨帆龙,赵 鹿,李 偲,董世奇,刘鉴峰,樊慧蓉
(1. 中国医学科学院放射医学研究所、2. 创新药物放射性药代研究重点实验室,天津 300192;3. 天津中医药大学,天津 301617)
慢性乙型肝炎(chronic hepatitis B virus,CHB)是一种由乙型肝炎病毒(hepatitis B virus,HBV)持续感染引起的肝脏慢性炎症性疾病。目前还没有治疗CHB的特效药,临床上多是联合使用核苷类药物(nucleoside analogues,NAs)、干扰素和保肝降酶药物,力求最大限度地长期抑制HBV复制[1-4]。虽然NAs药物临床应用广泛,但耐药性的发生率也较高[5]。耐药性已成为CHB治疗的挑战,急需开发新的具有抗耐药HBV的药物。
替芬泰(Y101)是一种抗HBV候选新药,根据苗药马蹄金(dichondrarepensForst.)的活性成分马蹄金素设计的苯丙酸二肽衍生物[6]。替芬泰能抑制共价闭合环状DNA的转换,从而抑制HBV复制,阻断病毒的持续存在,停药后无明显反跳,且对NAs耐药株具有较强的抑制效果[6-8]。在剂量递增临床试验中,替芬泰在一定剂量范围内安全性和耐受性良好[9]。
本研究组前期报道替芬泰在大鼠体内代谢广泛[10],M8是替芬泰的酰胺水解产物,为替芬泰的主要代谢物,M9为M8的氮氧化代谢物;另外,通过Caco-2和MDCK-MDR1细胞模型的转运研究,证明替芬泰是转运体P-糖蛋白(P-glycoprotein,P-gp)的底物[11]。然而替芬泰与其他P-gp底物或抑制剂药物合用是否改变其体内药动学特征尚未见报道。因此,本研究目的是:(1)建立测定大鼠血浆中替芬泰、M8和M9浓度的LC-MS/MS方法,并进行方法学验证;(2)研究临床常用药物维拉帕米(P-gp抑制剂)对替芬泰在大鼠体内药动学的作用,为替芬泰进一步研究提供基础数据,同时为临床合理用药提供参考。
1 材料与方法
1.1 药品和试剂Y101原料药(批号20191106,纯度99.5%)、M8(批号20191128,纯度99.0%)和M9(批号20191128,纯度99.0%)均来源于贵州省中国科学院天然产物化学重点实验室;盐酸维拉帕米(批号20181128,纯度98.0%)购自南京罗迈美生物科技有限公司;乌苯美司(批号190603,纯度98.0%)由深圳万乐药业有限公司提供;甲醇,乙腈等均为色谱纯,由Thermo Fisher公司提供;去离子水使用屈臣氏水。
1.2 实验仪器采用配有LC-30AD二元泵、CTO-30A柱温箱和SIL-30AC自动进样器的液相色谱系统(日本Shimadu公司);质谱检测器采用Sciex TRIPLE QUADTM 5500三重四级杆串联质谱(美国Applied Biosystems公司)并配备电喷雾离子源(ESI)和Analyst1.7.1数据处理软件;Sartorius SQP型分析天平(德国Sartorius公司);Legend Micro 17R台式离心机(美国Thermo Scientific公司);Auto Vap S60型样品全自动浓缩仪(美国ART公司);XYN-60LMGE型氮气发生器(上海析友分析仪器有限公司);TARGIN VX-Ⅱ型多管涡旋振荡器(北京踏锦科技有限公司)。
1.3 实验动物健康雄性SD大鼠(SPF级,合格证编号:1100111911032465),体质量(200-220) g,购自北京维通利华试验动物有限公司。实验动物使用许可证编号:SYXK(津)2018-0008。在SPF动物房对大鼠实施颈静脉插管手术,术后饲养恢复3 d,期间状态良好的大鼠用于药代动力学实验。实验前12 h禁食不禁水。
1.4 色谱与质谱条件色谱条件:液相色谱系统采用日本Shimadu公司的30A型液相,色谱柱为Infinitylab Poroshell 120 EC-C18(50 mm×2.1 mm, 2.7 μm, 美国Agilent 公司),柱温40 ℃,进样体积1 μL,流速0.3 mL·min-1,流动相A:0.05%甲酸-乙腈,流动相B:0.05%甲酸-1 mmol·L-1乙酸铵-5%乙腈水溶液,梯度洗脱程序为:0-0.2 min (85% B) →2-4 min (15% B) →4.1-5.5 min (85% B),仪器运行时间为5.5 min。
质谱条件:质谱采用美国Applied Biosystems公司的Sciex TRIPLE QUADTM 5500型三重四级杆串联质谱仪,离子源:电喷雾离子源(ESI),正离子检测;卷帘气:20 psi;喷雾电压:4 000 V;源温度:550 ℃;去簇电压:100 V;入口电压:10 V。替芬泰、M8、M9和内标乌苯美司用于定量分析的离子对和碰撞能分别为m/z490.2→339.4 (Y101),碰撞能:18 V;m/z357.2→105.0 (M8),碰撞能:37 V;m/z373.2→105.0 (M9),碰撞能:35 V;m/z309.2→120.1 (IS:乌苯美司),碰撞能:30 V。Y101、M8、M9和内标的质谱图见Fig 1。

Fig 1 Product ion mass spectra of [M+H]+ of Y101 (A),(B) , M9 (C) and bestatin (D, internal standard)
1.5 对照品溶液配制分别精确称取Y101、M8、M9对照品适量,溶解并定容配制成浓度为800 mg·L-1的Y101甲醇溶液、1 000 mg·L-1的M8、M9的60%甲醇水溶液作为储备液。准确量取储备液,用甲醇逐级稀释成系列浓度工作液,Y101系列标准工作液为5、10、50、200、500、2 000、2 500 μg·L-1,质控工作液浓度为12.5、250、1 875 μg·L-1;M8系列标准工作液为5、10、50、200、1 000、4 000、5 000 μg·L-1,质控工作液浓度为12.5、250、3 750 μg·L-1;M9系列标准工作液为1、2、10、40、200、800、1 000 μg·L-1,质控工作液浓度为2.5、50、750 μg·L-1。
精确称取乌苯美司(内标)对照品,用甲醇配制成800 mg·L-1的储备液,并用甲醇逐级依次稀释成1 mg·L-1的内标工作液,4 ℃冰箱储存备用。
1.6 样品处理方法依次向50 μL大鼠含药血浆加入150 μL甲醇和50 μL内标工作液(乌苯美司,1 mg·L-1),涡旋1 min,4 ℃ 12 000 r·min-1离心10 min;取上清液50 μL,加入含200 μL的50%甲醇-水的离心管中,涡旋1 min,取样100 μL于内插管中,4 ℃ 12 000 r·min-1离心5 min,进样1 μL进行LC-MS/MS定量分析。
1.7 方法学验证本方法选用LC-MS/MS法定量测定大鼠血浆样品中替芬泰、M8和M9的浓度,并从专属性、线性范围、灵敏度、准确度、精密度、基质效应、回收率、稳定性方面对其进行方法学验证,验证过程中的所有操作方法均按照生物样品测定的相关要求开展[12]。
1.8 大鼠体内药动学研究8只SD雄性大鼠分成两组,每组4只,对照组灌胃给予60 mg·kg-1的替芬泰,实验组先后灌胃给予25 mg·kg-1的维拉帕米和60 mg·kg-1的替芬泰、维拉帕米和替芬泰均用1%的羧甲基纤维素钠配制成混悬液。分别在给药前(0 h)和给药后0.083、0.25、0.5、1、2、3、4、6、9、12、24、30、48 h经颈静脉插管采血0.25 mL于肝素化EP管中,同时补充同体积的生理盐水。全血立即在4 ℃、1 2000 r·min-1离心5 min,分离血浆,存于-80 ℃冰箱待测。
1.9 数据处理应用Analyst 1.7.1软件对待测物替芬泰、M8、M9和内标乌苯美司进行积分,得出峰面积。待测物浓度作为横坐标,待测物峰面积与内标物峰面积比值作为纵坐标,使用加权最小二乘法(权重为1/x2)进行回归运算,求得的直线回归方程即为校正曲线。根据计算机软件默认的四舍五入规则,对于>1 000的数据保留至整数位数字,对0.1-1 000的测定与计算数据保留3位有效数字,<0.1的数值保留3位小数。使用WinNonlin 8.1软件对血药浓度数据进行处理并计算药代动力学参数,采用非房室模型统计矩法计算药代参数Cmax、Tmax、AUC0-t、AUC0-∞、T1/2、CL。参数经SPSS 17.0进行统计学分析,定量资料采用t检验分析。
2 结果
2.1 方法学验证
2.1.1专属性 待测物和内标乌苯美司的典型MRM色谱图见Fig 2,从图可知该方法对待测物替芬泰、M8、M9和内标的专属性好,大鼠血浆中的内源性物质不干扰待测物的测定,满足定量要求。

2.1.3灵敏度、准确度和精密度 结果见Tab 1,待测物替芬泰、M8、M9的日内和日间的精密度和准确度均满足生物样品测定的相关要求[12]。
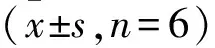
Tab 1 Precision and accuracy of Y101 and its metabolites M8,M9 in rat plasma by LC-MS/MS
2.1.4基质效应和提取回收率 待测物和内标的基质效应和提取回收率均满足定量要求,生物样品的基质效应不影响待测物的浓度测定。
2.1.5稳定性 替芬泰、M8和M9在室温放置4 h、-80 ℃室温循环冻融3次、-80 ℃长期冻存25 d、样品处理后自动进样器放置72 h的准确度均在85%-115%之间,RSD<15%,说明血浆样品中待测物在分析过程中稳定性良好。
2.2 维拉帕米对替芬泰大鼠体内药动学的作用
2.2.1P-gp抑制剂维拉帕米对替芬泰药动学的影响 大鼠单次灌胃给药后替芬泰的血浆药物浓度-时间曲线见Fig 3A,药动学参数见Tab 2。结果表明,灌胃给药后替芬泰吸收迅速(0.938±1.38) h达峰,达峰后血药浓度迅速下降,半衰期T1/2为(1.38±0.148) h。而维拉帕米作为转运体P-gp抑制剂,与替芬泰联合用药后替芬泰的AUC0-t显著升高(P<0.05),AUC0-t达到单独给药组的1.71倍(P<0.05),CL也降为单独给药组的61%,提示维拉帕米通过抑制P-gp而提高了替芬泰在肠道的吸收。
2.2.2P-gp抑制剂维拉帕米对M8药动学的影响 大鼠单次灌胃给药后M8的血浆药物浓度-时间曲线见Fig 3B,药动学参数见Tab 2。结果表明,M8体内达峰较晚,Cmax和AUC0-t显著高于替芬泰,且AUC0-t为原型药物替芬泰的5倍,提示M8是替芬泰灌胃给药后血浆中主要的代谢产物。合用P-gp抑制剂维拉帕米对M8的血浆浓度影响较小,其药动学参数差异无统计学意义(P>0.05)。
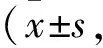
Tab 2 The pharmacokinetic parameters of Y101 and its metabolites (M8/M9) after single intragastric administration of Y101 (60 mg·kg-1) and Y101+verapamil (25 mg·kg-1) in rats n=4)
2.2.3P-gp抑制剂维拉帕米对M9药动学特征的影响 大鼠单次灌胃给药后M9的血浆药物浓度-时间曲线见Fig 3C,药动学参数见Tab 2。结果表明,M9体内达峰较晚,Cmax和AUC0-t明显低于替芬泰和M8,且AUC0-t为原型药物替芬泰的1/5倍。合用P-gp抑制剂维拉帕米对M9的药动学特征有一定影响,两药合用组AUC0-t值是单独给药组的1.58倍(P<0.05),CL降为单独给药组的62%。

Fig 2 Typical MRM chromatograms of Y101, M8, M9 and bestatin (internal standard) in rat plasma

Fig 3 Mean plasma concentration-time profile of Y101 and its metabolites (M8/M9) after single intragastric administration of Y101 (60 mg·kg-1) and Y101+verapamil (25 mg·kg-1) in n=4)
3 讨论
替芬泰作为一个抗HBV候选新药,有着很大的临床应用潜力。然而对于替芬泰的系统深入研究仍然不足,例如目前还没有同时测定大鼠血浆中替芬泰及其代谢产物的LC-MS/MS方法学相关报道,而且有关替芬泰体内药物相互作用研究较为欠缺。有研究者建立了测定大鼠血浆中替芬泰浓度的LC-MS/MS方法,该方法没有同时检测血浆中主要代谢物M8和M9[13]。因此,本研究建立一个快速、灵敏、可靠的LC-MS/MS定量方法,可以同时测定大鼠血浆中替芬泰、M8和M9的浓度,并将该方法应用于维拉帕米对替芬泰大鼠体内药动学的作用研究,为替芬泰的深入研究提供方法上的支持和实验依据。
替芬泰是转运体P-gp的底物,但在体内合用其它P-gp抑制剂或底物药物是否改变替芬泰的药动学特征未见报道。因此,我们设计大鼠体内单次灌胃给药的药动学实验,考察替芬泰合用P-gp抑制剂维拉帕米后,大鼠体内替芬泰及其代谢物的药动学变化,分析P-gp抑制剂维拉帕米对替芬泰吸收影响的可能机制。实验结果表明,与单独给药组比较,合用维拉帕米可以明显提高替芬泰的AUC0-t值(Tab 2,P<0.05),提示可能与维拉帕米竞争性抑制肠道P-gp[14]减少替芬泰外排有关;同时清除率明显降低(Tab 2,P<0.05),T1/2无明显改变,提示清除率改变与替芬泰暴露量增加有关,而替芬泰体内消除没有明显改变。文献报道维拉帕米还可以抑制有机阳离子转运体1、多药耐药蛋白3和多药耐药相关蛋白1介导的转运[15-17],这些转运体是否与替芬泰暴露量改变相关需要进一步深入研究。
维拉帕米对代谢物M9作用结果显示,AUC0-t和清除率的变化趋势与替芬泰一致,提示替芬泰暴露量增加可能也相应提高了代谢转化为M9的比例。然而与M9相比,M8的AUC0-t、清除率等药动学参数没有变化,提示P-gp抑制剂维拉帕米虽增加替芬泰体内暴露,但并不相应提高M8的代谢转化,因此推测维拉帕米可能抑制替芬泰转化为M8的代谢酶。M8为替芬泰的酰胺水解产物,该过程可能是水解酶介导的[17]。以此为切入点,我们前期考察了氨肽酶抑制剂乌苯美司和肾脱氢肽酶抑制剂西司他丁对替芬泰和M8转化的影响,结果提示氨肽酶和肾脱氢肽酶与替芬泰生物转化无关。目前,本课题组正在开展替芬泰代谢转化为M8的代谢酶研究。因此,临床上替芬泰联合使用转运体P-gp底物或抑制剂药物时,注意是否造成异常的药物浓度升高,需要根据具体情况调整替芬泰的给药剂量。
综上,本研究建立了一种快速、灵敏、可靠的LC-MS/MS定量方法,并进行了方法学验证,用以测定大鼠血浆中替芬泰、M8和M9的浓度。我们应用建立的LC-MS/MS方法研究转运体P-gp介导的替芬泰和其他药物发生的药物相互作用,首次阐明替芬泰和P-gp抑制剂维拉帕米合用对替芬泰在大鼠体内药动学的影响,为后期深入研究基于转运体的药动学相互作用和药物开发提供了参考依据。
