下调LINC00667靶向调控miR-34a抑制口腔鳞癌CAL-27细胞增殖并诱导细胞凋亡的体外研究
2021-08-10彭国栋裴磊
彭国栋 裴磊
口腔癌是头颈部恶性肿瘤中的一大类,口腔癌中有约90%为口腔鳞癌,其发生涉及烟草、酒精刺激、病毒感染、免疫异常等多个因素[1]。口腔鳞癌的发生是一个多步骤、多基因共同作用的结果,其具体的发生机制还不明确[2]。积极寻找有效的分子标记物对于口腔鳞癌的治疗意义重大[3]。LncRNA是长度大于200 bp的非编码RNA,其可以在转录后、翻译水平调控基因的表达,参与多个细胞生理和病理过程[4]。很多研究表明,LncRNA与人类多种疾病有关,如动脉粥样硬化、哮喘、脑出血等,LncRNA可能是疾病治疗的分子靶点[5-7]。LINC00667是近些年来发现的具有调控肿瘤进展作用的调节因子,其在胶质瘤中发挥促进作用[8]。LINC00667在结直肠癌中表达上调,下调LINC00667抑制结直肠癌细胞增殖并诱导细胞凋亡[9]。LncRNA作用机制与miRNA有关,其可以通过调控miRNA的表达参与多个生理过程[10]。前期的预实验发现LINC00667和miR-34a存在互补结合位点。miR-34a在口腔鳞癌中发挥抑制作用,其能够下调肿瘤细胞的增殖能力,诱导细胞凋亡[11]。本实验探讨下调LINC00667靶向调控miR-34a对口腔鳞癌细胞增殖、凋亡的影响,为靶向分子治疗口腔鳞癌提供参考。
1 材料与方法
1.1 主要材料和仪器
cyclin D1抗体、p27抗体(碧云天生物技术有限公司);口腔鳞癌细胞CAL-27(广州赛库生物技术有限公司);C-Caspase-3抗体(北京百奥莱博科技有限公司);mimics control、miR-34a mimics、miR-34a inhibitor、inhibitor control(上海吉玛制药技术有限公司);口腔鳞癌细胞SCC15(南京科佰生物科技有限公司);口腔鳞癌细胞OSC-4(上海弘顺生物科技有限公司);shRNA control、LINC00667 shRNA(上海基尔顿生物有限公司);正常口腔上皮细胞HOK(上海榕柏生物技术有限公司); Light Cycler 480荧光定量PCR仪(Roche公司,美国);Multiskan FC酶标仪(Thermo公司,美国);FACS caliber流式细胞仪(BD公司,美国)。
1.2 口腔鳞癌细胞中LINC00667表达的检测
收集正常口腔上皮细胞HOK和口腔鳞癌细胞CAL-27、SCC15、OSC-4,按试剂盒说明,Realtime PCR方法检测各细胞系中LINC00667的表达,内参设置为GAPDH,按照2-△△Ct法计算LINC00667表达水平。
1.3 CAL-27细胞转染及分组
将CAL-27细胞分为Control、sh-NC、sh-LINC-00667组,sh-NC、sh-LINC00667组,按照转染试剂说明分别转染shRNA control、LINC00667 shRNA,Control组为没有进行细胞转染的口腔鳞癌细胞CAL-27。收集转染48 h以后的各组细胞,利用Realtime PCR方法检测细胞中LINC00667表达水平。
1.3.1 CAL-27细胞增殖检测 在96 孔板中接种口腔鳞癌CAL-27细胞,按照Control、sh-NC、sh-LINC-00667组分组方法处理培养48 h。常规MTT法检测,以A值表示细胞增殖活性。
1.3.2 CAL-27细胞周期检测 收集各组细胞,常规PI染色,用流式细胞仪检测细胞周期变化。
1.3.3 CAL-27细胞凋亡检测 收集各组细胞Annexin V-FITC方法染色,流式细胞仪检测细胞凋亡。
1.3.4 CAL-27细胞中cyclin D1、p27、C-Caspase-3蛋白表达检测 收集各组细胞,Western blot方法检测3 种目标蛋白表达。GAPDH作为参照,分析目的蛋白的相对表达水平。cyclin D1、p27一抗按照1∶1 000稀释,C-Caspase-3按照1∶600稀释。
1.4 靶基因预测及鉴定
利用生物信息学软件Starbase分析LINC00667的靶基因,以荧光素酶报告系统鉴定二者的靶向关系。分别把WT、MUT与mimics control、miR-34a mimics共转染到CAL-27细胞中,培养48 h后,利用荧光素酶活性测定试剂盒分析细胞荧光素酶活性的变化。WT为含有LINC00667结合位点的野生型荧光素酶报告载体,MUT为含有突变之后LINC00667结合位点的突变型荧光素酶报告载体。收集转染48 h以后的Control、sh-NC、sh-LINC00667组细胞,利用Realtime PCR方法检测细胞中miR-34a表达水平,内参为U6。
1.5 miR-34a inhibitor对下调LINC00667影响口腔鳞癌细胞作用检测
CAL-27细胞中共转染miR-34a inhibitor、LINC00667 shRNA和inhibitor control、LINC00667 shRNA,命名为sh-LINC00667+Anti-miR-34a和sh-LINC-00667+Anti-miR-NC组,细胞培养48 h后,利用MTT实验检测细胞增殖,PI染色法检测细胞周期,Annexin V-FITC方法检测细胞凋亡, Western blot方法检测细胞中cyclin D1、p27、C-Caspase-3蛋白表达,Realtime PCR方法检测miR-34a表达。
1.6 统计学分析
2 结 果
2.1 口腔鳞癌细胞中LINC00667相对高表达
口腔鳞癌细胞CAL-27、SCC15、OSC-4中LINC00667表达水平均高于正常口腔上皮细胞HOK(P<0.05),OSC-4、SCC15中LINC00667表达水平均低于CAL-27(P<0.05)(表 1)。口腔鳞癌细胞中LINC00667相对高表达,选取表达水平最高的CAL-27用于后续实验。

表 1 各细胞系中LINC00667表达水平
2.2 下调LINC00667对口腔鳞癌细胞增殖、周期和凋亡影响
与Control、sh-NC组比较,sh-LINC00667组CAL-27细胞中LINC00667水平降低,细胞增殖活性下降,细胞G0/G1期比例升高,细胞凋亡率升高,细胞中cyclin D1蛋白表达减少,p27、C-Caspase-3蛋白表达水平升高(P<0.05)(图 1,表 2)。下调LINC00667抑制口腔鳞癌细胞增殖并阻滞细胞周期,诱导细胞凋亡。
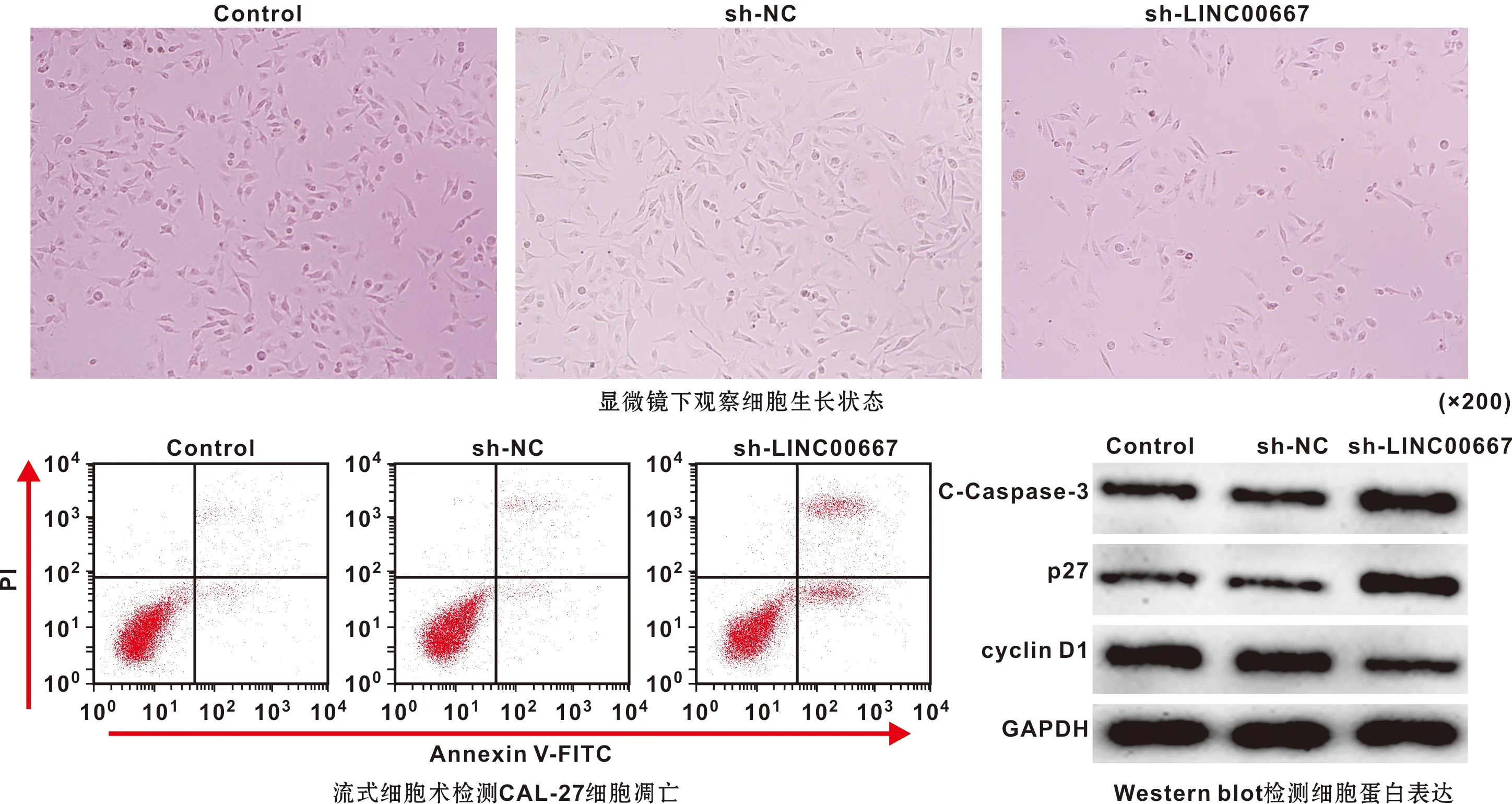
图 1 LINC00667 shRNA对CAL-27细胞凋亡和细胞中cyclin D1、p27、C-Caspase-3蛋白表达影响

表 2 LINC00667 shRNA转染对CAL-27细胞相关生物学特性的影响
2.3 LINC00667和miR-34a为靶向关系
生物信息学软件预测LINC00667和miR-34a存在互补结合位点,并且miR-34a mimics和WT共转染之后的细胞荧光素酶活性降低(图 2,表 3)。LINC00667和miR-34a为靶向关系。

图 2 LINC00667和miR-34a结合位点
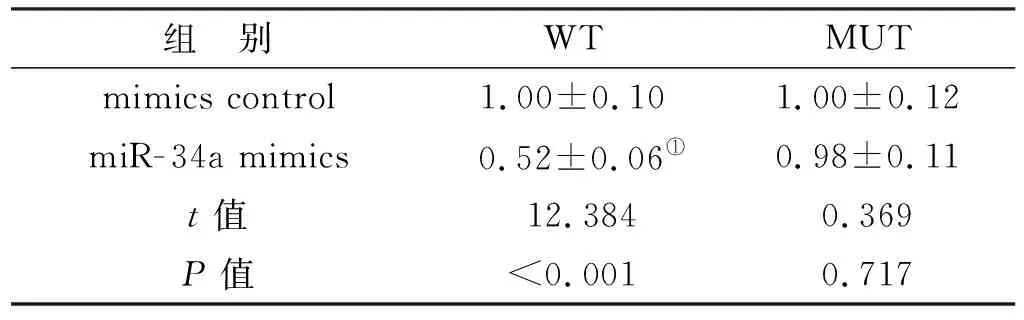
表 3 荧光素酶活性
2.4 下调LINC00667促进miR-34a表达
与Control、sh-NC组比较,sh-LINC00667组CAL-27中miR-34a水平升高(P<0.05)(表 4)。下调LINC00667促进miR-34a表达。

表 4 下调LINC00667后CAL-27细胞中miR-34a水平
2.5 miR-34a inhibitor对下调LINC00667影响口腔鳞癌细胞CAL-27增殖、周期和凋亡的作用
与sh-LINC00667+Anti-miR-NC组比较,sh-LINC00667+Anti-miR-34a组口腔鳞癌细胞CAL-27中miR-34a水平降低,细胞增殖活性升高,细胞G0/G1期比例降低,细胞凋亡率降低,细胞中p27、C-Caspase-3蛋白表达水平降低,cyclin D1蛋白表达水平升高(P<0.05)(图 3,表 5)。
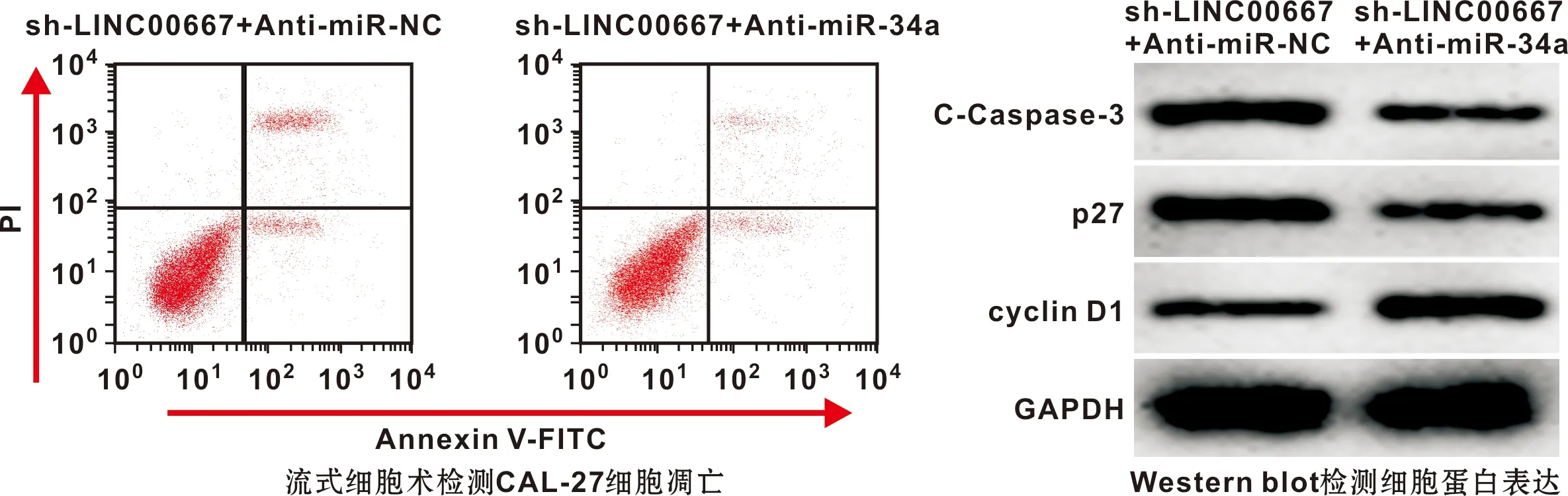
图 3 miR-34a inhibitor对下调LINC00667影响CAL-27细胞凋亡和细胞中cyclin D1、p27、C-Caspase-3蛋白表达影响
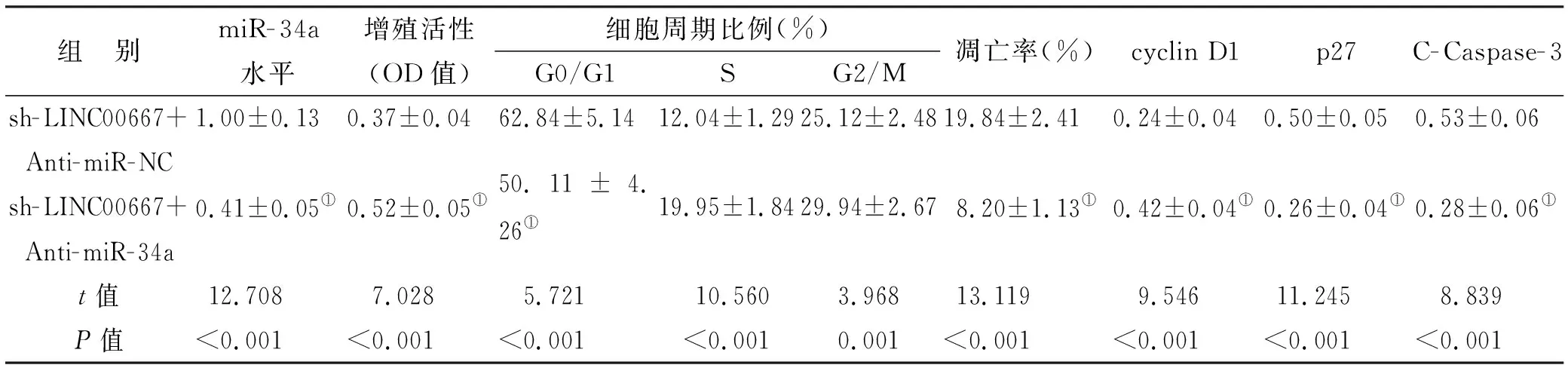
表 5 miR-34a inhibitor和LINC00667 shRNA转染对CAL-27细胞相关生物学特性的影响
3 讨 论
LncRNA具有十分强大的调控潜力,LncRNA能够从DNA甲基化、基因组印记、mRNA降解、蛋白质定位等多个层面发挥作用,其与神经退行性疾病、心血管系统疾病、肿瘤等发生有关,参与胚胎发育、能量代谢、细胞分化,LncRNA目前已经成为研究的重点领域[12]。有研究发现,LINC00667与肿瘤进程有关,LINC00667在非小细胞肺癌中表达上调,LINC00667促进肺癌细胞恶性增殖[13]。下调LINC00667诱导结直肠癌细胞凋亡,降低结直肠癌细胞增殖速度[9]。本实验发现,LINC00667在口腔鳞癌细胞中过度表达,并且下调LINC00667抑制口腔鳞癌细胞增殖能力,这说明LINC00667在口腔鳞癌中可能发挥类似癌基因的作用,这与以前的研究结果一致,均提示LINC00667可能具有促进肿瘤的作用。
细胞周期有序进展是细胞增殖的基础,而细胞增殖和细胞凋亡动态平衡是机体稳态维持的关键[14]。细胞周期是指从上一次细胞分裂结束到本次细胞分裂结束的整个过程,其包括分裂期和分裂间期,细胞周期是一个复杂过程,受到多个基因的共同调控作用[15]。G0/G1向S期进展是细胞周期调控中的关键点之一,cyclin D1可以促进细胞进入S期,cyclin D1也被认为是细胞周期进程加快的标志[16]。另外,cyclin D1也是目前发现的在肿瘤中表达上调的促肿瘤因子[17]。p27是细胞周期的抑制因子,其表达水平升高,细胞周期被阻滞[18]。Caspase蛋白家族含有多个蛋白成员,这些蛋白成员以没有活性的形式在细胞内存在,只有被活化后才可以发挥促进细胞凋亡的功能[19]。Caspase-3是Caspase蛋白家族中的凋亡执行因子,其在凋亡级联反应中处于下游,Caspase-3被激活后可以不可逆的诱导细胞凋亡[20]。本实验表明,下调LINC00667后的口腔鳞癌细胞G0/G1期比例升高,cyclin D1蛋白表达减少,p27、C-Caspase-3蛋白表达水平升高,细胞凋亡率升高,这提示下调LINC00667阻滞细胞周期并诱导细胞凋亡,这进一步证明了LINC00667可能是一种癌基因。
目前对LncRNA的作用机制的研究较多,但尚未完全阐明,目前研究较多的是LncRNA通过与miRNA结合影响miRNA的表达进而调控细胞生理功能,并且LncRNA和miRNA通过碱基互补的方式结合,因此同一个LncRNA可以同时调控多个miRNA,而同一个miRNA能够同时被多个LncRNA调控[21]。本实验发现,下调LINC00667能够靶向促进miR-34a的表达。miR-34a位于1p36.22染色体上,其在大多数器官中均有表达。有研究已经证明,miR-34a在宫颈癌、乳腺癌、口腔鳞癌等多个肿瘤组织中表达下调,miR-34a在肿瘤细胞生长中发挥抑制作用[11,22-23]。本实验显示,下调miR-34a具有逆转下调LINC00667对口腔鳞癌细胞增殖、周期和凋亡作用的功效,这说明下调LINC00667通过靶向miR-34a发挥作用。
综上,LINC00667可能是一个口腔鳞癌促进因子,下调其表达体外抑制口腔鳞癌细胞增殖,阻滞细胞周期,诱导细胞凋亡,机制与靶向miR-34a有关。目前尚未研究LINC00667调控miR-34a的下游靶向机制,尚未在多株口腔鳞癌以及体内验证LINC00667的作用,在后续实验中会对这些内容进行探讨。本次实验为靶向分子治疗口腔鳞癌提供了思路,为研究口腔鳞癌的分子发生机制提供了部分资料。
