HIF-1α RNAi对口腔鳞癌生长以及血管生成影响的研究
2021-08-10岑兴廖楚航费伟周昊
岑兴 廖楚航 费伟 周昊
实体肿瘤生长的微环境通常是乏氧环境,这有利于细胞因子的释放促进血管生成从而导致肿瘤的进程加快[1]。乏氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是乏氧环境中重要的信号传导分子,它可以调控基因的表达产生一系列生物学效应促进肿瘤发展,包括血管生成、细胞增殖、凋亡、糖酵解和pH调节[2]。之前的研究发现,在多种肿瘤的生长和转移中发现HIF-1α的异常表达,包括口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)[3-4]。
在本研究中,通过实时定量PCR(RT-PCR)、Western blot检测了OSCC临床标本中HIF-1α的mRNA和蛋白表达情况,使用RNA干扰(RNA interference,RNAi)下调HIF-1α在OSCC动物模型中的表达,观察肿瘤生长情况,检测HIF-1α和VEGF的表达水平,同时检测了肿瘤细胞的凋亡情况和微血管密度(microvascular density,MVD)。初步探寻HIF-1α在OSCC发生和发展中的作用。
1 材料与方法
1.1 肿瘤标本的检测
实验组标本来自四川省人民医院颌面外科2019 年01 月~2019 年06 月手术切除的新鲜肿瘤组织(12 例),年龄60~82 岁,所有患者病理证实均为OSCC;对照组为术中冰冻病理结果证实无肿瘤细胞浸润的正常组织。所有患者均签署知情同意书,本研究获得四川省人民医院伦理委员会的批准。
1.2 RT-PCR 检测
取保存的肿瘤组织样本12 例,分别磨碎后加入Trizol(50 mg 组织加入1 ml)抽提RNA,并用RevertAidTM试剂盒(Thermo,USA)逆转录成cDNA;取逆转录产物进行实时荧光定量RT-PCR(ABI Prism 7700,USA)。
1.3 Western blot检测
使用蛋白提取试剂盒(北京索莱宝)提取肿瘤组织蛋白,BCA蛋白检测试剂盒(Pierce,USA)测定蛋白浓度。蛋白变性后,冷却上样,凝胶电泳半干法转入PVDF膜后置于封闭缓冲液(摇床振荡1 h),分别加入目标基因一抗(1∶10 000,cell signaling technology,USA) ,4 ℃过夜,TBS/T洗涤后孵育二抗,ECL显影条带并进行灰度分析(Bio-Rad,USA) 。
1.4 IHC检测
免疫组化染色过程按试剂盒所附说明进行,石蜡标本4 μm连续切片, 常规脱蜡;抗原修复; 加入HIF-1α抗体(北京中杉金桥)后,孵育1 h;加入二抗,孵育20 min;加入DAB溶液显色,蒸馏水冲洗、复染、脱水、透明封片,电子显微镜下观察采图。
1.5 HIF-1α特异siRNA慢病毒载体的构建
表达HIF-1α特异siRNA慢病毒载体由上海生工生物工程技术服务有限公司合成包装。
1.6 肿瘤模型建立以及RNAi体内实验
口腔鳞状细胞癌细胞株 Tca8113 购自四川大学口腔疾病研究国家重点实验室; 基本实验步骤如下; 细胞株从液氮冰存中复苏,培养于RPMI 培养液(15%灭活小牛血清,青霉素200 U/ml,链霉素200 U/ml),37 ℃,5%CO2培养箱。收集对数生长期细胞,制备浓度为 1 ×107/ml 细胞悬液,皮下接种于30 只裸鼠背部,每个部位接种约0.1 ml。待肿瘤体积达到100 mm3,分别瘤内注射相同体积(0.1 ml)的生理盐水(Mock组),表达非特异性siRNA的质粒(pUc组)和表达HIF-1α特异siRNA的质粒(pU组),每组10 只。每5天注射1 次,共注射4 次。从第5天开始,每5天用游标卡尺测量肿瘤体积,利用公式肿瘤体积=长径×(短径)2×1/2计算。最后1 次测量肿瘤体积后采用颈椎脱位法处死裸鼠,完整分离组织;一半组织用4%多聚甲醛固定,石蜡包埋;另一半立即存放于液氮罐中,后转存于-70 ℃冰箱,备后续检测。
1.7 HIF-1α表达检测
利用RT-PCR、Western blot和IHC检测裸鼠瘤体内HIF-1α的表达变化,方法同1.2-1.4。
1.8 肿瘤细胞凋亡的测定
按照TUNEL试剂(碧云天,上海元业兴生物科技有限公司)盒说明,对肿瘤组织中凋亡细胞进行测定。
1.9 VEGF的检测和微血管计数
利用Western blot检测VEGF的表达变化情况。CD34染色后,选择2 个血管化程度较高的区域进行微血管计数,采用低光度数(×10物镜)进行计数。最终的MVD值为每个高血管化区域(总面积:2.65 mm2)的3 个评价高倍视野(×25物镜)的平均值。具有清晰管腔或明确线形血管形状的血管被考虑用于计数。
2 结 果
2.1 肿瘤标本中HIF-1α的表达
结果显示在OSCC患者肿瘤标本中HIF-1α的mRNA和蛋白的表达明显高于对照组(P<0.05)(图 1)。
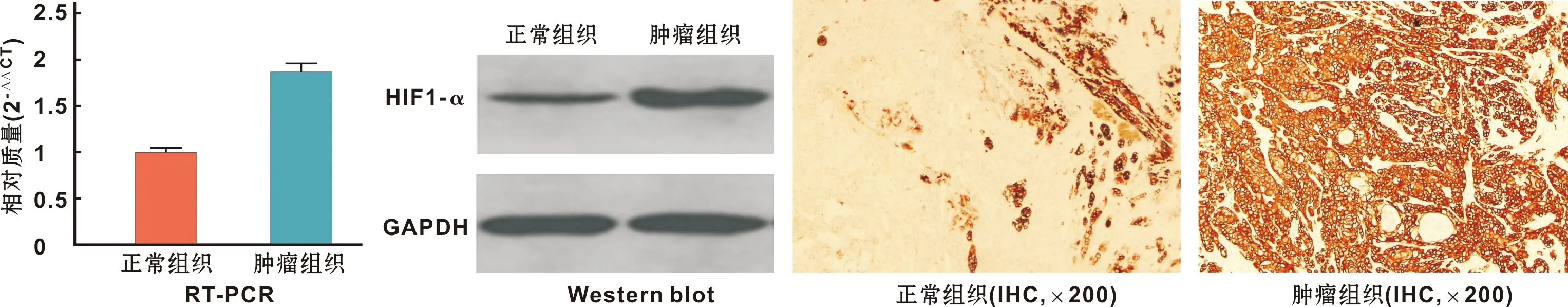
图 1 肿瘤组织和正常组织中HIF-1α的mRNA和蛋白的表达
2.2 HIF-1α抑制效果的检测
PCR和Western blot结果显示在注射了表达HIF-1α特异siRNA的移植瘤模型中,HIF-1α的mRNA和蛋白的表达明显比对照组降低(P<0.05)(图 2A)。
2.3 肿瘤生长的变化
肿瘤大体图片示pU组瘤体的组明显低于大小Mock组和pUc组(图2 A);生长曲线结果显示pU组的生长趋势明显慢于其他组(P<0.05)(图 2B)。

图 2 荷瘤裸鼠肿瘤增长
2.4 HIF-1α的抑制效果
PCR、Western blot和IHC结果均显示在pU组中HIF-1α的表达水平相对于Mock组和pUc组明显降低(P<0.05)(图 3)。

图 3 3 组样本中HIF-1α的mRNA、蛋白表达
2.5 肿瘤组织凋亡的变化
TUNEL结果显示在pU组中,凋亡细胞的数量明显要高于其他组(P<0.05)(图 4)。

图 4 3组肿瘤组织样本中细胞凋亡(TUNEL)
2.6 VEGF表达和微血管密度变化
Western blot结果显示在pU组中VEGF的表达显著低于对照组(图 5A);同时,微血管密度(MVD)统计结果显示,pU组中的MVD明显低于对照组(P<0.05)(图 5B)。
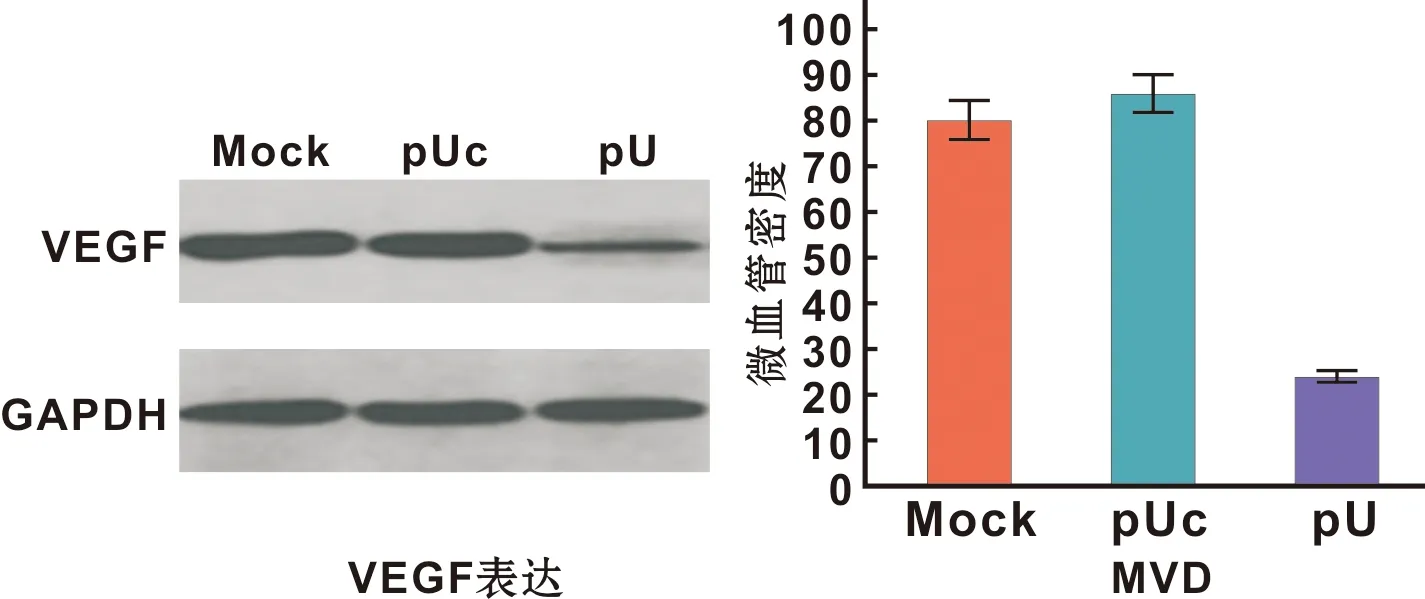
图 5 肿瘤组织中VEGF的表达及MVD
3 讨 论
癌症目前被认为是由于基因的突变和异常表达导致的,这些基因的改变赋予细胞许多特定功能,如细胞增殖、生存、侵袭和转移。因此,基因靶向治疗可能成为控制癌症进展的一种有效的方法。
实体肿瘤的生长很大程度上依赖于血管生成,肿瘤组织表现出比健康组织更低的氧合水平[1]。缺氧触发了血管生成机制,HIF-1在这个过程中起了重要的作用,HIF-1是一种由HIF-1α和HIF-1β亚基组成的异源二聚体转录因子,当肿瘤细胞暴露在缺氧中时,它被稳定和激活,促进相关基因的转录,这些基因涉及肿瘤生物学的许多方面,包括血管生成、无氧能量代谢、细胞增殖、细胞侵袭和凋亡[5-6]。同时,多种肿瘤抑制蛋白和信号转导途径表达失调的结果也使HIF-1α转录活性增加。已在多种人类肿瘤中检测到HIF-1α浓度升高,其表达水平与恶性程度和生存预后相关[3-4]。实验结果也发现在OSCC患者的肿瘤组织中HIF-1α的表达明显高于正常组织。
以往的研究揭示了HIF-1α参与肿瘤发展过程的生物学机制:首先,p53或VHL的丢失通过干扰其泛素化和蛋白酶体降解来增加HIF-1α蛋白的表达[7];随之,HIF-1α进入细胞核并与存在于促进对缺氧的生理反应的各种基因中的HRE结合,包括上调VEGF,以及糖酵解酶和葡萄糖转运蛋白[8],这些基因的上调通过增加肿瘤细胞中葡萄糖的供应和代谢来促进肿瘤的生长[9],而VEGF由于其血管生成特性发挥了核心作用。Miele等[10]发现p42/p44MAPK通路在胰岛素样生长因子-1诱导的HIF-1α活化和VEGF中起重要作用。Lauhner等[11]的研究报道了HER2信号通过HIF-1a诱导VEGF基因的转录激活,这种激活依赖于PI3K和AKT的活性。在乏氧条件下,髁突软骨细胞中HIF-1α和VEGF的表达成正相关[12];另外,在人类导管原位癌和浸润性乳腺癌中HIF-1α过表达与HER2、VEGF表达及MVD显著相关[13],HIF-1α功能丧失可抑制肿瘤血管生成,而HIF-1α功能增强可促进肿瘤血管生成[14]。与此相一致,研究结果表明,在体内外RNAi下调HIF-1α的表达时,VEGF的表达明显受到抑制,并且在口腔鳞癌移植瘤中也同时发生了显著的MVD抑制。因此,可以推测针对HIF-1α的RNAi可能通过下调血管生成因子(如VEGF)来阻止口腔肿瘤血管生成,从而阻止肿瘤的进程。
另一方面HIF-1α在癌症的发展过程中还具有促进增殖和抗凋亡的作用。HIF-1α被证明在低氧诱导的胰腺癌细胞凋亡方面具有保护作用[15]。Yoshida等[16]发现HIF-1α可防止垂体腺瘤HP75细胞缺氧诱导的凋亡。Mizuno等[17]报道了RNAi介导的HIF-1α下调显著抑制了肝胆和胰腺癌细胞的生长。另外,HIF-1α的一些靶基因也参与增殖因子和抗凋亡因子的形成,如VEGF、胰岛素样生长因子-2、血小板衍生生长因子和转化生长因子-β,这些因子与其受体结合激活信号传递[18]。IAP-2是一种抗凋亡蛋白,也被认为是HIF-1α介导的候选因子[19]。实验结果也表明,在HIF-1α被抑制之后,肿瘤在体内生长也受到抑制,凋亡细胞明显增多,HIF-1α可能在刺激癌细胞增殖和抑制凋亡方面发挥关键作用。
综上所述,RNAi下调HIF-1α的表达抑制了口腔鳞癌进展的许多关键步骤。为临床上采用靶向HIF-1α技术治疗OSCC,特别是防治癌细胞存活和血管生成方面提供了重要的理论依据和实验基础。
