前列腺癌患者血清IL-17和IL-35水平表达与临床病理特征以及预后的关系研究
2021-08-10文礼红余文洪
何 跃,梁 晶,文礼红,刘 宏,余文洪,孙 祯
(1.重庆北部宽仁医院泌尿疾病科,重庆 401120;2.解放军联勤保障部队第九四零医院泌尿外科,兰州 730000)
前列腺癌是发生于前列腺上皮细胞的恶性肿瘤,每年全球约160 万新发病例,36.6 万人死亡[1]。我国前列腺癌发病率呈上升趋势,好发于65~79 岁老年男性[2]。虽然局限性前列腺癌有较高的长期生存率,但转移性前列腺癌即使经过强化的多模式治疗,仍然存在较高复发和死亡风险。慢性炎症反应与前列腺癌的启动和进展密切相关,炎性细胞聚集,炎性因子合成和释放形成肿瘤相关炎性反应微环境,影响正常免疫功能和组织细胞增殖分化,导致恶变[3]。白细胞介素-17(IL-17)是一种功能广泛的促炎因子,在宿主防御、组织修复、炎性疾病和癌症进展中发挥重要作用,已被证实参与宫颈癌、食道癌、胃癌、肝癌和结直肠癌等多种恶性肿瘤发展[4]。白细胞介素-35(IL-35)是一种新发现的免疫抑制细胞因子,属于白介素-12 细胞因子家族,现有研究发现IL-35 能促进细胞增殖和肿瘤血管生成,与肿瘤发生进展密切相关[5]。本研究拟探讨IL-17,IL-35 与前列腺癌临床特征和预后的关系,以期为临床治疗、病情分析提供参考。
1 材料与方法
1.1 研究对象 选择2016年3月~2017年6月解放军联勤保障部队第九四零医院泌尿科收治的86例前列腺癌患者(前列腺癌组),年龄58~75 岁,平均66.52±6.32 岁,病理类型均为腺泡腺癌;分化程度:中低分化47 例,高度分化39 例;肿瘤分期:pT1-2 44 例,pT3a 42 例;组织学分级:Gleason 1~2 级39 例,Gleason 3~5 级47 例 ;淋巴结转移15 例,术前血清前列腺特异抗原(PSA)≥10 ng/ml 53 例,<10ng/ml 33 例。纳入标准:①行前列腺癌切除手术,术后组织病理学证实为前列腺癌;②未发生远处转移;③临床资料和病理结果完整。排除标准:①术前接受新辅助放化疗者;②并发其它部位恶性肿瘤;③肿瘤扩散至盆腔或远处器官,恶病质不耐受手术者,拒绝手术治疗者;④术后预期寿命小于10年者,随访失联。另选择同期我院收治的前列腺良性增生患者共60 例为对照组,均经前列腺穿刺活检证实,年龄52~71 岁,平均龄年65.77±6.01 岁。本研究经单位批准,符合《世界医学协会赫尔辛基宣言》相关要求。前列腺癌患者术后保持电话随访,随访至2020年6月,定期门诊复查PSA,血清 PSA 水平连续两次 >0.2ng/ml 定义为生化复发[6]。生化复发时间定义为确诊至生化复发时间,总生存时间定义为确诊至死亡或随访截止时间。
1.2 仪器与试剂 FLUOstar Omega 全自动多功能酶标仪购自德国BMG LABTECH 公司,IL-17,IL-35 试剂盒购自上海酶联生物科技公司。
1.3 方法 所有受试者术前采集静脉血3ml 注入干燥试管,待血液自然凝固后取上清液低温离心(4℃,2 000r/min,15cm)20min,取血清上机检测,采用酶联免疫吸附试验检测IL-17,IL-35 水平。
1.4 统计学分析 SPSS 25.00 进行数据分析,计量资料以均数±标准差(±s)表示,采用独立样本t检验或单因素方差分析。Kaplan-Meier 绘制生存曲线,分析不同IL-17,IL-35 水平下前列腺癌患者生存率差异,Log-Rank 检验生存率的差异,Cox风险比例回归分析影响前列腺癌患者预后的因素。以P<0.05 为差异具有统计学意义。
2 结果
2.1 前列腺癌组、对照组血清IL-17,IL-35 水平比较 两组年龄比较差异无统计学意义(t=0.720,P=0.473)。前列腺癌组血清IL-17,IL-35 水平分别为65.23±14.46pg/ml,132.15±23.65pg/ml,高于对照组的25.12±7.49pg/ml,61.42±10.58pg/ml,差异具有非常显著统计学意义(t=19.707,21.684,均P<0.001)。
2.2 不同临床特征前列腺癌患者血清IL-17,IL-35水平比较 见表1。肿瘤分期pT3a,组织学分级Gleason 3-5 级,淋巴结转移,术前PSA ≥10ng/ml患者血清IL-17,IL-35 水平高于肿瘤分期pT1-2,组织学分级Gleason1-2 级,未发生淋巴结转移,术前PSA <10 ng/ml 患者,差异具有非常显著统计学意义(P<0.001)。不同年龄、分化程度之间血清IL-17,IL-35 水平差异无统计学意义(P>0.05)。
表1 不同临床特征患者血清IL-17,IL-35 水平差异(n=86,(±s)

表1 不同临床特征患者血清IL-17,IL-35 水平差异(n=86,(±s)
临床特征nIL-17(pg/ml)t 值P 值IL-35(pg/ml)t 值P 值年龄(岁) ≥60 岁5565.74±13.54 0.4680.641 132.69±22.15 0.3000.765<60 岁3164.33±13.15131.19±22.52分化程度 中低分化4765.87±12.98 0.5060.614 132.46±22.58 0.1390.890高度分化3964.46±12.74131.78±22.61肿瘤分期 pT1-24457.19±4.59 18.465<0.001 114.79±9.56 21.474<0.001 pT3a4273.65±3.59150.34±4.98组织学分级 Gleason 1-2 级3954.65±3.57 24.656<0.001 109.45±1.83 57.937<0.001 Gleason 3-5 级4774.01±3.67150.97±4.15淋巴结转移 是1575.12±3.78 10.057<0.001 149.47±4.62 11.433<0.001否7163.14±6.59128.49±10.65术前PSA(ng/ml) ≥10<10 5370.65±5.09 13.086<0.001 142.57±7.49 14.650<0.001 3356.53±4.89115.41±9.35
2.3 不同血清IL-17,IL-35 水平前列腺癌患者生存率差异 随访时间36~51 个月,中位随访24 个月,86 例前列腺癌患者生化复发23 例,死亡12 例。Kaplan-Meier 生存曲线分析显示,高血清IL-17水平组无生化复发生存率,总生存率低于低血清IL-17 水平组(Log-Rankχ2=7.031,4.701,P=0.008,0.030),高血清IL-35 水平组低于低血清IL-35 水平组(Log-Rankχ2=7.832, 5.483,P=0.005, 0.019),见图1。
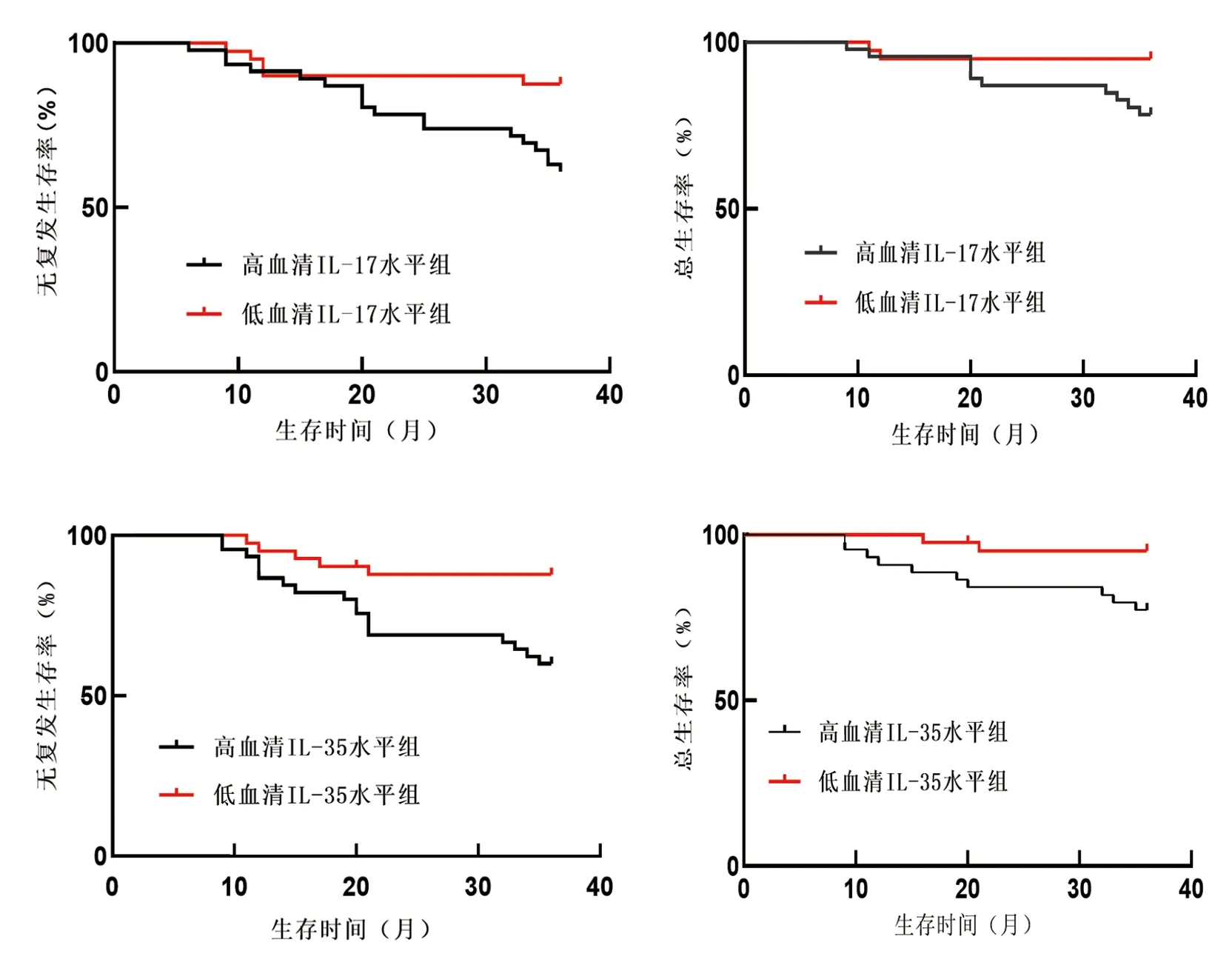
图1 不同血清IL-17,IL-35 水平前列腺癌患者生存曲线
2.4 影响前列腺癌患者预后的因素分析 单因素Cox 风险比例回归分析结果显示pT3a,中低度分化,Gleason 3-5 级,淋巴结转移,高水平IL-17,IL-35与前列腺癌患者不良预后发生有关(P<0.05),多因素Cox 风险比例回归分析显示Gleason 3-5 级,淋巴结转移,高水平IL-17,IL-35 是前列腺癌患者不良预后的危险因素(P<0.01),见表2 和3。

表2 影响前列腺癌患者预后的单因素Cox 风险比例回归模型
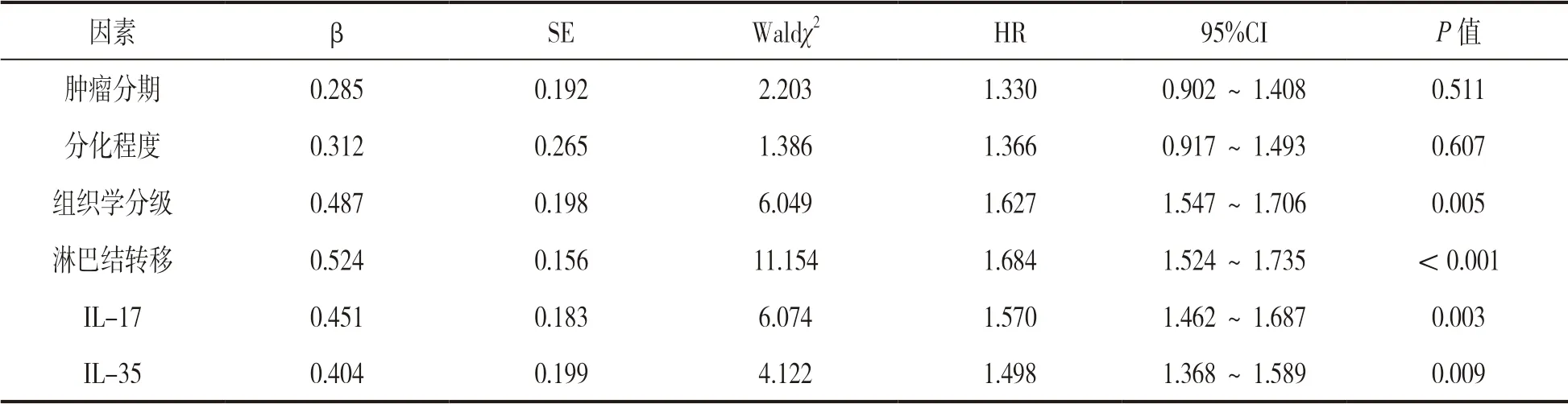
表3 影响前列腺癌患者预后的多因素Cox 风险比例回归模型
3 讨论
炎症与细胞分化、增殖侵袭、血管生成和转移等肿瘤发生和发展各个环节密切相关。巨噬细胞、肥大细胞、中性粒细胞、淋巴细胞及其亚群浸润于肿瘤组织释放如肿瘤坏死因子、表皮细胞生长因子、血管内皮生长因子、成纤维细胞生长因子2 等降解细胞外基质,介导上皮间质转化,促使肿瘤侵袭及转移[7]。炎症细胞还可募集间充质干细胞至肿瘤微环境,刺激血小板源性生长因子和血管内皮生长因子表达,促进新生血管形成和肿瘤生长[8],炎症细胞还可抑制细胞毒性T 淋巴细胞、自然杀伤细胞,导致Th1/Th2 和Th17/Treg 失衡,促使肿瘤细胞免疫逃逸[9]。全身炎症状态影响激素水平,而前列腺癌发病受雌激素和雄激素水平双重影响,越来越多的证据表明慢性炎症通过调节免疫反应,肿瘤微环境等参与前列腺癌发生过程中[10]。
IL-17 是一种多效促炎症细胞因子,主要由CD4+T 细胞的亚型-辅助细胞T17,单核细胞等分泌,具有强大招募中性粒细胞,促使多种炎性细胞因子释放,诱导趋化因子、血管生长因子表达等作用[11]。近年来研究发现IL-17 可能通过促进慢性组织炎症来支持癌症的发展,IL-17 在宫颈癌、食道癌、胃癌、肝癌和结直肠癌中表达升高[4],IL-17 通过增强癌症诱导的炎症反应,防止癌细胞受到免疫监视,促进肿瘤进展[12]。本研究发现前列腺癌患者血清IL-17 水平明显高于前列腺良性增生患者,且IL-17 水平与前列腺癌患者肿瘤分期、组织学分级、淋巴结转移以及术前PSA 水平有关,说明IL-17 介导的肿瘤相关炎症反应可能参与前列腺癌的发病和侵袭转移等恶性进展过程,与徐锐[13]等人报道存在一致之处。通过随访发现血清高IL-17 水平患者无生化复发生存率和总生存率低于低血清IL-17 水平患者,提示IL-17 水平与前列腺癌患者复发和生存密切相关,而这一结论得到了Cox 回归分析结果证实。IL-17 参与前列腺癌发病和进展的机制可能有以下几点:IL-17 通过作用于核因子-κB 和细胞外信号调节蛋白激酶1/2 信号通路,抑制程序性细胞死亡蛋白1,进而抑制细胞毒性T 淋巴细胞激活,抑制肿瘤免疫反应,逃避肿瘤免疫监视[14]。IL-17 还可增加肿瘤转移相关基因 mRNA 和蛋白的表达[15],上调血管内皮细胞中血管细胞黏附分子表达,增强前列腺癌细胞与血管内皮细胞黏附[16],促使和加速前列腺癌转移,导致肿瘤进展。
IL-35 是调节T 细胞功能的重要介质,主要由Treg 细胞在干扰素-γ 或Toll 样受体刺激下分泌,B 细胞、内皮细胞、平滑肌细胞和单核细胞也可产生IL-35,IL-35 通过促进Treg 细胞扩增和IL-10 的产生,抑制Th1 和Th17 细胞分化和功能,发挥免疫抑制功能[17]。癌细胞、肿瘤相关巨噬细胞可分泌IL-35,影响肿瘤免疫微环境免疫应答,抑制CD8+T 细胞功能,促使新生血管形成[18]。乳腺癌和肺癌模型中,肿瘤相关巨噬细胞分泌IL-35,通过激活Janus 激酶2-信号转导与转录激活因子3 信号通路促使癌细胞的上皮-间质转化,促进癌症的转移定植,敲除IL-35 可减少转移定植[19]。IL-35 在结肠癌[19]、非小细胞肺癌[20]表达均增高,与肿瘤侵袭、转移有关。本研究结果表明IL-35 同样参与前列腺癌发病和进展,ZHU[21]等人也指出血浆中IL-35 浓度增加与前列腺癌分期进展、GLEASON 评分增加、淋巴结和远处转移有关,提示IL-35 水平升高可能有助于前列腺癌的进展和转移。生存分析和Cox 回归分析结果表明IL-35 与前列腺癌复发和生存有关。分析IL-35 参与前列腺癌发生和进展机制为:IL-35水平增高抑制CD8+T 细胞功能,降低抗肿瘤免疫功能[22],导致前列腺癌细胞逃避免疫监视,促使新生血管形成和上皮-间质转化,进而导致肿瘤进展。
综上,前列腺癌患者血清IL-17,IL-35 水平明显升高,IL-17,IL-35 与前列腺癌的发生、发展和预后密切相关。IL-17,IL-35 可能是前列腺炎症相关性肿瘤微环境中促进肿瘤生长、侵袭和转移等病理过程的重要因子,有望成为前列腺癌病情和预后评估的一个新的免疫学指标,可能为前列腺癌的免疫治疗提供新的思路或治疗靶点。
