广西德保黄精炮制前后的液相图谱变化研究
2021-08-09赵秋华黄元河潘乔丹陆海峰
赵秋华 黄元河 潘乔丹 陆海峰
【摘 要】 目的:比较分析黄精炮制前后的液相图谱变化。方法:以薯蓣皂苷元为考察指标,采用HPLC法分析比較,色谱条件为Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5 μm),流动相为乙腈-水,梯度洗脱,波长200 nm,柱温30 ℃。结果:广西德保黄精炮制前后均有薯蓣皂苷元,但是炮制后薯蓣皂苷元含量有所下降,液相图谱炮制前后有显著差异,黄精炮制后产生新的色谱峰。结论:HPLC建立的黄精液相图谱稳定性、重复性较好,为黄精的质量标准研究提供参考依据。
【关键词】 黄精;炮制;高效液相色谱;薯蓣皂苷元
【中图分类号】R284.1 【文献标志码】 A 【文章编号】1007-8517(2021)12-0039-03
Abstract:Objective To compare and analysis The changes of liquid chromatogram of Rhizoma Polygonati before and after processing. Methods Taking diosgenin as the index,HPLC was used to analyze and compare,The chromatographic conditions were eclipse XDB-C18 column (150 mm × 4.6 mm,5μm),mobile phase was Acetonitrile-water,gradient elution,the wavelength was 200 nm,and the column temperature was 30 ℃.Results The content of diosgenin was determined by HPLC. There were diosgenin before and after processing,but the content of diosgenin decreased after processing. There were significant differences in HPLC chromatogram before and after processing,and new chromatographic peaks appeared after processing Rhizoma Polygonati.Conclusion The results showed that the HPLC chromatogram of semen luteum was stable and reproducible,which could provide reference for the quality standard research of Rhizoma Polygonati.
Keywords:Rhizoma Polygonati; Processing; High Performance Liquid Chromatography; Diosgenin
黄精为百合科植物滇黄精Polygonatum kingianum Coll.et Hemsl.黄精Polygonatum sibiricum Red.或多花黄精Polygonatum cyrtonema Hua的干燥根茎。按形状不同,习称“大黄精”“鸡头黄精”“姜形黄精”,其性平、味甘,具有补气养阴、健脾、润肺、益肾的功效[1]。近年来有关黄精化学成分研究报道日趋增多,至今已确定其中主要含有多糖、低聚糖、皂苷、氨基酸等活性成分,其中薯蓣皂苷是黄精属植物主要成分之一[2]。现代药理研究表明,黄精具有抗氧化和抗衰老、改善学习记忆、降血糖、抗动脉粥样硬化、抗菌抗病毒、抗肿瘤等药理作用[3]。苏仕林[4]对德保黄精进行植物学研究,发现由于山地开发,重采轻护,黄精资源锐减,而且生产周期长,产量非常有限。本研究通过对比德保黄精炮制后的液相图谱变化分析,以期为德保黄精药材质量标准和进一步开发研究奠定基础。
1 仪器与材料
1.1 仪器 岛津LC-20A高效液相色谱仪,Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5μm),sartorius CPA64分析天平,HC-5002S数控型台式超声波清洗机,超纯水机。
1.2 材料 黄精药材(购于靖西端午药市,采自德保县),经右江民族医学院基础医学院黄元河副教授鉴定为百合科植物黄精的根茎。黄酒(绍兴女儿红酿酒有限公司,酒精度%vol:14.0),薯蓣皂苷元(111539-200001),购于中国食品药品检定研究所。色谱级乙腈(MACKLIN),色谱级甲醇(TEDIA),其余试剂为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
2.1.1 色谱条件 岛津LC-20A高效液相色谱仪,Eclipse XDB-C18色谱柱(150 mm×4.6 mm,5 μm),以乙腈和水为流动相,采用二元梯度洗脱(梯度洗脱程序见表1),流速1 mL/min,检测波长200 nm,柱温30 ℃,进样量20 μL。
2.2 对照品溶液的制备 精确称取薯蓣皂苷元适量,加甲醇溶解后配制成0.18 mg/mL的对照品溶液,0.22 μm微孔滤膜滤过,备用。
2.3 供试品溶液的制备
2.3.1 生品黄精 将黄精除去杂质,洗净,略润,切厚片,干燥,得生品黄精。将黄精药材粉碎成粗粉,精确称取黄精粉末2 g,加入70%乙醇40 mL,超声提取2次,每次30 min,抽滤,合并滤液,旋干,浸膏加10 mL甲醇定容,放置过夜,0.22 μm微孔滤膜滤过,取滤液作为供试品溶液。
2.3.2 酒黄精 将生品黄精,加入黄酒焖润(每100 g黄精,用黄酒20 g), 高壓锅蒸制2 h,取出稍晾,干燥。将酒黄精粉碎成粗粉,精确称取黄精粉末2 g,加入70%乙醇40 mL,超声提取2次,每次30 min,抽滤,合并滤液,旋干,浸膏加10 mL甲醇定容,放置过夜,0.22 μm微孔滤膜滤过,取滤液作为供试品溶液。
2.4 方法学考察
2.4.1 精密度试验 精密吸取薯蓣皂苷元对照品10 μL,按照2.1.1色谱条件,连续进样5次进行测定,测得峰面积RSD为0.46%,表明仪器精密度良好。
2.4.2 重复性试验 取生品黄精5份,制备成供试品溶液,按照2.1.1色谱条件,重复进行测定,计算RSD值,测得峰面积RSD为1.85%,表明该方法重复性良好。
2.4.3 稳定性试验 取生品黄精药材制备成供试品溶液,按照2.1.1色谱条件,分别于0 h、2 h、4 h、6 h、8 h、12 h进行测定,测得峰面积RSD为1.74%,表明供试品溶液在12 h内稳定。
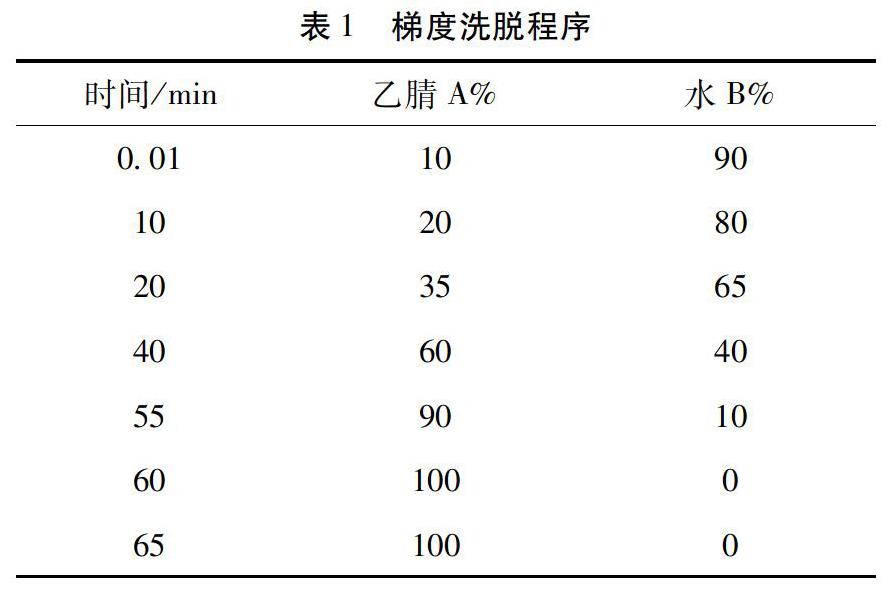
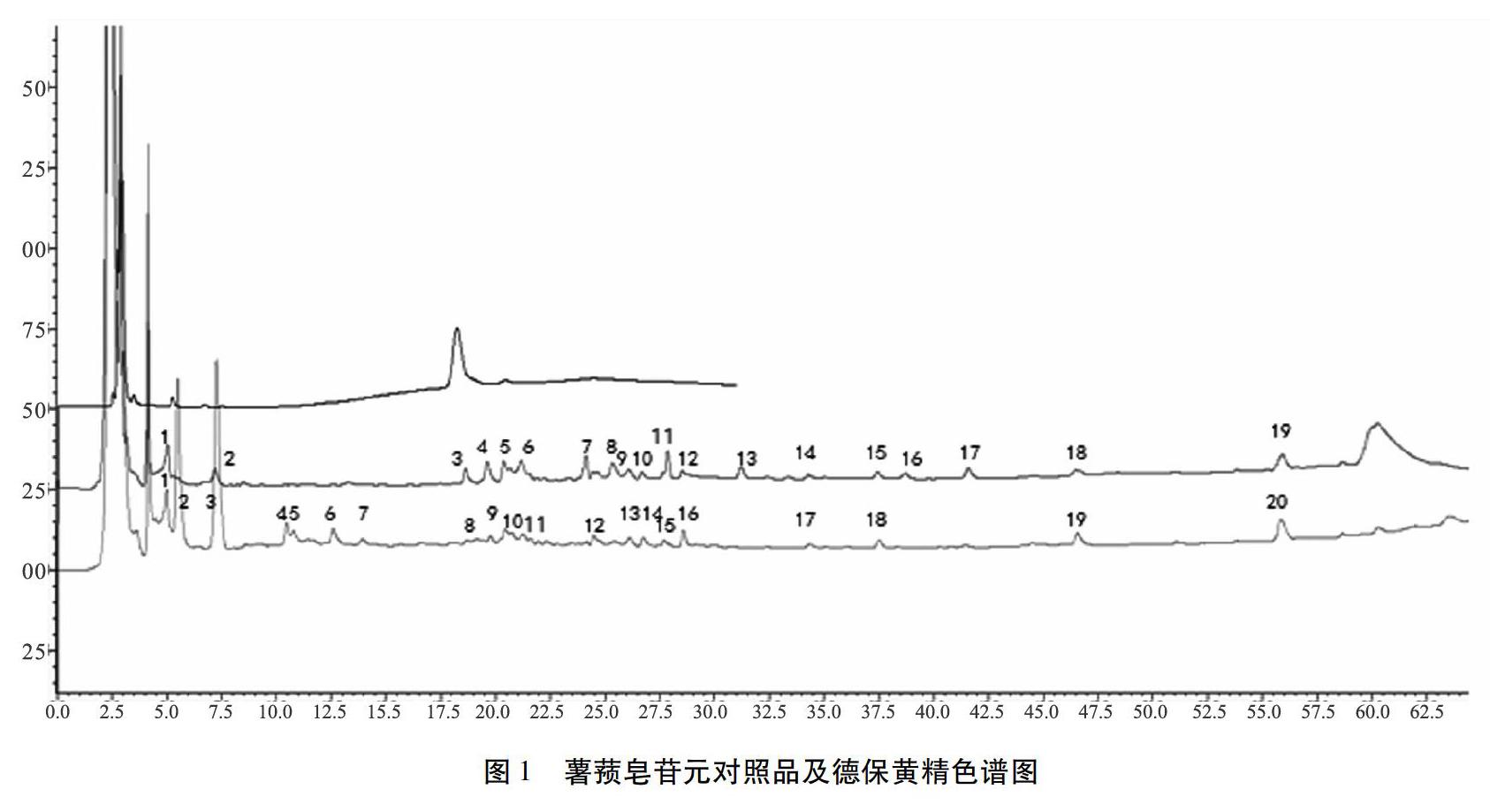
2.5 结果 将德保黄精样品分别按2.3方法制成供试品溶液,按色谱条件测定。通过色谱图结果分析比较,生品黄精检测出19个色谱峰,其中3号为薯蓣皂苷元;酒黄精检测出20个色谱峰,其中8号为薯蓣皂苷元。通过色谱图综合对比(色谱图1 为薯蓣皂苷元标准品,在条件探索中发现其在20 min左右出峰,后面无色谱峰,故保留时间设置为30 min,样品保留时间设置为65 min),生品黄精及酒黄精均含有薯蓣皂苷元,但是炮制后薯蓣皂苷元含量下降,且酒黄精产生了新的色谱峰,生品黄精有的色谱峰在酒黄精中也未检测到。如图1所示,生品黄精的7、13、16、17号峰在酒黄精中未检测到,生品黄精的3、11号峰的峰面积明显变小;另外,酒黄精中产生2、4、5、6、7号新的色谱峰。由实验结果可推断德保黄精炮制前后,化学成分发生了变化,有待进一步研究,以确定消失或新产生的是何化学成分。
3 讨论
3.1 黄精的炮制 黄精生用刺激咽喉,接触过生黄精或其汁液的皮肤会产生瘙痒感,故须经过炮制后才可用于临床[5]。有文献报道高压蒸制酒黄精的外观色泽、质地、气味、口感等性状与常压蒸制酒黄精无差异,可以达到传统蒸制的要求,而且高压蒸制酒黄精技术可显著节省炮制时间,有效提高生产效率[6],因此本次实验采取高压蒸制的方法。通过对比黄精炮制前后色谱图,推断黄精炮制后原有的一些色谱峰消失与降低刺激性相关。
3.2 黄精的液相图谱变化 黄精药材在广西德保以野生为主,采挖后大多泡酒服用。薯蓣皂苷元药理作用明显,具有抗肿瘤、抗心血管系统及雌激素样作用,是合成甾体激素类药物的前体[7],被认为是黄精发挥作用的真正有效成分[8]。通过对比生品黄精与酒黄精色谱图,炮制后薯蓣皂苷元含量下降。有研究认为[9] ,薯蓣皂苷元是其它许多皂苷元的前体,而通过炮制是否将使其转化为其它皂苷元而使炮制品中薯蓣皂苷元含量下降? 本实验结果发现,此推断可能性较大,黄精炮制后在降低刺激性副作用的同时,能增强药物补脾润肺、益肾的作用。黄精炮制后药效增强是否还与黄精中其它成分的含量变化有关,则有待后续研究确定。
3.3 黄精的质量评价 在本实验中,对比等度洗脱和梯度洗脱的色谱图,黄精炮制后黄精的色谱峰有变化,表明薯蓣皂苷元含量并不能作为衡量黄精质量的唯一标准,黄精中尚有多糖、人参皂苷等多种活性成分。党艳妮等[10]通过中药网络药理学数据库和分析平台,发现黄精中已鉴定的39个化合物,其中18个具有良好的药物代谢性质的化合物,黄精可通过多成分、多靶点及多通络的作用机制发挥其抗肿瘤活性。因此对德保黄精进行化学成分检测和多成分综合分析,可为德保黄精药材质量标准和进一步开发研究奠定基础。
参考文献
[1]中国药典国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药出版社,2015:306-307.
[2]钟凌云,周晔,龚千锋.炮制对黄精薯蓣皂苷元的影响研究[J].中华中医药学刊,2009,27(3):538-540.
[3]姜程曦,张铁军,陈常青,等.黄精的研究进展及其质量标志物的预测分析[J].中草药,2017,48(1):1-16.
[4]苏仕林,马博,黄珂.广西百色德保黄精的民族植物学研究[J].安徽农学通报,2012,18(1):56-57,83.
[5]孙婷婷,张红,李晔,等.陕西产黄精不同炮制品中薯蓣皂苷元含量含量分析[J].中国药房,2017,20(1):158-160.
[6]王永禄,王丽瑶,朱欣佚,等.常压蒸制和高压蒸制对酒黄精化学成分的影响研究[J].中国生化药物杂志,2014,34(8):173-175.
[7]罗静,沈昱翔,周浓,等. HPLC 法测定14 个不同产地滇重楼中薯蓣皂苷元的含量[J].中国药房,2015,26(21):2965-2967.
[8]孙隆儒,王素贤,李铣.中药黄精化学成分的研究(I)[J].中草药,1997,28(增刊):47.
[9]张洁,马百平,杨云,等.黄精属植物甾体皂苷类成分及药理活性研究进展[J].中国药学杂志,2006,41(5):330-332.
[10]党艳妮,黄壮壮,苏英英,等.基于网络药理学的黄精抗肿瘤成分筛选研究[J].药物评价研究,2020(3):468-472.
(收稿日期:2020-11-15 编辑:程鹏飞)
