二硫代羧基化羟甲基聚丙烯酰胺与Cu2+的螯合稳定性
2021-08-09严亚萍王露露周雅琦兰州交通大学环境与市政工程学院甘肃兰州730070
严亚萍,王 刚,王露露,周雅琦 (兰州交通大学环境与市政工程学院,甘肃 兰州 730070)
重金属废水中,含铜废水是最常见、水量最多的废水[1].常见含铜废水的处理方法主要有:化学沉淀法、电化学法、膜分离法、离子交换法、生物吸附法和植物修复法等[2-5].这些方法各有优缺点,而螯合沉淀法作为化学沉淀处理技术中常见的一类方法,因其操作方法简单且絮凝效果佳而备受关注[6].郭睿等[7]以一种接枝共聚物(EPPC)为母体,通过黄原酸化反应,合成了一种重金属螯合剂阳离子聚酰胺黄原酸钠(EPPCX),该产品对 Cu2+的去除率可达96.9%;肖晓等[8]以二硫化碳、乙二胺为原料用化学合成法制备出一种重金属螯合捕集剂 N,N-双(二硫代羧基)乙二胺(EDTC),除铜性能良好,当体系pH值为 3.0~9.0时,Cu2+的去除率可达 99.5%以上;王刚等[9]以聚丙烯酰胺为母体,通过巯基乙酰化反应制得巯基乙酰化羟甲基聚丙烯酰胺(MAMPAM),结果表明MAMPAM对单一体系和混合体系中的铜均有较好的去除效果,当pH值为6.0时,单一体系中铜的最高去除率可达 95.92%.以上研究均表明重金属螯合絮凝剂对重金属具有良好的去除性能.目前关于重金属螯合絮凝剂大多集中在其对重金属去除性能的研究上,而针对螯合絮凝剂与重金属之间螯合能力的相关研究偏少.理论上,重金属螯合絮凝剂去除重金属能力的强弱主要取决于絮凝剂中螯合基团与重金属离子间的螯合能力,可用螯合物的稳定常数衡量.稳定常数常见的测定方法有:极谱法、pH值电位法、分光光度法等[10].其中,极谱法由于使用的滴汞电极有剧毒,会对操作人员和环境带来严重的危害,应用较少;pH电位法需要在测定螯合物稳定常数的同时测定解离常数,并利用计算机模拟函数模型计算稳定常数,过程繁琐[11-12];而分光光度法主要适用于测定配合物中具有共轭体系或金属配合物的稳定常数,其优势是经典、操作简单,在一般实验室条件下就可进行[13].在现有关于重金属螯合剂与重金属间螯合能力的研究中,大多侧重于某一特定条件下稳定常数的研究,而未在不同条件下对稳定常数的影响进行系统的研究.例如,廖强强等[14]、刘立华等[15]仅测定了当体系 pH值为某一定值时(pH值为9.25),重金属絮凝剂与Cu2+、Pb2+、Cd2+、Ni2+的稳定常数,并未考察其他影响因素对螯合物稳定常数的影响.
聚丙烯酰胺(PAM)是一种线性高分子聚合物,因其良好的桥连能力和吸附效应被广泛应用于废水处理中[16].本文前期研究中,以 PAM 为母体,通过化学反应分别将羟基和二硫代羧基引入到 PAM 分子链上,获得一种重金属螯合絮凝剂二硫代羧基化羟甲基聚丙烯酰胺(DTMPAM)[17].由于二硫代羧基中含有能与 Cu2+形成难溶性硫化物的硫原子,故DTMPAM 能通过含硫官能团有效螯合去除水中溶解态的 Cu2+,同时 DTMPAM 还能利用自身的电中和、吸附架桥等作用使螯合絮体实现快速沉降和聚集,具有良好的除 Cu2+性能[18-19].实际含铜废水中往往还含有其他共存有机配位剂,如焦磷酸、柠檬酸、乙二胺四乙酸、酒石酸等,这些物质的存在会促进或抑制DTMPAM对Cu2+的去除,其影响原因仅仅采用配位化学的相关知识给出了理论解释[19],而未能结合DTMPAM中二硫代羧基与Cu2+形成螯合物的稳定常数进行说明.鉴于此,本文在前期研究的基础上,采用紫外分光光度法研究了DTMPAM对Cu2+的螯合能力,确定了螯合物的配位比,考察了螯合物DTMPAM-Cu在pH值、—CSS-浓度、Cu2+浓度等不同条件下的稳定性,并计算其稳定常数,以期获得不同条件下 DTMPAM 与 Cu2+间的螯合能力,为DTMPAM应用于实际含铜废水的处理提供参考.
1 材料与方法
1.1 仪器与试剂
试剂:聚丙烯酰胺(PAM,相对分子质量300万)、甲醛(HCHO,AR)、二硫化碳(CS2,AR)、氢氧化钠(NaOH, AR)、盐酸(HCl,GR)、氯化铜(CuCl2·2H2O,AR).
仪器:ORION828型pH测试仪(美国奥立龙中国公司),FA2004型电子天平(上海精密科学仪器有限公司),JB-2型恒温磁力搅拌器(上海雷磁新泾仪器有限公司),Unicam UV300型紫外-可见分光光度计(英国Unicam公司).
1.2 DTMPAM的制备
DTMPAM由PAM、HCHO、CS2、NaOH为原料在实验室自制,其具体制备方法为:于三口瓶中加入质量分数为 0.5%的PAM水溶液和 HCHO,PAM与 HCHO物质的量比为 1:1;用 NaOH溶液调节其pH值为10.0,于恒温磁力搅拌器上水浴加热至50℃,恒温反应 2h,获得中间产物羟甲基聚丙烯酰胺(MPAM).另取三口瓶,加入质量分数为 0.5%的MPAM 水溶液以及 NaOH、CS2,使 MPAM:CS2:NaOH物质的量比为1:4.3:4.3;将三口瓶置于恒温磁力搅拌器上水浴加热至30℃,搅拌使其反应1h;最后将水浴温度升至45°C,继续反应70min后,制得最终产物二硫代羧基化羟甲基聚丙烯酰胺(DTMPAM)[17].该产物为橘黄色液体,可溶于水、乙醚等溶剂,但不溶于丙酮、乙醇;在蒸馏水体系中,DTMPAM溶液的等电点pHiep为2.0.
1.3 实验原理
DTMPAM高分子链上的—CSS-基团能与Cu2+发生螯合反应[20-21],方程式如式(1)所示.

螯合物DTMPAM-Cu稳定常数βn可用式(2)表示[22].

当 c(Cu2+)>>c(—CSS-)时,存在式(3)所示关系,ε为摩尔吸光系数.

当反应平衡时,有如式(4)~式(6)关系.

螯合物稳定常数βn的计算式如式(7).

式中:[Cu2+]、[CSS-]和[(Cu(CSS)n)-n+2]分别为反应平衡时 Cu2+、—CSS-和(Cu(CSS)n)-n+2的浓度,mol/L;n为Cu2+与—CSS-的配合比;ε可由式(3)与测定的饱和吸光度Amax计算;n为绘制的A-c(Cu2+)/c(CSS-)曲线的转折点;A为螯合物(Cu(CSS)n)-n+2在最大吸收波长处的吸光度.
1.4 实验方法
1.4.1 紫外吸收光谱的测定 在 25mL比色管中,加入一定量DTMPAM溶液、Cu2+溶液,用蒸馏水稀释使体系中—CSS-浓度为4.0×10-5mol/L、Cu2+浓度为2.0×10-5mol/L,在室温下放置5min,螯合反应达到平衡后[23],以—CSS-浓度为 4.0×10-5mol/L 的DTMPAM 溶液作为参比,采用紫外-可见分光光度计测定 DTMPAM 与 Cu2+形成螯合物的吸收光谱.在DTMPAM的吸收光谱测定中,DTMPAM溶液中—CSS-浓度取 4.0×10-5mol/L,以蒸馏水作为参比,其他条件相同.
1.4.2 螯合物配位比及稳定常数的测定 在25mL比色管中,加入一定浓度的DTMPAM和不同浓度的Cu2+溶液,用蒸馏水稀释后,使溶液中—CSS-浓度为一固定值,c(Cu2+)/c(CSS-)的值按一定梯度变化,在室温下放置 5min后,以固定—CSS-浓度的 DTMPAM溶液作为参比溶液,测定其吸收光谱.从光谱曲线中选出最大吸收波长,以最大吸收波长处的吸光度 A对 c(Cu2+)/c(CSS-)作图,由 A-c(Cu2+)/c(CSS-)曲线可确定,螯合物的配合比 n、最大吸光度 Amax,将 Amax代入式(3),即可求得ε;将 n、ε、c(Cu2+)、c(CSS-)、A代入式(7)可求得螯合物的稳定常数.
2 结果与讨论
2.1 DTMPAM及DTMPAM-Cu的吸收光谱
由图1可知,DTMPAM分别在207,226nm处出现最大吸收峰,207nm处为—S—C=S基团中的未成对电子向共轭体系的 n-π∗跃迁[24],226nm 处为助色基团—NH2接到生色基团—C=O后生成的酰胺基(—CONH2)[25],—C=O的吸收峰波长在195nm处,与助色基团—NH2结合后,吸收峰波长向长波方向移动,发生红移,说明碳硫键和碳氮键有部分双键的特征[15,26-28].而螯合物 DTMPAM-Cu分别在 220,260nm 处出现最大吸收峰,表明 Cu2+与—CSS-发生了螯合反应,而与—NH2发生了配位反应[29].—CSS-基团中含有 n电子,同时Cu2+提供电子空轨道,会形成新的共轭体系[30],螯合物在吸收光子后,在—CSS-配位场的影响下,d轨道的电子跃迁到高能级轨道发生电荷迁移跃迁,由于n电子比π电子更易于激发,电子跃迁所需的能量降低,导致吸收峰向长波方向移动,产生显著红移[31].
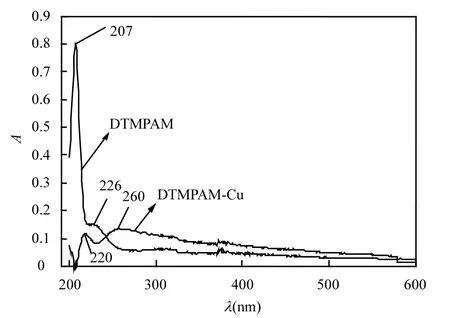
图1 DTMPAM与DTMPAM-Cu的吸收光谱Fig.1 Absorption spectra of DTMPAM and DTMPAM-Cu
2.2 Cu2+浓度对螯合物吸收光谱的影响
将溶液中—CSS-的浓度固定为 4.0×10-5mol/L,体系 pH 值为 7.5,分别加入不同浓度的 Cu2+,使c(Cu2+)/c(CSS-)的比值从 0.1~1.5变化,考察 Cu2+浓度对螯合物DTMPAM-Cu紫外吸收光谱的影响.由图 2可知,当—CSS-浓度为 4.0×10-5mol/L 时,不同浓度的 Cu2+与 DTMPAM 螯合后,螯合物均在 220和260nm波长处出现了最大吸收峰,且吸光度 A随着c(Cu2+)/c(CSS-)比值的增大而增大,当c(Cu2+)/c(CSS-)的比值增加到1.0左右时,其与c(Cu2+)/c(CSS-)比值为 1.5的曲线基本重合,说明随着 Cu2+浓度的增大,引起螯合物吸光度变化的 DTMPAM-Cu浓度不再变化,螯合反应达到饱和.

图2 不同Cu2+浓度下DTMPAM-Cu的紫外吸收光谱Fig.2 Ultraviolet absorption spectra of DTMPAM-Cu under different Cu2+ concentrations
图 2还表明,随着 c(Cu2+)/c(CSS-)比值的增大,螯合物DTMPAM-Cu在220和260nm处吸收峰的位置几乎无变化,未发生红移或蓝移,但整体的吸光度值在不断增大,说明随着 Cu2+浓度的增大,体系中生成的DTMPAM-Cu螯合物增多.这可能是由于随着体系中Cu2+的增多,DTAPAM与Cu2+的碰撞几率增加,故生成的DTMPAM-Cu螯合物增多[20].
2.3 —CSS-浓度的影响
2.3.1 不同—CSS-浓度下螯合物 DTMPAM-Cu的吸收光谱 固定—CSS-的浓度分别为 3.0×10-5,4.0×10-5,5.0×10-5,6.0×10-5mol/L,体系 pH 值为 7.5,分别加入不同浓度的 Cu2+,测定不同浓度 Cu2+与—CSS-形成的螯合物的吸光度,得到如图 3所示的紫外吸收光谱.
由图 3可知,当 DTMPAM 中—CSS-浓度从3.0×10-5~6.0×10-5mol/L变化时,DTMPAM与不同浓度的Cu2+螯合后都在220和260nm处出现最大吸收峰,最大吸收峰位置未发生变化,说明—CSS-浓度的变化并不影响DTMPAM-Cu的最大吸收峰的位置;随着—CSS-浓度的逐渐增大,螯合物 DTMPAM-Cu紫外吸收光谱曲线A→P的吸光度值整体在增大,这是由于随着—CSS-浓度的逐渐增大,体系中形成的螯合物 DTMPAM-Cu也随之增多,因此曲线 A→P的吸光度值也随之整体增大;在同一—CSS-浓度下,吸光度 A随 Cu2+浓度的增大而增大,当 c(Cu2+)/c(CSS-)为1.0和1.5时,两条曲线基本重合,表明随着Cu2+浓度的增大,体系中生成的能够引起吸光度 A变化的螯合物DTMPAM-Cu浓度不再增大,螯合反应基本达到完全.


图3 不同—CSS-浓度下螯合物DTMPAM-Cu的紫外吸收光谱Fig.3 Ultraviolet absorption spectra of chelate DTMPAM-Cu under different —CSS- concentrations
2.3.2 不同—CSS-浓度下 A-c(Cu2+)/c(CSS-)曲线为确定螯合物DTMPAM-Cu的配位比和稳定常数,选取 220nm 为吸收峰波长,固定—CSS-浓度分别为3.0×10-5,4.0×10-5,5.0×10-5,6.0×10-5mol/L.
由图4可知,随着—CSS-浓度的增大,吸光度A也随之增大,这是由于当—CSS-浓度较大时,体系中螯合物DTMPAM-Cu也较多,因此吸光度A也较大.在 4种不同—CSS-浓度下,当 c(Cu2+)/c(CSS-)小于0.5时,吸光度A随c(Cu2+)/c(CSS-)的增大近似呈线性增加;当c(Cu2+)/c(CSS-)为0.5~1.0时,吸光度A随 c(Cu2+)/c(CSS-)的增大而缓慢增加;当 c(Cu2+)/c(CSS-)为 1.0~1.5时,吸光度 A不再随 c(Cu2+)/c(CSS-)的增大而变化,表明 DTMPAM与 Cu2+的螯合反应基本达到完全,此时的吸光度即为饱和吸光度 Amax;每条曲线在 0.5~0.6之间出现明显的拐点,表明DTMPAM与Cu2+按物质的量比2:1进行螯合,生成2:1型螯合物.

图4 不同—CSS-浓度下的A-c(Cu2+)/c(CSS-)曲线Fig.4 Graph of A-c(Cu2+)/c(CSS-) under differernt —CSS-concentrations
2.3.3 不同—CSS-浓度下 DTMPAM-Cu的稳定常数 DTMPAM 中的—CSS-与 Cu2+生成 2:1型螯合物,故式(7)中n取2.以图4中各曲线水平段的吸光度为饱和吸光度 Amax,当—CSS-浓度分别为 3.0×10-5,4.0×10-5,5.0×10-5,6.0×10-5mol/L 时,对应的 Amax为0.142,0.169,0.197,0.233.由式(3)可计算出摩尔吸光系数ε.将 n、ε、c(Cu2+)、c(CSS-)和 c(Cu2+)/c(CSS-)的吸光度A代入到式(7),计算螯合物DTMPAM-Cu稳定常数的对数值lgβ2,结果如表1所示.
取不完全反应区域且实验结果较接近的点计算稳定常数[32],并对其稳定常数求平均值,得到在 4种不同—CSS-浓度下,DTMPAM与Cu2+形成螯合物的平均稳定常数对数值分别为 11.4473,10.7279,10.6282和10.5725,这些值与刘立华等[15]采用分光光度法测得含有—CSS-基团的重金属捕集剂与Cu2+的稳定常数对数值12.1367较为接近.随着—CSS-浓度的增大,稳定常数会略有减小,说明DTMPAM 对 Cu2+的螯合能力与体系中—CSS-的浓度有关,这可能是由于随着 DTMPAM 浓度的增大,在体系体积相同的情况下,会发生一定的空间位阻[33-34],DTMPAM 浓度越高,越不利于高分子链的舒展和解离,导致DTMPAM高分子链有一部分呈卷曲状,不利于与 Cu2+的结合,故 DTMPAM 与 Cu2+的螯合能力略有下降.表 1还表明,在同一—CSS-浓度下,随着c(Cu2+)/c(CSS-)的增大,Cu2+浓度在不断增大,溶液离子强度逐渐增强,DTMPAM-Cu稳定常数对数值变化较小,说明研究浓度范围内溶液离子强度对稳定常数影响较小,这与赵婧等[35]在溶解有机质(DOM)与 Cu2+的络合性研究中得出的结论一致.此外,摩尔吸光系数ε也可间接反映螯合物 DTMPAMCu 稳定常数的大小,ε越大,lg¯也越大.

表1 螯合物DTMPAM-Cu的稳定常数Table 1 Stability constant of chelate DTMPAM-Cu
2.4 pH值的影响
2.4.1 pH值对螯合物DTMPAM-Cu吸收光谱的影响 固定—CSS-浓度为4.0×10-5mol/L,调节体系pH值为 3.0~9.0,测定螯合物 DTMPAM-Cu在不同 pH值下的吸收光谱,如图5所示.
由图 5可知,当 pH 值为 3.0~5.0时,螯合物DTMPAM-Cu的吸收光谱图仅在220nm处存在吸收峰,260nm处吸收峰消失;当pH值为6.0~9.0时,螯合物DTMPAM-Cu在220和260nm处均存在吸收峰.随着体系pH值的逐渐升高,220nm处吸收峰并未发生明显变化,而260nm处的吸收峰开始出现并逐渐明显,说明体系 pH 值对—CSS-和 Cu2+的螯合影响不大,而对DTMPAM在260nm吸收峰处的官能团—NH2和Cu2+的配位作用影响较大,pH值越大,—NH2对Cu2+的配位能力越强.这是由于 DTMPAM 表面带负电荷,当体系pH值较低时,溶液中H+较多,使得带负电的DTMPAM表面吸附了大量的H+,—NH2被质子化,同时H+占据了Cu2+与—NH2的配位位点[35-37];当pH值升高时,体系中OH-的增加抑制了—NH2与 H+的结合,增强了其对Cu2+的配位能力,故—NH2所在的 260nm 处吸收峰逐渐增强.在不同的pH值下,DTMPAM-Cu的吸光度仍随 Cu2+浓度的增大而增大,这与前述原因类似,即随着Cu2+浓度的增大,体系中DTMPAM-Cu增多.


图5 不同pH值下螯合物DTMPAM-Cu的紫外吸收光谱Fig.5 Ultraviolet absorption spectra of chelate DTMPAM-Cu at different pH values
2.4.2 DTMPAM-Cu螯合物在不同pH值下的配位比 当pH值为3.0~9.0时,选取220nm为吸收峰波长,固定—CSS-浓度为 4.0×10-5mol/L.
由图6可知,不同pH值下,当c(Cu2+)/c(CSS-)小于0.5时,A-c(Cu2+)/c(CSS-)曲线几乎呈直线;每条曲线在0.5~0.6之间出现明显的拐点;当c(Cu2+)/c(CSS-)为0.5~1.0时,吸光度 A随c(Cu2+)/c(CSS-)的增大而缓慢增加;当 c(Cu2+)/c(CSS-)为 1.0~1.5时,吸光度 A不再随 c(Cu2+)/c(CSS-)的增大而变化,DTMPAM 与Cu2+的螯合反应基本达到完全.随着 pH 值的变化,A-c(Cu2+)/c(CSS-)曲线的拐点并未发生改变,说明pH值并不影响DTMPAM与Cu2+的配位比,配位比仍然是2:1,生成2:1型螯合物.

图6 不同pH值下的A-c(Cu2+)/c(CSS-)曲线Fig.6 Graph of A-c(Cu2+)/c(CSS-) at different pH values
2.4.3 螯合物DTMPAM-Cu在不同pH值下的稳定常数 从表 2可见,当体系 pH3.0~5.0时,随着体系pH值的升高,DTMPAM-Cu的稳定常数逐渐升高,DTMPAM 对 Cu2+的螯合能力增强.这是由于DTMPAM 存在酸效应,pH值较低时,二硫代羧基主要以—CSSH 形式存在,不易与 Cu2+结合,随着体系pH值的升高,以—CSS-形式存在的二硫代羧基增多,—CSS-更易与 Cu2+结合.而当体系 pH6.0~9.0时,DTMPAM-Cu的稳定常数对数值分别为 9.9367,9.7254,10.2967,10.0662,整体上略低.这可能是由于,当体系pH值较高时,体系中会形成较多的Cu(OH)2细小絮体,—OH 会与—CSS-竞争 Cu2+,造成—CSS-与 Cu2+的螯合能力减弱[24].体系 pH值会对DTMPAM 与 Cu2+的螯合造成一定的影响.不同 pH值条件下的摩尔吸光系数ε与lg¯β2之间的关系也与2.3.3中所述的规律一致,即ε越大,lg¯β2也越大.

表2 不同pH值下螯合物DTMPAM-Cu的稳定常数Table 2 Stability constant of chelate DTMPAM-Cu at different pH values

续表2
3 结论
3.1 DTMPAM吸收光谱图中的最大吸收峰随Cu2+的加入发生显著红移,—CSS-与 Cu2+发生了螯合反应,形成了新的共轭体系.不同条件下 DTMPAM 中的—CSS-与Cu2+均形成2:1型螯合物.
3.2 DTMPAM与Cu2+的螯合能力与—CSS-浓度、体系 pH 值有关.随着—CSS-浓度的增大,螯合物DTMPAM-Cu的稳定常数有减小的趋势.DTMPAM对Cu2+螯合能力会受体系pH值影响,当体系pH值为3.0~5.0时,随着pH值的升高,DTMPAM-Cu的稳定常数逐渐升高,当pH值为6.0~9.0时,DTMPAMCu的稳定常数整体上略低.
