川西彝族酸菜汁中抗氧化乳酸菌筛选及益生特性研究
2021-08-09许强袁乐梅唐雪梅边名鸿
许强, 袁乐梅, 唐雪梅, 边名鸿*
(1.固态发酵资源利用四川省重点实验室,四川 宜宾 644000;2.四川轻化工大学 生物工程学院,四川 宜宾 644000)
随着人们生活品质的提高及健康意识的逐渐提升,具有一定益生特性的微生物菌剂的开发及应用受到了广泛关注。在人、畜体内,乳酸菌是重要的菌群,具有维持微生态平衡的作用,是影响宿主健康的主要益生菌之一[1]。在体外,乳酸菌有类似抗氧化剂的作用,在抗氧化酶的作用下,可以清除体内的超氧阴离子及过氧化氢等,有降低机体氧化损伤、延缓衰老及预防病变的作用,是一种新型的天然抗氧化剂,因此在食品、医药等行业中应用非常广泛[2]。
乳酸菌广泛存在于醪糟、酸奶、泡菜等传统发酵食品中,其中有不少具有特殊生理功能的菌株[3],李丹丹等[4]发现在西藏牦牛酥油中存在自由基清除能力较强的乳酸菌,王琪等[5]在酸粥发酵液中筛选得到一株抗氧化活性较强的乳酸菌,鉴定为短乳杆菌。川西彝族酸菜产自川西高海拔地区,是彝族的传统美食,在高寒高海拔生态环境中网罗了较多功能性强的微生物[6],乳酸菌是其发酵过程中重要的优势微生物,其中大多数具有较强的体外抗氧化活性。将其中抗氧化活性较强的乳酸菌经分离筛选后应用到传统发酵食品中,不仅可以得到具有抗氧化特性的食品,还可以改善发酵食品的风味,具有较好的研究价值和开发前景。
本研究以彝族酸菜汁中筛选的乳酸菌为出发菌株,对比分析其抗氧化能力及胃肠道耐受性能力,旨在筛选具有益生菌潜力的乳酸菌,为乳酸菌益生菌剂的合理开发提供基础数据。
1 材料与方法
1.1 试验材料与试剂
彝族酸菜汁中分离到的40株乳酸菌:实验室保藏;大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis):四川轻化工大学公共实验室保藏。
MRS液体培养基:北京陆桥技术股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、牛胆盐、胃蛋白酶、胰酶、过氧化氢、邻苯三酚、三羟甲基氨基甲烷、硫酸亚铁、水杨酸等:合肥博美生物科技有限公司。
1.2 试验仪器
DM300生物显微镜 徕卡仪器有限公司;PHS-2C精密pH计 上海虹益仪器仪表有限公司;756紫外可见分光光度计 上海奥普勒仪器有限公司;5424R高速冷冻离心机 德国Eppendorf公司;Scientz-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;2720 thermal cycler PCR仪 Applied Biosystems公司;JY04S-3C凝胶成像系统 君意东方电泳设备有限公司。
1.3 试验方法
1.3.1 具有抗氧化性菌株的筛选
取乳酸菌发酵液于离心机中离心10 min后,用pH为7的PBS缓冲液反复吹打菌体,离心,重复3次后将菌体重悬至9.0 log CFU/mL。将菌悬液用超声波细胞粉碎机冰浴破碎10 min,离心2 min后保留上清液,备用。
1.3.1.1 还原能力的测定
参照Lin等[7]的操作方法测定乳酸菌的还原能力,记录其OD700 nm值。
1.3.1.2 清除羟自由基能力的测定
参照柳青[8]的方法测定乳酸菌羟自由基清除能力,计算公式如下:
清除羟自由基能力/%=(Ai-Aj)/(A0-Aj)×100%。
式中:Ai为DPPH乙醇溶液(0.2 mmoL/L)在OD517 nm的吸光值;Aj为以1 mL蒸馏水代替样品液的对照组;A0为用1 mL蒸馏水代替样品且体系中不包含H2O2的空白组。
1.3.1.3 清除超氧阴离子自由基能力的测定
参照Wang等[9]的研究方法,测定乳酸菌清除超氧阴离子自由基能力,计算公式如下:
清除超氧阴离子自由基能力/%=(△Ai-△A0)×100/△A0。
式中:△Ai和△A0为加入样品和去离子水之前和之后邻苯三酚自氧化的速率。
1.3.1.4 对DPPH自由基清除能力的测定
参照Wang等的研究方法,测定乳酸菌对DPPH自由基的清除能力,计算公式如下:
DPPH自由基清除能力=[1-(Ai-Aj)/A0]×100%。
式中:A0为以1 mL乙醇代替样品液的对照组;Ai为DPPH乙醇溶液(0.2 mmol/L)在OD517 nm的吸光值;Aj为以1 mL乙醇代替DPPH乙醇溶液的空白组。
1.3.1.5 耐受过氧化氢的能力
将乳酸菌菌悬液接种至H2O2浓度分别为0,0.4,0.7,1.0 mmol/L的MRS液体培养基中37 ℃恒温培养。每隔2 h取样,在OD600 nm处测定吸光值,观察各组培养物对不同浓度H2O2耐受能力的变化情况[10]。
1.3.2 乳酸菌通过人体胃肠道能力的检测
1.3.2.1 耐酸性
参照Abolfazl等[11]的方法并稍作修改,将乳酸菌接种至pH 2和pH 3的MRS液体培养基中。乳酸菌在pH 2的条件下培养60 min,在pH 3的条件下培养180 min,用倾注法计算乳酸菌菌落数。
1.3.2.2 胆盐耐受性
参考陈欢等[12]的方法并稍作修改,将乳酸菌接种至牛胆盐含量为0%、0.3%、0.5%和1.0%的MRS液体培养基中。培养24 h后,使用倾注法计算乳酸菌菌落数,并计算乳酸菌的胆盐耐受能力。
1.3.2.3 对人工胃液和肠液的耐受性
将菌悬液分别加入10 mL的人工胃液和人工肠液,37 ℃厌氧培养。在人工胃液培养3 h时取样,人工肠液培养4 h时取样,梯度稀释后以倾注法计算乳酸菌存活的菌落数并计算乳酸菌存活率。
1.3.2 4 菌株16S rRNA分子生物学鉴定及系统发育树构建
将功能性较好的菌送至擎科生物公司测定16S rRNA序列,用Nucleotide BLAST对比后用MEGA软件构建系统发育树。
2 结果与分析
2.1 具有体外抗氧化能力菌株的筛选
2.1.1 还原力和清除羟自由基清除能力
乳酸菌具有一定的还原能力,能避免细胞受到活性氧的伤害[13]。而羟自由基是最活跃的ROS,会导致DNA、蛋白质和多糖化合物等的损伤,羟基自由基清除能力是反映菌株抗氧化能力的重要参数之一[14]。
由表1可知,菌株无细胞提取液(CFE)和菌悬液(IC)的还原力大于100 μmol/L L-半胱氨酸盐酸盐当量的菌株有20株,其中E5菌株的CFE与IC的还原力最高,分别达到227.33 μmol/L和290.67 μmol/L。所选菌株中有15株菌的CFE和IC的羟自由基清除能力大于30%,其中菌株LBS8的CFE羟自由基能力高达50.77%; LBS3的IC羟自由基清除能力为41.08%。不同乳酸菌对羟自由基清除能力有较大差异,可能是由于不同乳酸菌分泌抗氧化物质的种类和含量不同[15]。
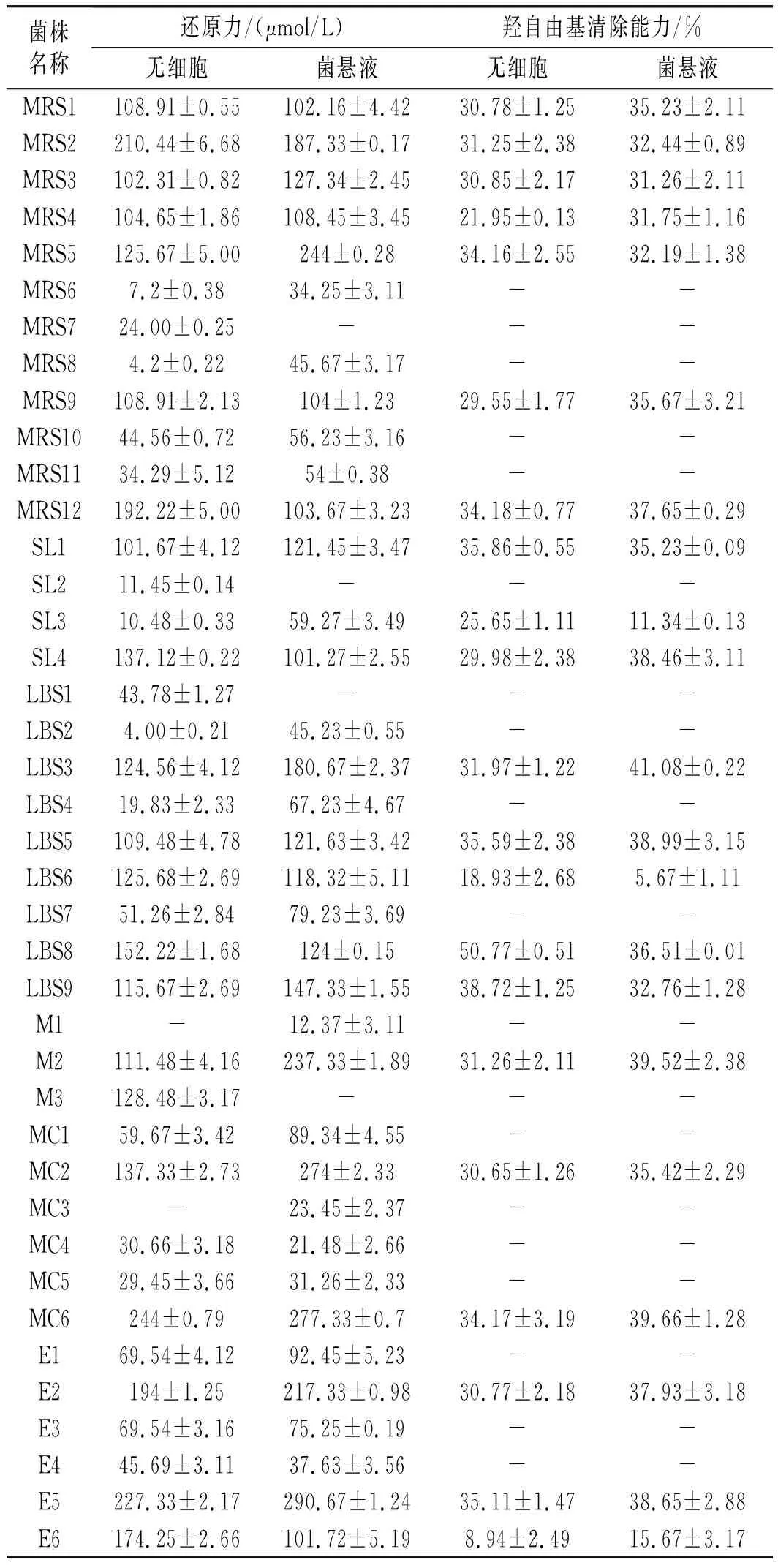
表1 乳酸菌的还原力和清除羟自由基能力Table 1 The reducing power and hydroxyl radical scavenging ability of lactic acid bacteria
2.1.2 菌株超氧阴离子及DPPH自由基清除能力
选择2.1.1中具有较高还原能力(IC和CFE>100 μmol/L)和羟自由基清除能力(IC和CFE>30%)的15株乳酸菌,测定其超氧阴离子自由基清除能力。
由表2可知,所选的菌株中有12株菌的CFE和IC的超氧阴离子自由基清除能力大于70%,其中MRS12的CFE超氧阴离子自由基清除能力高达82.91%,MC6的IC超氧阴离子自由基清除能力高达81.94%。所选15株菌中CFE和IC的DPPH清除能力大于30%的菌株有10株,其中MC2的CFE的DPPH自由基清除能力高达36.52%,MRS5的IC的DPPH自由基清除能力能达到39.11%,与Zhang等[16]提出的高活性乳酸菌概念相符。大多数菌株的菌悬液清除能力高于无细胞提取液的能力,原因可能是菌体可以持续分泌胞外多糖,多糖具有一定的供氢能力,通过氢原子或电子转移的方式与DPPH自由基发生中和,以达到清除的目的[17]。

表2 乳酸菌的超氧阴离子和DPPH自由基清除能力Table 2 The superoxide anion and DPPH radical scavenging ability of lactic acid bacteria
2.1.3 耐受过氧化氢能力的测定结果
耐受过氧化氢能力是衡量乳酸菌抗氧化能力的指标之一,过氧化氢与超氧阴离子对细胞有较强的毒害,有加速细胞的衰老过程甚至杀死细胞的作用[18],因此乳酸菌应具备一定的过氧化氢耐受能力。选择2.1.2中还原能力、羟自由基、超氧阴离子自由基、DPPH自由基清除能力都较强的菌株MRS2、MRS5、MRS12、SL1、LBS8、LBS9、M2、MC2、MC6、E5进行过氧化氢耐受能力分析,见表3。
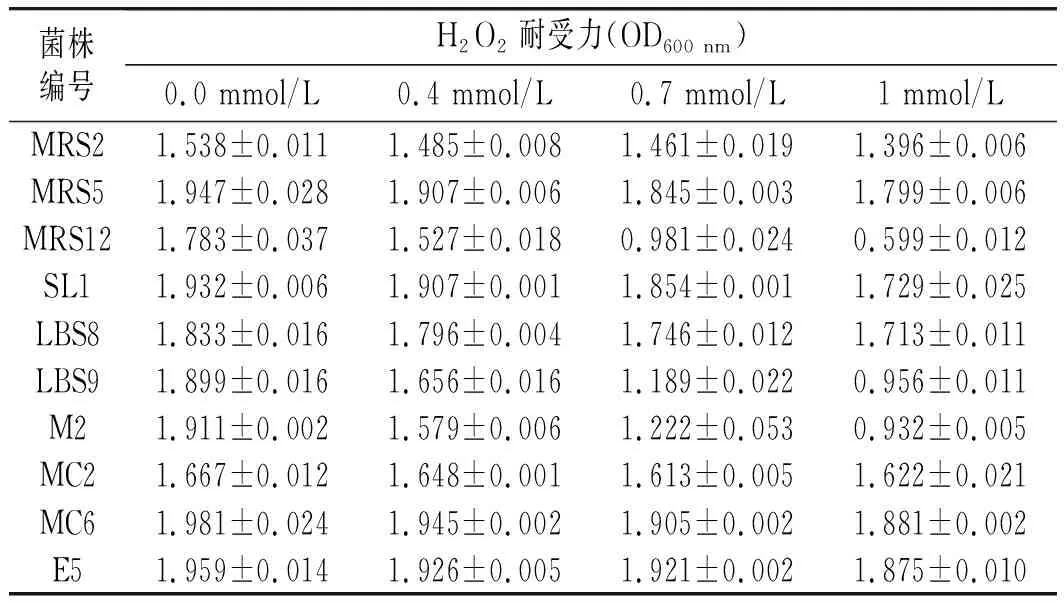
表3 乳酸菌耐受不同浓度过氧化氢能力Table 3 The resistant ability of lactic acid bacteria to different concentration of hydrogen peroxide
由表3可知,在不同H2O2浓度中培养24 h后,随着H2O2浓度的增加,菌体浓度均呈下降趋势,10株菌株中,MRS12、LBS9、M2在1 mmol/L H2O2的环境中生长受到较大影响;其余7株菌在0~1 mmol/L H2O2的环境中生长良好。原因可能是这8株菌分泌有机酸、细菌素或过氧化氢等抗氧化性物质能力较强,使得乳酸菌对过氧化氢的耐受性较强[19]。
2.2 乳酸菌通过胃肠通道存活能力的检测
2.2.1 菌株耐受pH 2、pH 3的能力
人的胃液pH通常为3左右,若在pH 3的条件下培养2 h后活菌数依旧高于6 log CFU/mL,菌株即可正常发挥其功能作用。
由表4可知,选择耐受过氧化氢能力较强的7株菌在pH 3条件下处理180 min后,菌数均高于6.5 log CFU/mL,说明菌株在pH 3的条件下存活良好。在pH 2的条件下,仅有菌株MC2和MRS2的生长受到了严重的影响,在培养到60 min时,其活菌数分别为2.78 log CFU/mL和2.54 log CFU/mL。菌株LBS8、MC6、MRS5、SL1的活菌数均大于6 log CFU/mL,说明这4株菌能耐受pH 2的生长环境。

表4 不同pH对乳酸菌生长的影响Table 4 The effect of pH values on the growth of lactic acid bacteria log CFU/mL
2.2.2 菌株的胆盐耐受力
乳酸菌对胆盐的耐受力越高,说明其在肠道中的存活能力越强。各组乳酸菌对不同浓度胆盐耐受能力的变化见表5。

表5 不同胆盐浓度下乳酸菌的耐受能力变化Table 5 The resistant ability of lactic acid bacteria under different concentration of bile salt
由表5可知,随着胆盐浓度的增加,乳酸菌的生长受到一定的抑制。在胆盐浓度为0.1%的条件下,乳酸菌的胆盐耐受力均大于58%;在0.3%胆盐浓度下,菌株LBS8、MC6、MRS5和SL1的胆盐耐受力高于50%;在0.5%胆盐浓度下,大部分菌株的生长均受到了抑制,而菌株LBS8、MC6、MRS5和SL1仍能存活,可见其胆盐耐受能力较强。
2.2.3 乳酸菌对人工胃液和肠液的耐受能力分析
人体胃蛋白酶在酸性环境中被激活,杀死进入胃中的细菌,因此乳酸菌能通过胃肠道是发挥其功能特性的前提条件[20]。
由表6可知,在人工胃液中处理3 h后,各株乳酸菌的菌数均呈下降趋势。其中菌株MC2的生长受到明显的抑制,存活率低于40%。其余6株菌在pH 3的人工胃液环境中均有一定的耐受能力,其中菌株MRS2和MC6对胃液的耐受能力较强,大于90%。经过人工肠液处理4 h,除菌株MC2、MRS2以外,其他菌株存的活率较好,SL1、LBS8和E5能达到60%以上。

表6 乳酸菌在人工胃液和肠液中活菌数测定结果Table 6 The determination results of viable lactic acid bacteria number in artificial gastric fluid and intestinal fluid
2.3 16S rRNA分子生物学鉴定及系统发育树构建
综合比较2.2中7株菌的功能特性,选择各功能特性都较强的4株菌LBS8、MRS5、MC6、SL1进行了分子生物学鉴定,结果见图1。

图1 基于16S rRNA基因序列构建的系统发育树Fig.1 The phylogenetic tree constructed based on 16S rRNA gene sequence
由图1可知,菌株LBS8与Lactobacillusplantarumstrain KM4(MN493118.1)聚类在一起,同源性为100%,菌株MRS5与Lactobacillusplantarumstrain GV418(MN686265.1)聚类在一起,同源性为99%,因此这两株菌鉴定为植物乳杆菌(Lactobacillusplantarum),MC6与Lactobacillusparaplantarumstrain LABD15(MK758083.1)的同源性为98%,因此被鉴定为副植物乳杆菌(Lactobacillusparaplantarum),SL1 与Lactobacillusparacaseistrain 1601(MN795083.1)的同源性为100%,被鉴定为副干酪乳杆菌(Lactobacillusparacasei)。
3 结论
以川西彝族酸菜样品中分离得到的40株疑似乳酸菌为出发菌株,分别对其无细胞提取物与菌悬液的还原力、羟自由基清除能力、超氧阴离子自由基清除能力、DPPH自由基清除能力及H2O2耐受能力进行检测,筛选得到7株抗氧化能力较强的菌株。其中,菌株LBS8、MC6、MRS5、SL1分别在pH 2、pH 3和0.3%、0.5%胆盐环境中培养24 h后仍能存活,且经人工胃液和肠液处理后,存活率均大于50%,各功能特性都较好。经16S rRNA基因同源性分析,确定菌株LBS8、MRS5为植物乳杆菌,菌株MC6为副植物乳杆菌,菌株SL1为副干酪乳杆菌。本研究所筛选的益生性乳酸菌菌株为其应用于彝族酸菜或进一步开发新型营养健康食品,所筛选的乳酸菌菌株具有一定的益生特性,并有发酵彝族酸菜或进一步开发新型营养健康食品的潜质。
