大豆蛋白凝胶性及其改良方法的研究进展
2021-08-09蔡燕萍游寅寅刘建华邱月吕飞丁玉庭
蔡燕萍,游寅寅,刘建华,邱月,吕飞,丁玉庭
(浙江工业大学 食品科学与工程学院,浙江 杭州,310014)
大豆是自然界中蛋白质含量最丰富的植物性食品,也是居民膳食中优质蛋白质的来源。近年来在食品加工领域中利用植物蛋白,特别是大豆蛋白代替动物蛋白的应用受到了广泛的关注。首先,大豆蛋白作为一种高质量的植物蛋白质具有较高的营养价值,其氨基酸组成与人体必需氨基酸组成相似,并且不含胆固醇,可作为动物蛋白的低成本替代品[1]。其次,与动物蛋白相比,大豆蛋白具有较高的生产效率、较低的能耗和碳排放量[2],对环境的污染小,为食品产业的发展提供了更多的可能性。不仅如此,大豆蛋白还具有优良的功能特性,如:凝胶性、溶解性、乳化性、起泡性等。其中凝胶性是最重要的特性之一,它是指大豆蛋白分子经热处理而解聚,未折叠分子通过二硫键、氢键、疏水和/或范德华力相互作用发生不可逆地排列和聚集,形成三维凝胶网络结构的现象[3]。它赋予大豆蛋白较高的黏性、可塑性和弹性,在产品应用中既能做水的载体,也可做糖、脂质及功能因子的载体,这对食品加工极为有利。
尽管大豆蛋白凝胶用于食品加工已有多年历史,但由于大豆蛋白是一种球蛋白,其聚集的驱动力多以物理相互作用为主,如疏水相互作用、静电相互作用、氢键等,其聚集体结构无序、凝胶强度不足、二硫键含量较低,因此制得的大豆蛋白凝胶制品口感粗糙、风味不佳、结构松散[4]。近年来研究人员对大豆蛋白的分子结构及凝胶特性进行了大量研究,发现不同的蛋白组成及环境条件通过对蛋白变性展开程度、聚集速率和稳定性等产生影响,从而对大豆蛋白凝胶形成产生较大的影响,使得大豆蛋白形成结构各异的凝胶网络[1]。因此可以采用物理、化学或生物技术对大豆蛋白凝胶性进行改良,以获得具有不同性质的大豆蛋白凝胶。本综述从大豆蛋白凝胶形成机理出发,对大豆蛋白凝胶形成的影响因素及其凝胶性的改良方法进行了深入地探讨,为拓宽大豆蛋白凝胶的应用范围以及大豆蛋白凝胶制品的开发和应用提供更多的可能性。
1 大豆蛋白凝胶
大豆蛋白凝胶可以定义为蛋白分子变性展开从而聚集的现象,在聚集过程中,吸引力和排斥力处于平衡状态,从而可以形成能保持大量水分的高度有序的三维网络结构或基体。如果吸引力大于排斥力,则形成凝胶网络,水分从凝胶基体排出;反之,如果排斥力大于吸引力,则难以形成凝胶网络。
1.1 大豆蛋白凝胶形成方法及类型
根据蛋白质浓度的高低,大豆蛋白凝胶形成方法主要分为两类:当蛋白浓度高时,蛋白体系加热冷却后便可凝固形成大豆蛋白热致凝胶;而当蛋白浓度较低时,则需要向蛋白体系中添加凝固剂,改变体系pH值或离子强度,进而形成大豆蛋白非热致凝胶。
1.1.1 热处理
热处理是大豆蛋白凝胶形成的方法之一,是促使变性蛋白分子去折叠和亚基重排的关键因素。首先,热处理使蛋白质亚基发生解离、疏水基团暴露,从而促进了大豆蛋白凝胶的形成。其次,热处理不仅诱导蛋白凝胶颗粒的形成,还决定了这些颗粒的特性。当蛋白质经过适当的热处理时,凝胶强度会达到一个峰值,此时蛋白质发生变性,蛋白质三、四级结构展开,蛋白质分子之间以及蛋白质与界面之间的相互作用力发生改变,从而使得蛋白质聚集;而过度热处理不仅不利于蛋白凝胶的形成,还会导致大豆蛋白过度变性形成不溶性凝胶[5]。
大豆蛋白中大豆球蛋白(11S)的变性温度为85~95 ℃,而β-伴大豆球蛋白(7S)较低,约为65~75 ℃[6]。随着热处理温度的变化,11S的变性程度对大豆蛋白凝胶的硬度和持水力有显著影响,而7S在相同的温度范围内对其没有显著影响。随着热处理温度的升高,7S形成可溶性聚集体,产生有限的“单体”聚集,而11S由于聚集体之间的结合形成不溶聚集体(图1)[7]。当同时处理7S与11S时,覆盖11S聚集体表面的物质不再是一个疏水残基,而是被7S的亲水性基团占据,从而导致聚集体之间的聚集终止。由于7S的存在,颗粒的生长也受到限制。在这种情况下,分散体中形成可溶性聚集体而不是不溶性聚集体。

图1 pH 7.0时,β-伴大豆球蛋白和大豆球蛋白的热聚集行为
1.1.2 凝固剂
在食品加工过程中,通常会通过添加凝固剂来促进大豆蛋白凝胶网络的形成。凝固剂的种类、用量及添加方式对大豆蛋白凝胶形成速度影响较大,缓慢的凝胶过程有助于形成高弹性的蛋白凝胶网络,而凝胶速度过快则容易产生沉淀[8]。一般来说,大豆蛋白凝固剂分为3类,酸类凝固剂、盐类凝固剂以及酶类凝固剂(表1)。

表1 凝固剂的分类及作用原理
1.2 大豆蛋白凝胶形成机理
目前研究人员较为认同的蛋白质聚集的机理是由ANDREWS等[12]提出的LENP(Lumry-Eyring nucleated polymerization model)动力学模型。该模型包含5个阶段,如图2所示,①变性展开:蛋白质受外界条件的影响,变性展开后蛋白分子三级结构被破坏,分子内部疏水基团暴露,二硫键等次级键断裂,肽链之间散开随机排列;②寡聚体的形成:暴露的各基团通过二硫键、氢键、疏水相互作用、静电相互作用以及范德华力的作用下相互靠近达到平衡,形成可逆的寡聚体,作为蛋白质聚集的预核心;③成核:寡聚体间进一步发生不可逆的聚集,形成聚集体核心;④聚合:变性蛋白质和聚集体核心在化学作用力下相互连接,形成更大的聚集体;⑤凝聚:聚集体间进一步结合,形成分子质量更大的凝聚体。当蛋白质形成聚集体后,将水、脂肪等成分包埋其中,从而进一步形成蛋白凝胶网络结构。

图2 蛋白质聚集的LENP动力学模型
2 大豆蛋白凝胶形成的影响因素
2.1 蛋白组成及浓度
大豆蛋白含有多种结构的蛋白质,根据其沉降系数主要分为2S、7S、11S和15S。在这4种蛋白质中,大豆7S和11S球蛋白是大豆蛋白的主要组分,约占总含量70%以上,且与大豆蛋白的功能性质密切相关。其中,7S球蛋白主要由α′、α和β亚基组成,巯基和二硫键的含量较少[13],其凝胶形成主要是通过加热过程中氢键的作用[9]。因此7S球蛋白具有较好的保水性、柔软性、溶解性和附着性,主要对大豆蛋白凝胶弹性产生影响。而11S球蛋白由酸性亚基A和碱性亚基B通过二硫键连接在一起[14]。其凝胶形成主要是通过二硫键和静电相互作用,在加热形成凝胶过程中,容易发生聚合、高分子化,因此对大豆蛋白凝胶硬度产生较大影响[15]。
大豆蛋白凝胶强度和大豆蛋白浓度呈正相关。当蛋白浓度高时,其变性聚集和凝胶过程同时发生,蛋白质间相互作用较强,加热后冷却便可形成凝胶[16];而蛋白浓度较低时,蛋白质变性聚集和凝胶过程被分开,此时蛋白质-溶剂的相互作用占主导,加热冷却后只能形成蛋白聚集体或者沉淀,因而需要通过添加凝固剂,改变蛋白体系的pH值或离子强度,进而形成凝胶[17]。WANG等[18]也报道经100 ℃预热改性30 min后,低浓度(1%、2%和4%)大豆蛋白凝胶能力较弱,而高浓度(6%)大豆蛋白凝胶能力较强。
2.2 热变性程度
热变性是大豆蛋白形成凝胶的前提之一,它直接影响了蛋白质表面疏水性,蛋白的表面疏水性越大越利于凝胶网络的形成。蛋白质的二级结构决定了蛋白质的表面疏水性,其表面疏水性与β-转角和无规则卷曲的相对含量呈正相关,而与α-螺旋和β-折叠的相对含量呈负相关。表面疏水性影响凝胶的形成,同时凝胶形成的外在因素又影响着蛋白的表面疏水性。天然蛋白质的疏水基团在内部,而亲水基团位于蛋白质表面[19]。随着热量的增加,大量的疏水基团暴露在表面,显著地增加了蛋白质表面疏水性,从而更有利于凝胶网络的形成[20]。
适当的热变性使大豆蛋白具有较好的凝胶特性[21]。大豆蛋白热变性程度过低会导致大豆蛋白中的肽链无法很好地展开,从而无法形成稳定的凝胶网络结构;而热变性程度过高则会使大豆蛋白形成不溶性聚集体,最终导致大豆蛋白无法形成较好的凝胶网络结构。因此,在制备过程中要保证大豆蛋白的热变性在一定的范围内,以确保大豆蛋白凝胶网络的形成。
2.3 pH值
pH值的改变会影响蛋白质分子的离子化作用和净电荷值,从而改变蛋白质分子间的吸引力和排斥力以及蛋白质分子与水分子结合的能力,进而影响凝胶形成和维持的作用力。在碱性条件下,大豆分离蛋白(soybean protein isolate,SPI)的溶解速率较大,且随着pH值增大溶解速率也随之增加[13]。而pH值降低到蛋白质等电点时,蛋白质分子和水分子之间的相互作用最小,所带净电荷也非常少,导致多肽链相互靠拢,形成不同大小的聚集体,从而形成不同强度的凝胶[9]。CHEN等[22]在pH分别为5.8、6.0、6.2、6.4、6.8条件下,对SPI进行95 ℃热处理30 min,发现蛋白质热聚集的大小和密度会随着pH的增大而减小。
2.4 离子强度
离子强度影响蛋白质中氨基酸残基的解离状态和电荷分布,改变蛋白分子之间的静电相互作用,从而影响蛋白凝胶形成。当盐离子浓度较低时,蛋白质易于溶解,此时蛋白分子间的相互排斥力大于吸引力,虽能形成凝胶,但凝胶强度低;随着盐离子浓度的增加,盐离子会对蛋白质表面的电荷产生屏蔽作用,并破坏蛋白质表面的水化层,增强蛋白质表面疏水作用,减小分子间排斥力,使蛋白质分子之间更易发生聚集,从而增强凝胶强度[23]。离子强度也会影响蛋白的分子质量分布和粒径大小,当离子强度从0增大时,SPI的聚集速率显著提高,从而得到粒径更大、溶解度更低的聚集体,而聚集体含量的多少对大豆蛋白凝胶形成的影响较为显著,因此可以通过调整离子强度来控制聚集体的含量,进而提高蛋白的凝胶性[24]。
2.5 油体
大豆中的脂质主要以油体的形式存在,油体可看成一种天然的乳化油滴粒子,其表面是一层蛋白质-磷脂膜,可将外界与核心的中性脂质隔开。膜上的蛋白质称为油体蛋白,加热后会发生不同程度的解离,进而影响大豆蛋白凝胶的性质。
在加热过程中,外部的蛋白质附着物逐渐从油体表面分离出来,导致油体被释放到大豆蛋白溶液的漂浮部分,7S中β亚基和11S的B亚基聚集形成颗粒蛋白,而7S中α、α′亚基和11S中的A亚基保留在可溶性部分中,油体表面先结合蛋白质聚集体或可溶性蛋白,形成一个小的团簇,然后这些小团簇之间相互作用形成大豆蛋白凝胶网络结构,如图3所示[20]。热处理后,油体无法完全释放到漂浮部分中,可能是因为油体蛋白和大豆球蛋白之间存在相互作用,从而使油体被颗粒蛋白所包裹[25]。
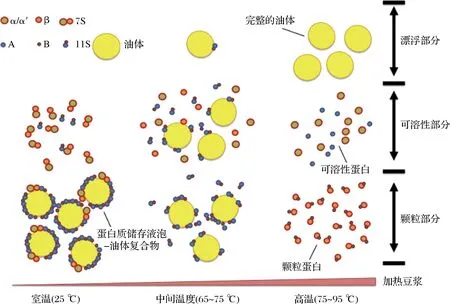
图3 加热大豆蛋白溶液时油体与蛋白的反应情况
2.6 植酸盐
植酸盐作为成熟大豆中的主要磷储备,对大豆蛋白凝胶形成有重要影响。植酸盐独特的电荷、结构特性及螯合能力,在加热过程中通过静电吸引作用与7S的α/α′亚基和11S的A亚基竞争11S的B亚基上的碱性氨基酸。其竞争性结合在一定程度上抑制了α/α′亚基和A亚基的结合,导致颗粒蛋白数量和平均粒径减小,同时使颗粒蛋白质表面ζ电位增大,这意味着植酸与蛋白质之间的结合反应可以提高大豆蛋白凝胶稳定性,图4为大豆蛋白热变性过程中植酸与蛋白结合的机理[26]。植酸盐在大豆蛋白凝胶过程中起着重要的缓冲作用,蛋白质交联变慢,从而使凝胶呈现出更致密的凝胶网络、更柔软的结构和更高的保水能力[23]。
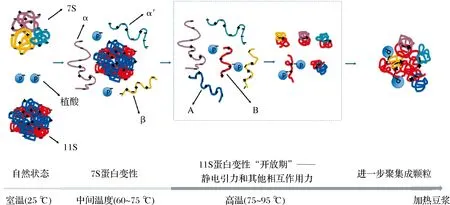
图4 大豆蛋白热变性过程中植酸与蛋白结合机理的预测
3 大豆蛋白凝胶性的改良方法
由于大豆蛋白是球蛋白,其结构保守,聚集的驱动力主要是疏水作用、氢键等物理相互作用,聚集体结构无序且凝胶强度不足,使得制备的大豆蛋白凝胶易出现弹性较差和结构松散的现象,因此可以通过物理、化学、生物等方法改变其中一个或多个影响因素,从而得到不同性质的大豆蛋白凝胶。
3.1 物理改良
3.1.1 超声处理
超声处理的主要工作原理是“空化效应”,通过空化和高剪切能波可促使蛋白质分子展开和部分变性,使蛋白质表面活性位点暴露,从而增强大豆蛋白质在后续加工中的热诱导聚集和凝胶化行为[27]。HU等[28]研究发现超声波可以调控SPI聚集体的结构,通过改变聚集体的粒径、表面疏水性、自由巯基含量等,改变蛋白质间的二硫键、疏水作用等化学作用力,进一步制得理化性质各异的大豆蛋白凝胶。与未经超声波处理相比,超声波处理获得的大豆蛋白凝胶得率、硬度和持水力都有一定的提高[29]。刘冉等[30]曾报道当超声功率在200~600 W的中功率下处理SPI,可以加速凝胶形成,并显著改善SPI凝胶性能;且400 W超声组效果最佳,所形成的凝胶具有最大的储能模量(G′)和损耗模量(G″)。
3.1.2 高压处理
高压处理是一种有效且安全的物理方法,可以改变蛋白质的结构和自组装特性。压力可引起蛋白质变性、聚集和凝胶化,从而改变其性质[31]。高压也可以让蛋白适度的变性,二级结构进一步展开,从而增加凝胶强度。大豆蛋白中7S的高压变性发生在300 MPa,而11S的高压变性发生在400 MPa。高压处理也可以与热处理结合,从而增强大豆蛋白凝胶特性。ZUO等[32]得出相比传统蒸煮方法,经高温高压蒸煮后,大豆蛋白凝胶网络中蛋白颗粒含量增加,形成更为致密的凝胶网络。因此,包括硬度,咀嚼性和弹性在内的凝胶质构特性均得到了显著改善。
3.1.3 多糖
多糖对形成致密的蛋白网络结构和提高食品系统的凝胶强度也有积极作用,可以显著改善蛋白质凝胶的功能特性[33]。近年来,多种多糖被用于大豆蛋白-多糖复合凝胶的形成,蛋白质和多糖的协同作用使得凝胶功能多样化,扩大了其应用范围。常见的蛋白-多糖复合凝胶大多是由蛋白作为基质、多糖作为填充物,通过氢键、范德华力及疏水相互作用等形成多重蛋白网络结构,有效地改善凝胶网络结构[34]。表2为不同多糖促进大豆蛋白凝胶的作用原理。

表2 不同多糖促进大豆蛋白凝胶的作用原理
3.1.4 蛋白
单独的大豆蛋白凝胶性质较为单一,且具有一定的局限性,可将多种蛋白质复合从而拓宽大豆蛋白凝胶的使用范围并增强其功能。杨娟等[39]在大豆蛋白溶液中添加质量比为4∶1的蛋清蛋白溶液,研究得出利用蛋清蛋白作为大豆蛋白热致凝胶过程中游离巯基的供体,复合体系可形成更多二硫键,在提升硬度的同时,增加其持水性,使得蛋白凝胶具有良好的质构特性。
3.1.5 脂质
脂质在一定程度上也有助于大豆蛋白凝胶网络的形成,适量的脂质会增加大豆蛋白的凝胶特性,而过多或过少的脂质添加量都会造成凝胶性质的减弱。NINGTYAS等[40]研究了不同脂肪及其浓度对GDL酸诱导SPI凝胶的影响。在所有的凝胶中,将无水乳脂添加至大豆蛋白时,凝胶G′最大,其次是棕榈硬脂和大豆油。表明脂质作为填充剂会影响SPI凝胶的硬度和凝胶性能。李菊芳[41]将磷脂添加到大豆蛋白粉中制成凝胶,结果表明,磷脂的复合对凝胶硬度、内聚性、弹性均产生重要影响。当磷脂与蛋白以1∶100的比例复合后,大豆蛋白颗粒表面负电荷增加,颗粒间斥力增强,从而增强了蛋白质与水之间的作用,使得体系剪切变稀;而随着复合磷脂量继续增加,达到1∶1时,蛋白之间的相互作用最强,此时体系变为黏塑性。且大豆蛋白与磷脂的结合程度受组分蛋白7S和11S相对含量的影响,其中11S含硫氨基酸含量较高,与磷脂的结合能力高于7S,凝胶特性也较好。
3.2 化学改良
3.2.1 盐
盐对大豆蛋白的影响主要是通过改变体系的pH值和离子强度。NaCl会促使大豆蛋白更快地发生热聚集和凝胶化[42]。增加离子强度相当于减少蛋白质的净电荷密度,即降低pH值至等电点。研究表明在低Na+浓度(10~20 mmol/L)下,通过盐析作用可以提高凝胶的硬度、保水性、热稳定性和结晶度,而在较高Na+浓度(30~40 mmol/L)下,则会降低凝胶的硬度、持水力和热稳定性[43]。
3.2.2 肽或蛋白水解物
肽或蛋白水解物可以改变蛋白质聚集性和凝胶特性[44],肽和蛋白质之间主要通过非共价相互作用实现特异性结合。WANG等[45]在加热条件下,加入玉米蛋白水解液对SPI稳定乳液的结构进行改性,研究发现玉米蛋白水解液中的肽与SPI之间发生疏水作用,从而诱导SPI的热聚集,当玉米蛋白水解肽与SPI质量比从0.3∶1逐渐增加至1.0∶1后,混合体系由流动状态变为半固态。因此得出,通过加入玉米蛋白水解液可以调节SPI乳液的黏度、黏弹性和触变性能。
3.2.3 糖基化
糖基化反应是一种通过美拉德反应形成的葡糖胺重排,被广泛用来改善蛋白质功能特性。SPI与糖发生美拉德反应,会消耗SPI的氨基,同时引入羟基的糖链,改变其亲水基团与疏水基团数目,从而改变其功能性质。潘男等[46]研究发现在适当的糖基化改性条件下,SPI凝胶质构特性呈现先升高后下降的趋势,当SPI与葡萄糖质量比为1∶1时,70 ℃下反应6 h所得产物的硬度达到最大,是未改性SPI硬度的7.51倍,相同比例底物在70 ℃反应4 h所得产物的弹性最大,比天然SPI的弹性提高了8.16%。GAN等[47]利用酶改性使SPI发生美拉德反应,获得的凝胶强度和黏弹性均得到了提高。
3.3 生物改良
3.3.1 酶
蛋白酶水解会破坏肽键,这可能导致蛋白质二级和三级结构发生变化,伴随蛋白质的部分展开以及分子内疏水基团和部分氨基酸的暴露。因此,除了分子质量明显降低外,酶处理会增加蛋白质疏水基团的可用性和可电离基团的数量[48],而这通常有利于聚集的相互作用的发生。根据酶解后蛋白质分子质量的范围和酶解程度,可将蛋白酶解过程分为轻度酶解(约90%的多肽分子质量>5 000 Da)、中度酶解(约46%的多肽分子质量>5 000 Da)及深度酶解(90%的多肽分子质量<500 Da)3类。
其中,限制性酶解(轻度或中度酶解)与SPI凝胶性能密切相关,这主要因为凝胶的形成取决于蛋白分子间的相互作用,而过高的水解程度可能导致蛋白质之间的相互作用减小、水解物表面疏水性降低和/或水解肽之间电荷排斥力增加,降低酶解蛋白的凝胶能力;反之,适当的水解程度有利于肽链中反应位点的暴露,从而增加蛋白分子间相互作用的可能性。用菠萝蛋白酶制备的大豆蛋白水解物具有良好的胶凝性能和良好的乳化活性[49]。研究发现漆酶也可在大豆蛋白及甜菜果胶之间形成共价共轭,在热处理和漆酶催化作用下,可以制备出交联、互穿的双网络凝胶。通过调整漆酶用量,可以优化双网络凝胶的形成条件[33]。
3.3.2 菌种发酵
近年来,研究人员还发现在发酵过程中乳酸菌能够形成乳酸,可降低体系的pH值,从而促使蛋白质变性聚集形成凝胶。大豆乳清分离乳酸菌的发酵过程中,体系pH值随时间的延长而降低,且发酵16 h的大豆乳清更适合作为大豆蛋白凝固剂[50]。YANG等[51]也发现嗜酸乳杆菌、植物乳杆菌、干酪乳杆菌、保加利亚乳杆菌和嗜热链球菌(1∶1)的混合菌株具有高凝结能力,其发酵过程中蛋白的聚集和结构变化显著提高了大豆蛋白凝胶的硬度和保水能力。
4 结论与展望
综上所述,天然大豆蛋白作为一种优质植物蛋白被广泛用于食品加工,但由于其凝胶强度较差,极大地限制了其在凝胶类食品中的应用。近年来,基于大豆蛋白分子结构,通过物理、化学、生物等改良方法提升大豆蛋白凝胶特性的相关研究已取得了长足的进展,但仍或多或少的存在改性工艺相对复杂、效果有限或产品得率低等问题,相关的机制研究也有待进一步深入。另一方面,目前的改性手段大多停留在调整凝胶环境水化学特性和蛋白分子层面,而最新研究表明,不同品种的大豆,其蛋白亚基组成差异往往会对其加工和营养特性产生较大影响,如何针对不同品种特性从蛋白亚基水平进行凝胶性改良,使大豆产业实现类似小麦的“专种专用”,仍然需要大量的研究工作。在实际生产中,如杀菌等加工工艺往往也会对大豆蛋白凝胶特性产生较大影响,而目前绝大多数凝胶特性改良研究并未充分考量这些因素。此外,尽管凝胶性是大豆蛋白最为重要的特性之一,然而在食品加工中往往并不是单一依赖某一种特性,在改良凝胶性的同时,如何实现包括如起泡性、溶解性、乳化性等加工特性的平衡也是需要重点考虑的问题。因此,未来仍需进一步系统、深入地研究大豆蛋白凝胶性的相关机制和改良方法,为开发健康营养且具有优良感官品质的大豆蛋白食品提供理论基础。
