微波预处理和熟化对红米消化和理化特性的影响
2021-08-09张子敬朱璠孙娟李言钱海峰王立
张子敬,朱璠,孙娟,李言,钱海峰,王立
(江南大学 食品学院,江苏 无锡,214122)
随着消费者对健康的关注度越来越高,有色米的消费量逐年加大。由于富含蛋白质、氨基酸、维生素、微量元素及其他健康成分,红米逐渐引起了人们的关注[1]。与人们日常食用的精白米相比,红米具有降胆固醇、预防癌症[2]、抗炎及抗氧化[3]的作用,但也存在不易蒸煮、难消化等缺点,这大大限制了红米的推广应用。因此,人们主要通过高温流化、超声[4]、预蒸煮[5]等方法将红米部分熟化,在保留红米表皮中原花青素等健康成分的基础上提升红米的熟化度。
微波加热是一种利用微波的能量特征对物体进行加热的过程,可有效改变淀粉的凝胶化、耐酶性及淀粉的有序结构和分子结构[6],具有产热快、成本低等优点[7],广泛应用于木薯、土豆[8]等的淀粉改性。近年来,人们将微波加热技术应用于杂粮的预处理,取得了较好的效果。研究表明,微波预处理可提高红芸豆的糊化度来增加其快消化淀粉含量[9];通过加快淀粉颗粒中水分子的快速交换来破坏支链淀粉微晶束,从而降低燕麦和高粱中淀粉的结晶度[10]。
对于红米的预处理,过去的研究主要集中在高压蒸煮、高温流化等常规方式,尚未有研究报道微波预处理对红米理化性质的影响。本研究以红籼米为研究对象,探究了一种新型微波预处理工艺对其理化性质的影响。此外,本研究还采用不同熟化方式对微波预处理红米与未处理红米进行比较分析,从淀粉结晶性和糊化特性等方面探究其体外消化特性的差异。
1 材料与方法
1.1 材料与仪器
红米,宇顺高科种业股份有限公司;总淀粉测定试剂盒、葡萄糖氧化酶/过氧化物酶(glucose oxiolase/peroxidase,GOPOD)试剂盒,爱尔兰Megazyme国际有限公司;猪胰α-淀粉酶,西格玛奥德里奇贸易有限公司;α-淀粉转葡萄糖苷酶,山东隆大生物工程有限公司;胃蛋白酶、其他试剂(分析纯),国药集团化学试剂有限公司。
M1-L236A微波炉,广东美的电器股份有限公司;HC-800Y磨粉机,浙江武义海纳电气有限公司;Y-50K3电饭煲、JYC-21HECO5电磁炉,山东九阳股份有限公司;LGJ-10冷冻干燥机,北京四环科学仪器厂有限公司;IC-B3501电饭煲,广东太古电器科技有限公司;H1650离心机,湖南湘仪实验室仪器开发有限公司;D2 PHASER X-射线衍射仪(X-ray diffractometer,XRD),德国布鲁克AXS有限公司;RVA 4500快速黏度分析仪(rapid viscosity analyzer,RVA),波通澳大利亚公司。
1.2 红米的预处理和熟化
1.2.1 预处理红米的加工
红米在体积比1∶3的50 ℃蒸馏水中浸泡30 min,取出沥干,微波800 W处理90 s;取出用10~25 ℃水浸泡10 s(红米浸没在水中),取出沥干,微波800 W处理90 s;此过程再重复2次,取出室温冷却,-20 ℃保存待用。
将上述预处理后的红米磨粉,过100目筛,-20 ℃储存待用。
1.2.2 熟化红米的加工
常压煮或高压煮红米的处理步骤如下:分别取100 g样品红米,各加蒸馏水200 g,置于常压或高压电饭煲中,以标准米饭蒸煮程序运行至结束。
常压蒸红米的处理步骤如下:取蒸锅加水置于电磁炉上加热,待水烧开,取100 g红米加蒸馏水200 g置于不锈钢容器中并将其置于蒸锅上层,以电磁炉自带的蒸米程序蒸40 min。
将蒸煮好的米饭放入-80 ℃冰箱冷冻,然后用冷冻干燥机干燥24 h,磨粉,过100目筛,-20 ℃储存待用。
1.3 实验方法
1.3.1 红米的淀粉体外模拟消化
红米的淀粉体外模拟消化参照CHUSAK等[11]的方法并稍作修改。取3 g猪胰α-淀粉酶(10 U/mg)于100 mL锥形瓶中,加入蒸馏水60 mL,37 ℃水浴振荡活化10 min,4 000 r/min离心10 min,取上清液,加α-淀粉转葡萄糖苷酶150 μL(200 000 U/mL),记为混合酶液A。取1 g(干基)待测试红米样品加入50 mL离心管中,加入10 mL pH 2的盐酸,均质30 s,37 ℃预热5 min。胃模拟阶段:立即加入0.3 mg胃蛋白酶(1 200 U/g)于离心管中,37 ℃水浴振荡30 min。小肠模拟阶段:以100 μL pH 14的NaOH溶液中和消化液中的盐酸,然后加入25 mL pH 6的磷酸缓冲液,搅拌均匀,加入5 mL混合酶液A,立即在37 ℃下以90 r/min水浴振荡2 h。分别在胃模拟消化的0及30 min,小肠模拟消化的20、40、60、80、100及120 min取0.1 mL消化液于0.9 mL无水乙醇中,12 000 r/min离心3 min。取0.1 mL上清液与3 mL GOPOD试剂充分混合,以0.1 mL蒸馏水+3 mL GOPOD试剂为空白,以0.1 mLD-葡萄糖标准溶液+3 mL GOPOD试剂为对照,50 ℃水浴20 min,于510 nm波长下测吸光值,淀粉水解率按公式(1)计算。

(1)
式中:A样,样品吸光值;A标,葡萄糖标准液的吸光值;ρ标,葡萄糖标准液的质量浓度,mg/mL;V总,消化液的总体积,mL;f,稀释倍数;0.9,葡萄糖转化为淀粉的系数;m总淀粉;样品中淀粉的质量,mg。
1.3.2 淀粉消化动力学和评估血糖指数的测定方法
淀粉体外消化可以看做是一级动力学过程[12],消化曲线符合一级动力学形式[13],如公式(2)所示:
Ct=C∞(1-e-kt)
(2)
式中:Ct,消化时间为t时淀粉的水解量,%;C∞,消化终点淀粉的水解量,%;t,消化时间,min;k,一阶动力学常数,min-1。
淀粉消化曲线下面积的计算如公式(3)所示:
AUG=C∞(tf-t0)-(C∞/k){1-exp[-k(tf-t0)]}
(3)
式中:AUG,淀粉消化曲线下面积;tf,消化开始时间,min;t0,消化终止时间,min。
水解指数(hydrolysis index,HI)定义为:测试样品的水解曲线下面积与白面包的水解曲线下面积的比值。
评估血糖指数(evaluste glycemic index,eGI)按公式(4)计算[14]:
eGI=39.71+0.549HI
(4)
1.3.3 红米的溶胀力测定
参考WANG等[15]的方法对1.2.1及1.2.2制备的生熟红米粉进行溶胀力测定。称取40 mg红米粉于2 mL离心管中,加蒸馏水1 mL,分别在50~90 ℃下水浴30 min,期间颠倒混匀。样品水浴后迅速冷水冷却至室温,13 000 r/min离心15 min,倒掉上清液称量沉淀。溶胀力按公式(5)计算:
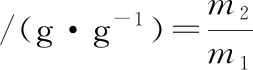
(5)
式中:m1,初始米粉的质量,mg;m2,水浴后溶胀米粉的质量,mg。
1.3.4 红米的结晶特性分析
参考WANG等[16]的方法对1.2.1及1.2.2制备的生熟红米粉进行淀粉晶体结构的测定。将米粉在相对湿度为75%(饱和NaCl溶液)的干燥器中室温平衡水分一周,利用XRD在电压40 kV,电流30 mA,射线源Cu-Ku源,波长0.154 nm的条件下扫描米粉样品,扫描速率为2°/min,范围为5~35°,步长为0.02°。所得图谱利用Jade 6进行处理,计算相对结晶度,如公式(6)所示:

(6)
1.3.5 红米的糊化特性测定
参考LEE等[17]的方法对1.2.1和1.2.2制备的生熟红米粉进行糊化特性测定,并进行一定修改。称量2.6 g样品(干基)置于RVA铝桶中,加水至28 g。测定程序为:红米粉在RVA中以50 ℃悬浮1 min,然后以12 ℃/min的速率加热至95 ℃(3.75 min),在95 ℃保持2.5 min,然后以12 ℃/min的速率降温至50 ℃,在50 ℃保持2 min。搅拌速率前10 s为960 r/min,然后以160 r/min保持至分析结束。测定完成后可以从RVA曲线上获得峰值黏度、谷值黏度、崩解值、最终黏度,回生值和糊化温度。
1.4 数据分析
每组实验重复3次。数据以平均值±标准差的形式表示,采用Origin 9.0软件进行数据统计分析和作图,用Jade 6软件处理XRD图谱,用SPSS软件进行显著性分析。
2 结果与分析
2.1 不同处理对红米淀粉体外消化的影响
以相同样品质量(干基)为基础,用体外模拟方法测定熟化后红米的淀粉消化率(图1)。对于所有样品,在胃模拟消化阶段均未观察到葡萄糖的释放,这可能是胃模拟阶段缺乏淀粉酶的作用造成的;而在小肠模拟消化的前20 min,淀粉水解度快速增高,随着时间的延长,淀粉水解度缓慢增加。对于原料红米,不同熟化方式处理后的最终淀粉水解率相似,没有显著性差异[18]。经熟化后,微波红米在小肠模拟消化的前20 min淀粉水解度高于原料红米;最终淀粉水解度均有一定程度提升,经高压煮后增加了14.77%,表明微波预处理对熟化后红米的淀粉水解具有显著性影响。此外,值得注意的是,尽管常压煮和常压蒸在处理时间上大于高压煮,但淀粉水解度增加最大的仍是高压煮,说明高压高温在增加微波预处理红米的淀粉水解度上更有效[19]。

a-常压煮;b-高压煮;c-常压蒸
通过对各红米样品的实验数据进行一级动力学数学模型拟合,得出各样品组的最大淀粉水解度(C∞)、水解速率(k)、水解指数(HI)和评估血糖指数(eGI)(表1)。6个样品组的C∞分别是74.2%、72.1%、76.8%、78.1%、85.4%及83.4%。其中,微波红米高压煮的C∞最高。k值越高,体外消化的速率越高。与原料红米相比,微波红米的k值均有所增加。所有样品组的eGI在80.8~89.1,这反映出它们均是高GI产品。此外,相比于原料红米,微波红米的eGI值均有所提升,具有显著性差异,这与淀粉体外消化的数据吻合。米粉中淀粉消化特性的差异可能是由不同加工导致的糊化差异造成的[20]。
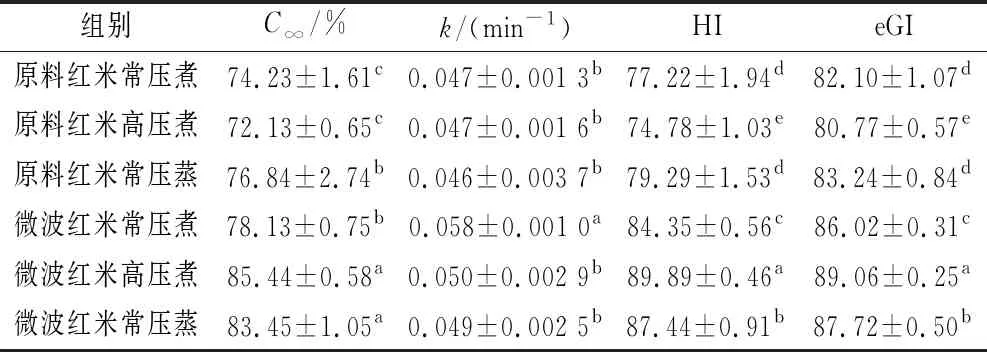
表1 由红米的体外模拟消化实验得到的消化动力学参数
2.2 不同处理对红米溶胀力的影响
原料和微波后红米粉的溶胀力随温度的升高而增加(图2-a)。当温度>70 ℃时,原料和微波后红米粉都显示出较高的溶胀力,这可能是由于淀粉糊化引起的淀粉结晶消散导致的[21]。随着微波次数的增加,红米粉的溶胀力降低。微波加热后米粉溶胀力的降低可能是由于淀粉颗粒中结晶区的重新排列更加无序导致的[22]。刘佳男[10]的研究表明微波预处理可以降低黑米中的支链淀粉含量,而淀粉的溶胀主要受支链淀粉的影响。
对于所有样品组,其溶胀力随温度的升高而增加。在熟化处理后,微波红米比原料红米拥有更低的溶胀力(图2-b)。这种显著性差异可能是因为对于经过熟化处理的2种样品,微波预处理样品的糊化程度更高,对淀粉颗粒结构的破坏更大,淀粉颗粒中结晶区的重新排列更加无序导致的。同时,淀粉颗粒中结晶区的消散降低了链堆积密度,促进了酶在淀粉颗粒中的扩散和酶分子与淀粉链的结合,从而增加了其淀粉消化率[20]。
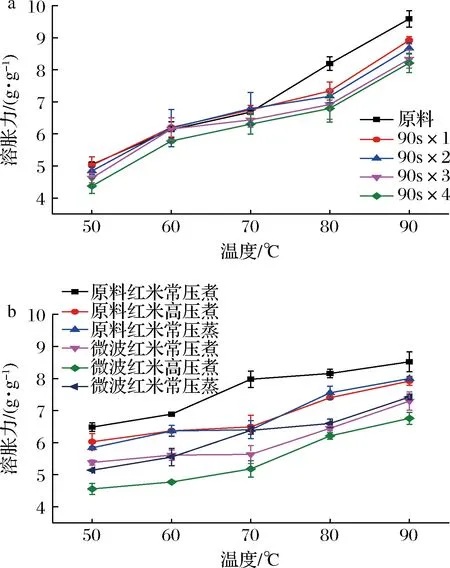
a-微波次数;b-熟化方式
2.3 不同处理对红米糊化特性的影响
使用RVA探究了微波预处理红米和熟化后红米粉的糊化特性(表2、表3)。与原料米粉相比,微波预处理红米粉的峰值黏度、谷值黏度、最终黏度和回生值随微波次数的增加而降低。此外,微波预处理红米粉的糊化温度随微波次数的增加而升高。这可能是由于预处理过程中淀粉颗粒的破坏导致淀粉吸水能力和膨胀能力降低引起的[18]。此外,微波预处理也会促进淀粉-脂质复合物的形成,导致糊化温度的升高和黏度的降低。
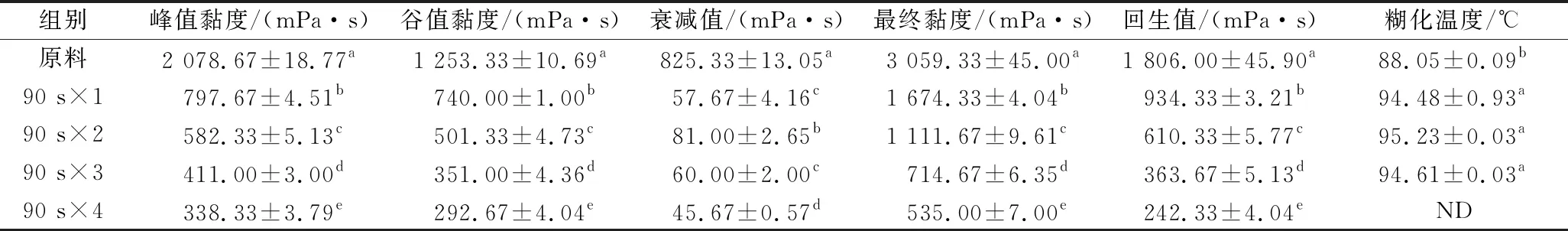
表2 微波次数对红米糊化特性的影响

表3 不同熟化方式对未预处理和微波预处理红米糊化特性的影响
与原料红米相比,微波红米经熟化处理后的峰值黏度、谷值黏度和最终黏度均较低。这可能是因为微波预处理已经极大地破坏了红米的淀粉颗粒完整性,降低了红米粉的峰值黏度、谷值黏度和最终黏度,进一步的熟化处理导致了其更低的糊化特性值。在3种熟化方式中,高压煮表现出更低的峰值黏度、谷值黏度和最终黏度,这可能是因为高压导致了分子有序性的减少及淀粉-脂质复合物与直链淀粉分子的缠绕,限制了淀粉分子的溶胀[23]。OYEYINKA等[22]的数据表明,米粉的峰值黏度和谷值黏度与稻米的熟化程度有关,随熟化程度的增高而降低。此外,一些数据表明,稻米的淀粉体外消化率与米粉的峰值黏度和最终黏度呈负相关,与糊化温度呈正相关[24]。
2.4 不同处理对红米结晶性的影响
所有样品的XRD图如图3所示。原料红米粉在衍射角为15、17、18及23°时均能观察到明显的衍射峰,说明红米淀粉的晶型为A型[25]。随着微波次数的增加,样品在15、17、18及23°的衍射峰逐渐减小,说明微波处理不会改变淀粉的晶型,但会破坏淀粉结晶(图3-a)。此外,随着微波次数的增加,在20°出现了脂质-淀粉复合物衍射峰。相比于常压煮和常压蒸,2种样品在经过高压熟化后的脂质-淀粉复合衍射峰更加明显,这与高压蒸煮比常压蒸煮更有利于淀粉-脂类复合物的形成相一致[26]。熟化后,微波红米的晶型衍射峰基本消失,而原料红米的结晶度分别为1.51%、1.36%和0.84%(图3-b、c、d),这可能因为微波红米在经预处理后淀粉结晶就已经基本消失。
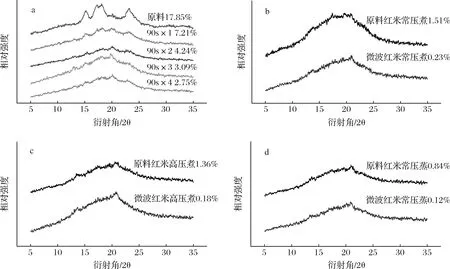
a-微波次数;b-常压煮;c-高压煮;d-常压蒸
微波预处理促进了红米淀粉的糊化,导致红米中淀粉颗粒和结晶的破坏、吸水和膨胀能力的下降,RVA和XRD数据均已经说明了这一点。因而,在经过相同的熟化处理后,微波红米表现出更高的熟化程度,这使得红米表现出更低的黏度,有利于淀粉体外消化过程中消化酶与底物的结合[27]。此外,微波和熟化的双重处理导致淀粉颗粒晶层中的螺旋排列减弱,结晶层发生一定断裂,这导致淀粉颗粒多尺度结构中链堆积密度的降低,进而促进了酶在淀粉基质结构中的扩散和酶分子与淀粉链的结合[28]。这也解释了经过3种熟化方式处理,微波预处理红米拥有更高的淀粉水解度的原因。
3 结论
微波预处理提高了熟化后红米的淀粉体外水解率,同时使红米粉的糊化特性和结晶特性发生了显著性变化,降低了红米粉的峰值黏度、谷值黏度、最终黏度和回生值,提高了糊化温度;显著降低了红米粉的淀粉结晶度和熟化后的溶胀力。熟化后,微波红米的淀粉结晶基本消散,而原料红米依旧残存些许淀粉结晶。结果显示,微波预处理可以有效提升红米的糊化度和熟化后的熟化程度,降低淀粉颗粒中链堆积密度,从而提升淀粉的体外消化率。
