治疗牙周炎的乳杆菌筛选及口腔益生特性评价
2021-08-09徐晚晴张秋香郑彦懿赵建新马方励
徐晚晴,张秋香*,郑彦懿,赵建新,马方励*
1(江南大学 食品学院,江苏 无锡,214122) 2(无限极(中国)有限公司,广东 江门,519000)
牙周炎是一种发生在口腔支持组织的感染性炎症疾病,通常伴随口臭、牙龈肿痛出血、牙齿松动、咀嚼功能紊乱等症状,同时也是成人牙齿缺失的首要原因[1]。越来越多的研究表明,牙龈卟啉单胞菌(Porphyromonasgingivalis)、具核梭杆菌(Fusobacteriumnucleatum)、中间普氏菌(Prevotellaintermedia)等牙周炎致病菌与多种全身疾病密切相关,如糖尿病、阿尔兹海默症、结肠癌等[2-3]。
牙周炎是多因素疾病,其中牙菌斑微生物及其产物是必不可少的始动因子,除此以外,牙周炎的发生还受其他局部刺激因素的影响和全身因素的调控[4]。宿主与牙周炎致病菌之间的相互作用很大程度上决定了牙周炎的发展与严重程度。牙龈卟啉单胞菌和中间普氏菌是目前公认的主要牙周炎致病菌。牙龈卟啉单胞菌可以侵入宿主细胞,释放多种毒力因子,从而促进骨质的吸收和破坏,影响病变牙槽骨重建[5-6]。而中间普氏菌通过直接侵袭口腔细胞、干扰宿主的免疫反应等方式造成牙周组织的破坏。除牙龈卟啉单胞菌和中间普氏菌外,在牙周炎患者病灶位点中也经常检测到具核梭杆菌[7]。具核梭杆菌能分泌多种凝集素,主导属内和属间的细菌黏附共聚,其在牙菌斑生物膜的形成和成熟过程中,起到了“桥梁”作用[8]。
除牙菌斑微生物的作用外,牙龈组织的损伤更多由机体产生的免疫反应引起[4]。虽然牙周组织被破坏的机制仍不完全明确,但随着对牙周炎发病机制的进一步了解发现,牙菌斑微生物及其代谢产物可以刺激宿主引发炎症反应,释放白细胞介素-1β(IL-1β)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)等多种炎症因子,引起牙周组织炎性损伤,最终导致牙槽骨丧失[8-9]。
目前治疗牙周炎的方法主要为机械疗法和药物疗法,但以牙周洁治术为主的机械疗法无法预防牙周炎的发生,且容易产生牙齿酸痛、张口疲劳等症状[10];而药物疗法治疗时间长,效果不明显,长期使用还容易破坏口腔微生态平衡[11]。因此,以乳酸菌为主的细菌替代疗法受到了越来越多的关注。乳酸菌通过代谢抑菌产物、竞争黏附致病菌所在位点、抑制致病菌的增殖和调节机体口腔免疫等,维持口腔微生态的平衡[12-13]。已有研究报道发酵乳杆菌、罗伊氏乳杆菌等益生菌在抑制口腔致病菌、降低生物膜量方面显示出的良好效果[14-16]。但乳杆菌对牙龈卟啉单胞菌、具核梭杆菌和中间普氏菌的混菌生物膜的抑制作用研究则鲜有报道。
本研究利用混菌生物膜模型和牙周炎细胞模型筛得2株具有抑制牙周炎生物膜形成,缓解口腔炎症,调控紧密连接蛋白表达的植物乳杆菌(Lactobacillusplantarum)CCFM1137和发酵乳杆菌(Lactobacillusfermentum)CCFM1139,并对其口腔益生特性进行评价。
1 材料与方法
1.1 实验菌株
牙龈卟啉单胞菌ATCC33277;具核梭杆菌ATCC25586;中间普氏菌ATCC25611;实验所用204株乳杆菌均来自于江南大学食品学院生物技术中心菌种保藏中心。
1.2 实验细胞
人源口腔上皮癌细胞Ca9-22,北纳生物有限公司。
1.3 材料和试剂
MRS、BHI培养基,青岛海博;溶菌酶,上海生物工程;氯化血红素、结晶紫、乙醇等化学试剂,国药集团;维生素K1,阿拉丁;牙龈卟啉单胞菌脂多糖(lipopolysaccharide,LPS),法国Invivogen公司;Trizol、DMEM培养液、胎牛血清、胰酶,美国Gibco公司;PrimeScriptTM反转录试剂盒,美国Thermo Fisher公司;SYBR Green预混液,伯乐生命医学产品(上海)有限公司;人源TNF-α、IL-1β和IL-8 ELISA试剂盒,上海酶联有限公司;实时荧光定量PCR引物,上海桑尼生物科技有限公司。
1.4 仪器设备
MLS-3750型高温高压灭菌锅,日本SANYO公司;SW-CJ-1CV型微生物操作超净工作台,安泰空气技术有限公司;隔水式恒温培养箱,上海跃进医疗器械厂;高速冷冻离心机,德国Eppendorf公司;Multiscan Go 全波长酶标仪,美国Thermo Fisher公司;DG250厌氧培养箱,华粤行仪器;PCR扩增仪T100、实时荧光定量PCR仪,美国Bio-Rad公司。
1.5 实验方法
1.5.1 菌悬液和上清液的制备
将活化3代后的牙龈卟啉单胞菌、具核梭杆菌和中间普氏菌以2%的接种量接种至含有质量分数0.5%氯化血红素-维生素K1的BHI液体培养基中,37 ℃厌氧培养48 h,调节3种菌悬液浓度至107CFU/mL。
乳杆菌活化3代后接种至MRS液体培养基,37 ℃培养24 h,于4 ℃、12 000 r/min离心10 min,上清液经0.22 μm无菌滤膜过滤后于-20 ℃保存。
1.5.2 细胞培养
将Ca9-22细胞接种于含有10%(体积分数)胎牛血清的DMEM培养基中,在37 ℃、体积分数为5% CO2、95%饱和大气湿度的条件下进行培养,用2.5 g/L的胰酶进行消化传代,每隔2 d传代1次,实验所用细胞为对数生长期。
1.5.3 生物膜量测定
在96孔板每孔中分别加入牙龈卟啉单胞菌、具核梭杆菌和中间普氏菌菌悬液各40 μL,而后加入过滤后的乳杆菌上清液80 μL,37 ℃厌氧培养48 h。阴性对照组以同体积的MRS代替乳杆菌上清液。
待培养结束后以PBS清洗生物膜2遍,用体积分数为99%的甲醇固定15 min,室温干燥10 min,室温静置晾干生物膜后向每孔中加入100 μL的1 g/L结晶紫溶液,将生物膜染色30 min,染色结束后以PBS清洗2遍。加入100 μL的95%乙醇溶解,置于摇床上振摇30 min,波长600 nm下读取吸光度值。按公式(1)计算生物膜减少量:
(1)
1.5.4 细胞炎症因子测定
将已活化的Ca9-22细胞均匀铺于6孔板中,每孔加入2 mL,调整浓度至2×105个/mL。培养2 h后,向每孔加入60 μL的乳杆菌上清液,并加入牙龈卟啉单胞菌LPS至终浓度为1 μg/mL,继续孵育4 h。收集细胞上清液,使用商业ELISA试剂盒,参照说明书测量细胞因子TNF-α、IL-1β和IL-8的量。空白组未添加LPS和乳杆菌上清液;模型组只添加LPS不添加乳杆菌上清液。
1.5.5 细胞总RNA提取,cDNA合成及实时荧光定量PCR
将已活化的Ca9-22细胞均匀铺于6孔板中,每孔加入2 mL,调整浓度至2×105个/mL。培养2 h后,向每孔加入60 μL的乳杆菌上清液,并加入牙龈卟啉单胞菌LPS至终浓度为1 μg/mL,继续孵育12 h。空白组未添加牙龈卟啉单胞菌LPS和乳杆菌上清液;模型组只添加牙龈卟啉单胞菌LPS不添加乳杆菌上清液。而后,利用Trizol提取法提取细胞总RNA[17]。根据PrimeScriptTM反转录试剂盒说明书反转录成cDNA。
实时荧光定量PCR反应体系:cDNA模板 2 μL,上下游引物各1 μL,SYBR Green预混液10 μL,双蒸水6 μL。反应程序:95 ℃预热2 min,95 ℃变性15 s,60 ℃退火30 s,40个循环。上下游引物序列见表1。以内参基因β-actin对相关基因进行相对定量分析。

表1 实时荧光定量PCR引物序列
1.5.6 乳杆菌溶菌酶耐受能力评价
采用分光光度法考察乳杆菌对溶菌酶的耐受能力[18]。将乳杆菌菌悬液接种至96孔板中,分别加入不同浓度的溶菌酶溶液使得各孔终质量浓度分别为0.4、0.8、1.2、1.6、2.0、3.0 mg/mL。空白组以无菌水替代。37 ℃培养24 h后在波长600 nm下测定吸光度。
1.5.7 乳杆菌自成膜能力评价
在96孔板中加入乳杆菌菌悬液各100 μL,37 ℃培养24 h后用结晶紫法测定生物膜量,用成膜能力强的具核梭杆菌作为对照菌[19]。
1.5.8 乳杆菌自聚、共聚能力评价
参考文献[20-21]的方法测定乳杆菌的自聚能力,以及它们分别与牙龈卟啉单胞菌、具核梭杆菌的共聚能力。测定时间分别为2、4、6、8 h。自聚集率按公式(2)计算:
(2)
式中:Ac,自聚集率,%;A0,初始OD600值;Ax,静止孵育xh后细菌悬液上清液的OD600值。
共聚集率按公式(3)计算:
(3)
式中:CC,共聚集率,%;Amix,混合物培养xh后的OD600值;Astrain,乳杆菌的初始OD600值;Apathogen,致病菌的初始OD600值。
1.5.9 统计分析及数据处理
本文中的所有图形均采用Graphpad Prism 7.0进行绘制。所有数据采用SPSS Statistics 22.0进行统计学分析,各组间的显著性差异采用Tukey检验进行单因素方差分析;实验结果以平均数±标准差表示,P<0.05表明数据分析结果呈显著性差异。
2 结果与讨论
2.1 基于抑制生物膜形成量的菌株筛选
牙菌斑生物膜是牙周炎发病的起始因素。利用结晶紫染色法测定204株乳杆菌对混菌生物膜的抑制作用。结果显示204株乳杆菌对生物膜的抑制率在0%~60%。按照生物膜减少量高于40%为效果好、20%~40%为效果一般、低于20%为效果差的标准进行筛选,共筛得抑制混菌生物膜效果好的乳杆菌20株用于继续研究乳杆菌对牙周炎症的缓解情况。20株乳杆菌对混菌生物膜的抑制作用见表2。
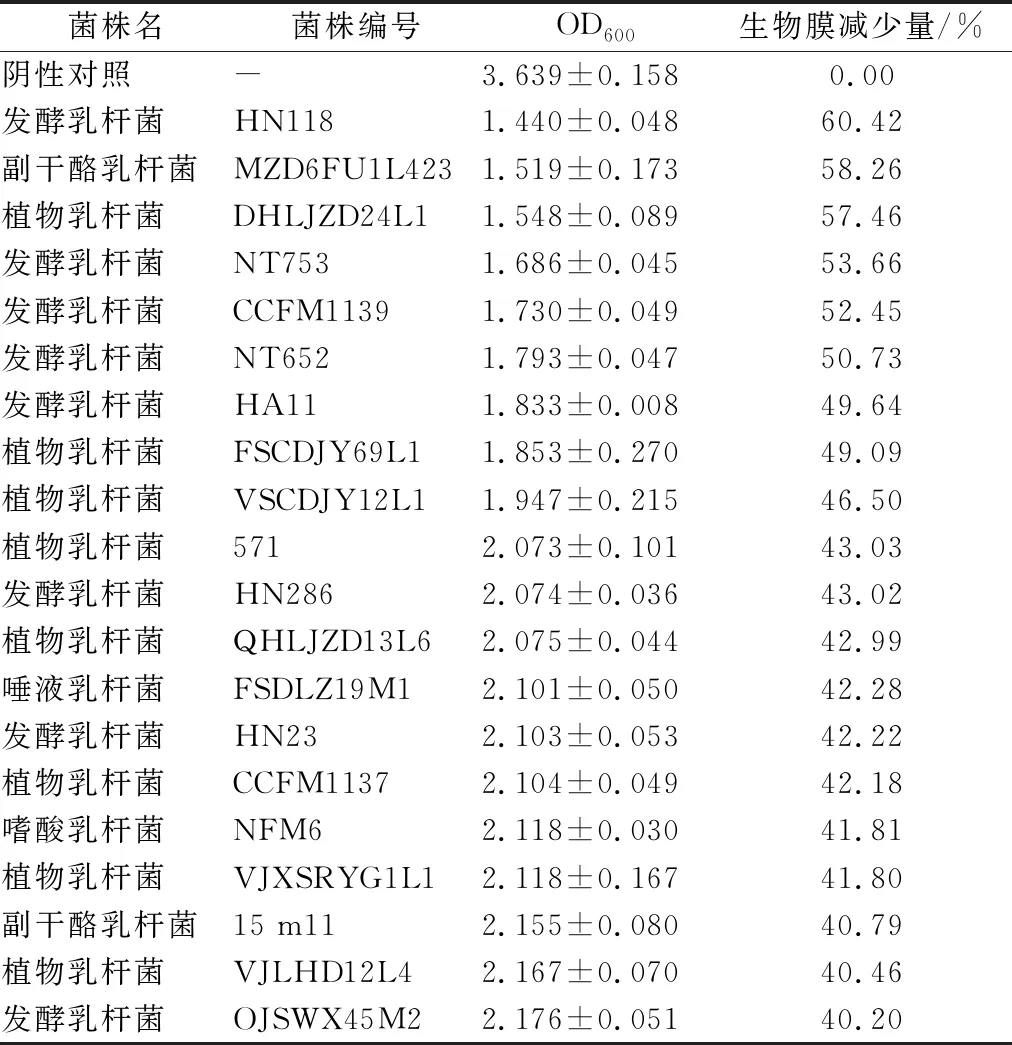
表2 乳杆菌对混菌生物膜的抑制作用
2.2 基于LPS诱导Ca9-22细胞分泌炎症因子的筛选
除了牙菌斑对牙周组织造成的破坏外,宿主因细菌及其毒力因子刺激所产生的过强的免疫应答反应是造成牙周炎的关键因素。当牙龈卟啉单胞菌与上皮细胞接触,牙龈卟啉单胞菌LPS刺激细胞释放TNF-α、IL-1β、IL-8等促炎细胞因子,从而加速炎症反应和机体损伤。利用LPS刺激Ca9-22细胞所形成的牙周炎细胞模型对20株乳杆菌进一步筛选。由图1可知,空白组细胞上清液中TNF-α、IL-1β、IL-8的含量较少。经LPS刺激4 h后的模型组TNF-α、IL-1β、IL-8的含量显著增加(P<0.05)。相比较模型组,实验组对TNF-α的分泌均具有抑制的作用,其中CCFM1139、HN23、CCFM1137、VSCDJY12L1和FSCDJY69L1能够极显著降低TNF-α的分泌(P<0.001)。对于IL-1β、IL-8,CCFM1137可以显著减少IL-1β的分泌(P<0.05);NT753、CCFM1139、HN286可极显著减少IL-8的分泌(P<0.001)。因此选取NT753、CCFM1139、HN286、HN23、CCFM1137、VSCDJY12L1和FSCDJY69L1共7株乳杆菌研究其对紧密连接蛋白表达量的影响。

a-TNF-α;b-IL-1β;c-ILF-8
2.3 基于LPS诱导Ca9-22细胞表达紧密连接蛋白的筛选
细胞间的紧密连接是结合上皮细胞中最重要的结构,通常由细胞间跨膜转运蛋白和支架蛋白组成。当牙周炎进一步恶化时,便会破坏细胞间的紧密连接。Claudin、Occludin作为常见的跨膜转运蛋白,控制着细胞旁路和各个细胞之间的半渗透压[22]。通过实时荧光定量PCR的方法对Claudin-1和Occludin的表达量进行相对定量分析,比较7株乳杆菌对紧密连接蛋白mRNA表达量的影响。由图2可知,与空白组相比,模型组紧密连接蛋白Occludin和Claudin-1的mRNA表达量显著下降(P<0.05)。与模型组相比,植物乳杆菌CCFM1137和发酵乳杆菌CCFM1139可同时显著提高Ca9-22细胞中Occludin和Claudin-1的mRNA表达量(P<0.05),且为种内效果最佳。因此,CCFM1137和CCFM1139可作为潜在口腔益生乳杆菌,对其进行益生特性评价分析。
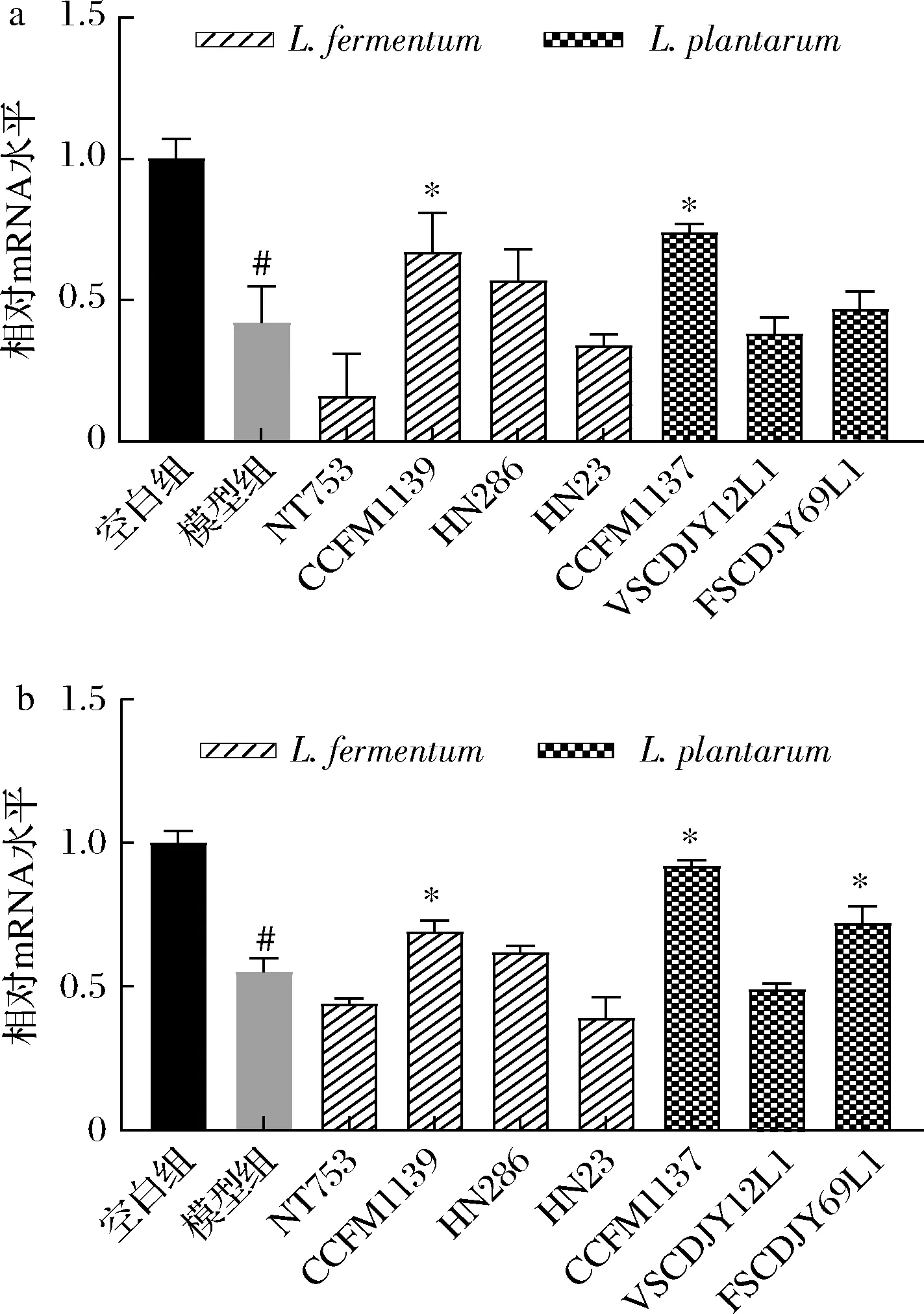
图2 乳杆菌对LPS刺激Ca9-22细胞表达Occludin (a)和Claudin-1 (b)基因的影响
2.4 溶菌酶耐受能力评价
溶菌酶作为唾液中重要的抗菌成分,能够选择性分解革兰氏阳性菌的细胞壁,从而导致微生物死亡[23]。通过测定乳杆菌对溶菌酶的耐受能力可评判当乳杆菌应用于口腔时是否具有一定存活能力。由图3可知,植物乳杆菌CCFM1137和发酵乳杆菌CCFM1139在溶菌酶0~1.6 mg/mL时,生长基本不受影响。而当质量浓度达到2.0 mg/mL时,2株乳杆菌的吸光度值都出现骤减。由此推测,CCFM1137和CCFM1139对溶菌酶的耐受临界值在1.6~2.0 mg/mL,远大于人口腔溶菌酶质量浓度1~57 μg/mL[24]。这表明,CCFM1137和CCFM1139不仅能够缓解牙周炎,同时在口腔中具有很好的存活能力。

图3 CCFM1137和CCFM1139在不同浓度溶菌酶下的生长密度
2.5 自成膜能力评价
牙菌斑生物膜是产酸细菌共同作用的结果。因此筛选得到的乳杆菌应当具有较低的自成膜能力。按照OD600<1为标准,对CCFM1137和CCFM1139的自成膜能力进行评判[25]。结果见图4,2株乳杆菌的自成膜能力远小于具核梭杆菌(P<0.05)。

图4 CCFM1137和CCFM1139自成膜能力
2.6 自聚共聚能力评价
乳杆菌自聚并利用其生产的胞外物质形成保护膜,保护菌株对抗环境变化,有助于定植,并且有研究表明自聚能力强的乳杆菌通常具有较强的黏附上皮细胞的能力[26]。而乳杆菌与致病菌的共聚能力是乳杆菌发挥口腔益生特性的关键。研究报道乳杆菌与致病菌的共聚能力与其抑制病原菌生物膜形成的能力有关[27]。
由图5可知,CCFM1137在2 h时自聚能力为9%,而在4 h测定时自聚能力突跃至43%,后期则趋于稳定。CCFM1139在2 h测定时自聚能力为12%,优于CCFM1137。之后CCFM1139的自聚能力逐步上升,至8 h时达到60%。

a-植物乳杆菌CCFM1137;b-发酵乳杆菌CCFM1139
CCFM1137和CCFM1139都显示出了与具核梭杆菌良好的共聚能力。2株菌在2 h时均超过了30%,而在8 h时,CCFM1137与具核梭杆菌的共聚能力为66%,CCFM1139为68%。而CCFM1137在2 h时与牙龈卟啉单胞菌并未发生共聚,在6 h时共聚能力为25%,在8 h时突破40%。CCFM1139在2 h时与牙龈卟啉单胞菌的共聚能力为19%,在6 h时突破44%,后稳步上升至50%。
3 结 论
牙周炎是一种由微生物引发的口腔炎症疾病,高发于35岁以上人群。乳杆菌作为益生菌,近年来在口腔疾病方面的应用受到研究者越来越多的关注。本研究筛得的植物乳杆菌CCFM1137和发酵乳杆菌CCFM1139不仅可以减少由牙龈卟啉单胞菌、中间普氏菌和具核梭杆菌所形成的混菌生物膜量,抑制牙菌斑的形成,还可以调节牙周炎细胞模型分泌TNF-α、IL-1β、IL-8以及紧密连接蛋白Claudin-1、Occludin的表达量,达到缓解炎症的效果。同时,CCFM1137和CCFM1139对溶菌酶都表现出较高的耐受能力,并具有弱自成膜能力和较强的自聚和共聚能力,不仅不会代替牙周炎致病菌形成新的生物膜,反而可以和牙周炎致病菌共聚,抑制具核梭杆菌等微生物形成生物膜。综上,植物乳杆菌CCFM1137和发酵乳杆菌CCFM1139在体外实验中能够减少混菌生物膜量,降低炎症因子TNF-α、IL-1β、IL-8的分泌,调节紧密连接蛋白Occludin和Claudin-1的表达量,具有较好的口腔益生特性,为CCFM1137和CCFM1139的体内实验提供了参考,同时为益生菌在防治牙周炎上的应用提供了理论基础。
