梅奇酵母转化L-苯丙氨酸合成2-苯乙醇发酵条件优化
2021-08-09史荣超刘洒洒侯阳阳张梦瑶龚佳江晓楠杨晓兵
史荣超,刘洒洒,侯阳阳,张梦瑶,龚佳,江晓楠,杨晓兵
(西北农林科技大学 葡萄酒学院,陕西 杨凌,712100)
2-苯乙醇(2-phenylethanol,2PE)是一种广泛应用于食品、药品和化妆品等领域的芳香醇,全球年产量约1万t[1],也可用于调配草莓、焦糖、蜜香、奶油等类型的食用香精(GB 2760—2014)[2]。目前,天然提取和化学合成是生产2PE的主要方式。玫瑰、矮牵牛、番茄、茉莉等植物精油是天然原料[3-5],但易受地域和气候的影响,2PE含量低,导致天然2PE价格昂贵(1 000 USD/kg)[1]。苯-环氧乙烷法和氧化苯乙烯加氢法是化学合成2PE主要方式,其反应条件苛刻,产品存在有毒残留[6-7]。微生物合成具有低碳环保、不受地域和气候影响、易于规模化生产等优势,是天然提取和化学合成的有效替代策略。2PE微生物合成按底物不同分为从头合成和非从头合成。从头合成途径广泛存在于微生物中,其底物为简单碳源(如葡萄糖等),但路径长、支路多,存在多种抑制作用,2PE产量较低[8]。非从头合成(主要指艾氏途径)的底物主要是L-苯丙氨酸(L-phenylalanine,L-Phe),因在微生物中转化效率高而被广泛开发利用[3]。
许多微生物具有合成2PE的能力,如酿酒酵母(Saccharomycescerevisiae)、解脂耶氏酵母(Yarrowialipolytica)、库德里阿茲威氏毕赤酵母(Pichiakudriavzevii)、马克斯克鲁维酵母(Kluyveromycesmarxianus)、梅奇酵母属(Metschnikowiasp.)、肉桂内生菌属(Sphingomonassp.)等[9-14]。美极梅奇酵母(Metsc-hnikowiapulcherrima)在高糖(>200 g/L)[15]、高酸(pH 3~4)条件下生长旺盛[16],能够合成普切明酸[17]、2PE[16]等多种化合物,也可作为生物防控剂用于果蔬采收后的杂菌防控[18],同时也可在开放、非灭菌条件下生产微生物油脂[19]。M.pulcherrima利用天然葡萄汁仅可产生0.25 g/L的2PE[20]。对于Metschnikowiasp.转化L-Phe合成2PE而言,已报道的转化效率通常较低。CHANTASUBAN等[16]利用M.pulcherrimaNCYC 373在单水相发酵条件下合成的2PE为1.71 g/L(L-Phe 30 g/L),但摩尔得率仅0.08。CHREPTOWICZ等[21]利用梅奇酵母合成的2PE为2.3~2.71 g/L(L-Phe 5 g/L),摩尔得率为0.62~0.73。为提高2PE合成效率,本研究通过筛选高产2PE的梅奇酵母菌株,调整培养基组成及发酵条件(碳源、温度和pH等)探究梅奇酵母在非灭菌(工业上灭菌通常伴随着高能耗和高成本)、补充碳源条件下高效转化L-Phe合成2PE。研究将为梅奇酵母高效转化L-Phe合成2PE的应用提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
美极梅奇酵母(M.pulcherrima)CICC 1467、桔梅奇酵母(M.citriensis)CICC 33213、梅奇酵母属(Metschnikowiasp.)CICC 33020、美极梅奇酵母(M.pulcherrima)CICC 32343,中国工业微生物菌种保藏管理中心。所用菌株均采用YPD固体培养基划线培养,培养条件为28 ℃,48 h。
1.1.2 培养基与主要试剂
固体YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,琼脂粉20,自然pH值,121 ℃灭菌20 min。
基础转化培养基:大量成分(g/L),葡萄糖26、L-Phe 20;微量成分(μg/L),维生素H2,泛酸钙400,叶酸2,肌醇2000,烟酸400,对氨基苯甲酸200,盐酸吡哆醇400,核黄素200,盐酸硫胺素400,H3BO3500,CuSO440,KI 100,FeCl3200,MnSO4400,MoNa2O4200,ZnSO4400,KH2PO41 000,MgSO4500,NaCl 100,CaCl2100,pH 4.0。0.22 μm水系滤膜过滤。
种子培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,自然pH值,121 ℃灭菌20 min。
主要试剂:L-苯丙氨酸(纯度98.5%)、2-苯乙醇标准品(纯度99.0%)、棕榈酸异丙酯(纯度97.0%),上海麦克林生化科技有限公司;N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF,纯度≥99.5%),天津科密欧化学试剂有限公司;2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB,纯度98.0%),上海易恩化学技术有限公司。
1.1.3 仪器与设备
ZQZY-85CS振荡培养箱,上海知楚仪器有限公司;GC9790Ⅱ气相色谱仪,浙江福立分析仪器股份有限公司;LC—2030 PLUS高效液相色谱仪,日本岛津制作所;EVOLUTION 220紫外可见分光光度计,赛默飞世尔科技有限公司;SBA-40D生物传感分析仪,山东省科学院生物研究所;FE28 pH计,梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 高产2PE菌株的筛选
将CICC 1467、CICC 32343、CICC 33213、CICC 33020在YPD固体培养基上划线培养,28 ℃活化30 h。挑取3个大小一致的单菌落,分别接种到含有50 mL基础转化培养基的250 mL摇瓶中,20 ℃,180 r/min条件下发酵,定时取样。
1.2.2 培养基成分、pH和发酵温度对2PE合成的影响
将CICC 1467在YPD固体培养基上划线培养,28 ℃活化30 h,挑取3个大小一致的单菌落,分别接种到含有50 mL转化培养基的250 mL摇瓶中,20 ℃,180 r/min条件下发酵120 h。探究因素和水平,按以下顺序进行(无特殊说明,接种量均采用单菌落接种,温度20 ℃,发酵时间120 h,pH 4.0):
(1)L-Phe添加量(g/L):0、4、8、12。
(2)碳源种类:葡萄糖、果糖、木糖、甘油(L-Phe 4 g/L)。
(3)葡萄糖添加量(g/L):10、30、50、70、90、110(L-Phe 4 g/L)。
(4)初始pH:2.0、3.0、4.0、5.0、6.0(L-Phe 4 g/L,葡萄糖50 g/L)。
(5)发酵温度(℃):15、20、25、30(L-Phe 4 g/L,葡萄糖50 g/L,pH 3.0)。
1.2.3 接种量对2PE合成的影响
将CICC 1467在YPD固体培养基上划线培养,28 ℃活化30 h。挑取1环单菌落至100 mL种子培养基中,28 ℃、180 r/min培养26 h(OD600约10)。5 000×g离心5 min分离出菌体,用无菌水洗涤2次,接种到转化培养基。
将基础转化培养基的葡萄糖、L-Phe和初始pH分别改为50、4 g/L和3.0以作为新的转化培养基。接种量分别为5%、10%、15%和20%(体积分数),25 ℃、180 r/min条件下发酵,定时取样。
1.2.4 非除菌条件下发酵潜力的探究
转化培养基同1.2.3。按5%接种量(体积分数)接种,25 ℃、180 r/min条件下发酵44 h。培养基处理共3种:对照组为蒸馏水配制后过滤除菌,处理一为蒸馏水配制不除菌,处理二为自来水配制后过滤除菌,处理三为自来水配制后不除菌。
1.2.5 检测分析
采用气相色谱法测定2PE产量,发酵液于8 000×g离心3 min,取上清液,用等体积棕榈酸异丙酯振荡1 min,8 000×g离心3 min,取上清液,用0.22 μm有机系滤膜过滤。气相检测条件:KB-FFAP色谱柱(30 m×0.32 mm,0.25 mm);进样量0.5 μL;分流比:40∶1;进样器220 ℃;程序升温条件:190 ℃保持6 min;20 ℃/min升至240 ℃,保持2 min;检测器250 ℃;载气为氮气,柱前压:0.07 MPa;气体流量:空气300 mL/min、氢气30 mL/min。
采用反相高效液相色谱法(HPLC)检测L-Phe残留量,分别取300 μL发酵液,150 μL 10 g/L DNFB溶液,150 μL 0.5 mol/L NaHCO3溶液(5 mol/L NaOH溶液调节pH至9.0)混合均匀,置于60 ℃水浴60 min(避光)[22]。用冰冷却[23],恢复到室温后,加入600 μL 0.01 mol/L KH2PO4溶液(5 mol/L KOH溶液调节pH至7.0),混合均匀后置于黑暗中15 min,0.22 μm滤膜过滤。色谱柱为Tnature C18(4.6 mm×250 mm,5 μm),进样体积10 μL,柱温26 ℃,流速0.8 mL/min,检测波长360 nm(紫外检测器);流动相配制:A相为0.05 mol/L NaAc溶液(pH=6.45±0.05),称取4.1015 g无水NaAc,溶解于950 mL超纯水中,用冰醋酸调节pH值至6.45,加10 mL DMF溶液,补水至1 L;B相为50%乙腈。洗脱程序如表1所示。

表1 利用反相高效液相色谱法检测L-Phe的洗脱程序
葡萄糖测定:采用DNS法;菌体生物量:以OD600值表示;乙醇体积分数采用SBA-40D生物传感分析仪测定;pH采用pH计测定。
2PE摩尔得率通过公式(1)计算:
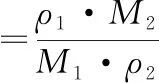
(1)
式中:ρ1,2PE产量,g/L;M1,2PE相对分子质量;ρ2,L-Phe添加量,g/L;M2,L-Phe相对分子质量。
1.2.6 数据处理
采用SPSS 18.0对试验数据进行差异性分析(ANOVA)检查各个结果的显著性差异,组间多重比较采用Duncan法,P<0.05,差异显著。采用Origin 2018作图。
2 结果和分析
2.1 高产2PE菌株的筛选
菌株的2PE合成能力决定了整个转化过程的生产效率。为获得高产2PE菌株,本研究对4株梅奇酵母合成2PE的能力进行了比较(图1)。当培养基中以L-Phe为唯一氮源时,艾氏途径才会占主要优势[24],故本研究采用以L-Phe为唯一氮源的培养基进行发酵。结果表明,4株酵母的生长速率和2PE合成速率在前36 h均较慢,之后进入快速生长和产物快速合成阶段,2PE合成与酵母生长呈正相关,4株酵母的2PE产量均在120 h达最大值,此时葡萄糖几乎耗尽(小于2 g/L)。4株酵母中,CICC 1467合成2PE的能力最强,终产量达1.76 g/L,摩尔得率为0.12。CICC 33020、CICC 33213和CICC 32343的2PE最大产量分别为1.48、1.46和1.53 g/L,无显著性差异(P>0.05)。因此,后续研究均采用CICC 1467进行。

a-生物量;b-葡萄糖消耗;c-2PE产量
2.2 L-Phe添加量对2PE产量的影响
L-Phe是通过艾氏途径合成2PE的底物,添加适量的L-Phe可促进2PE的合成效率,提高底物利用率[25]。在初筛中,CICC 1467合成的2PE为1.76 g/L(L-Phe 20 g/L),摩尔得率仅为理论值的12%。故本研究比较了L-Phe添加量对2PE合成的影响,为构建2PE的高效转化体系提供参考。研究发现,当L-Phe在0~12 g/L时,随着L-Phe添加量的增加,生物量先增加后减少,2PE产量同样先增加后减少(图2)。L-Phe为4 g/L时,OD600达最大值19.45,相应2PE产量为1.60 g/L,摩尔得率达0.54。L-Phe大于4 g/L时,OD600无明显差异(P>0.05),而葡萄糖消耗和副产物乙醇有所增加。L-Phe添加量为4、8和12 g/L的实验组发酵结束后,L-Phe剩余量分别为1.28、5.09和8.86 g/L,利用率分别为68.0%、36.4%和26.2%。因此,L-Phe最适添加量为4 g/L。
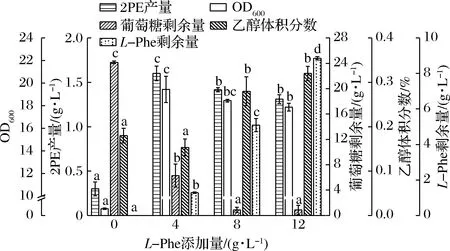
图2 L-Phe添加量对M.pulcherrima生长、葡萄糖消耗、乙醇和2PE产量的影响
2.3 碳源对2PE产量的影响
艾氏途径中苯乙醛到2PE的反应需要还原性辅酶(nicotinamide adenine dinucleotide,NADH)来提供电子供体[26],活细胞需要吸收能量来生成还原型辅酶以保持正常的氧化还原状态,葡萄糖等碳源能保证还原性辅酶的再生[27]。本研究比较了木糖、甘油、葡萄糖和果糖(均为26 g/L)4种碳源对2PE产量的影响(图3-a)。在相同质量浓度下,甘油能够提供高于葡萄糖、果糖和木糖的还原力NADH[28],但结果表明4种碳源对CICC 1467合成2PE和生物量的促进效果依次为:葡萄糖=果糖>甘油>木糖。虽然甘油能够提供更多的还原力NADH,但对于2PE合成的促进作用并不明显,可能是CICC 1467胞内甘油代谢相关的酶活性不够造成的。CICC 1467几乎无法利用木糖,生物量和2PE分别仅有0.22和0.11 g/L。又因葡萄糖比果糖价格低,故后续研究均采用葡萄糖为碳源。当葡萄糖为10~110 g/L时,随着添加量的增加,2PE产量先增加后不变(图3-b),这与先前报道的结果(2PE产量先增加后减少)不一致[25],可能CICC 1467是耐高渗酵母,能够在高糖环境下生长[15],而先前报道的K.marxianus不适合在高糖环境下生长[25]。当葡萄糖添加量为50 g/L时,2PE产量最高为1.85 g/L,摩尔得率为0.63。当葡萄糖添加量大于50 g/L时,2PE产量无显著变化(P>0.05),而副产物乙醇产量增加。综上,葡萄糖最适添加量为50 g/L。
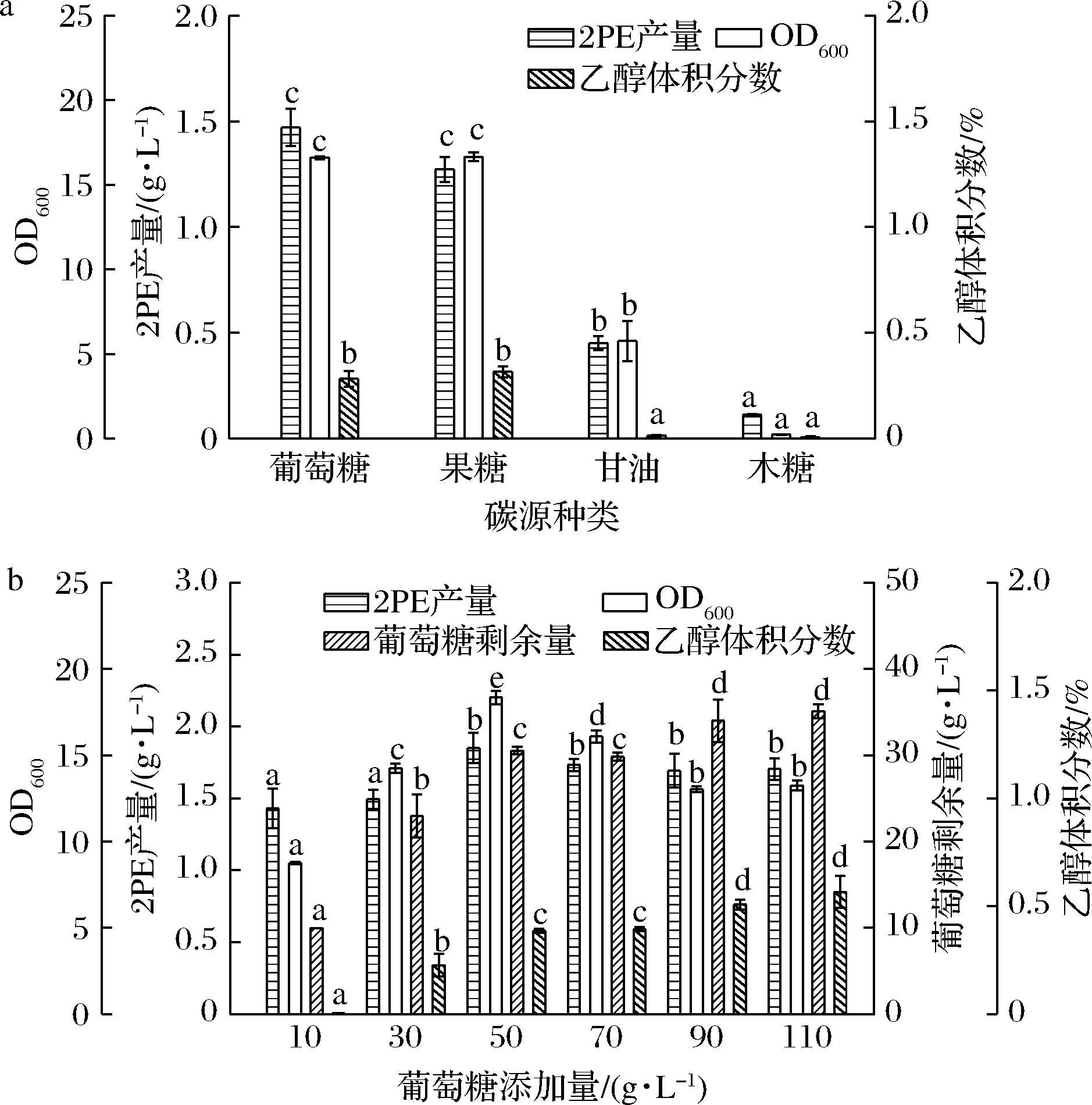
a-碳源种类;b-葡萄糖添加量
2.4 初始pH对2PE产量的影响
培养基pH能够显著影响微生物生命活动,进而影响目标产物合成效率。其主要机理包括以下3方面:一是改变蛋白质、核酸等生物大分子所带电荷,从而影响其生物活性;二是引起细胞膜电荷变化,改变微生物细胞吸收营养物质能力;三是改变环境中营养物质的可给性及有害物质的毒性[29]。故本研究探讨了初始pH(2.0~6.0)对2PE产量的影响(图4)。结果显示,随着初始pH的升高,生物量先升高后降低,2PE产量也随之先升高后降低,但乙醇呈升高趋势,表明较低pH有利于M.pulcherrima合成2PE,而不利于酒精发酵。但当初始pH为2.0时,菌体几乎无法生长,OD600仅有0.08。当初始pH 3.0时,生物量和2PE产量最高,分别为18.35和2.20 g/L,2PE摩尔得率达0.74,乙醇体积分数仅有0.25%。

图4 初始pH对M.pulcherrima生长、葡萄糖消耗、乙醇和2PE产量的影响
当初始pH大于3.0时,生物量和2PE产量均降低,乙醇的体积分数升高,说明pH过高不利于CICC 1467的生长和2PE的合成,反而有利于乙醇发酵。综上,最适初始pH为3.0。
2.5 发酵温度对2PE产量的影响
温度可通过改变细胞膜流动性来影响营养物质的摄入,进而影响细胞生长[30]。此外,胞内的绝大多数反应是在酶的催化下完成的,温度也可通过影响酶活性来影响产物的合成。因此,本研究考察了CICC 1467在15~30 ℃下的2PE合成情况(图5)。结果表明,CICC 1467在15 ℃下仍然能够生长(OD600为12.04),并产生1.27 g/L的2PE,具有一定耐受低温的能力。随着温度的升高,乙醇产量逐渐升高,25 ℃和30 ℃时达到最高(1%)。生物量和2PE产量先升高后下降,25 ℃时,生物量和2PE产量达到最高,分别为19.48和2.26 g/L,摩尔得率达0.76。因此,最适发酵温度为25 ℃。
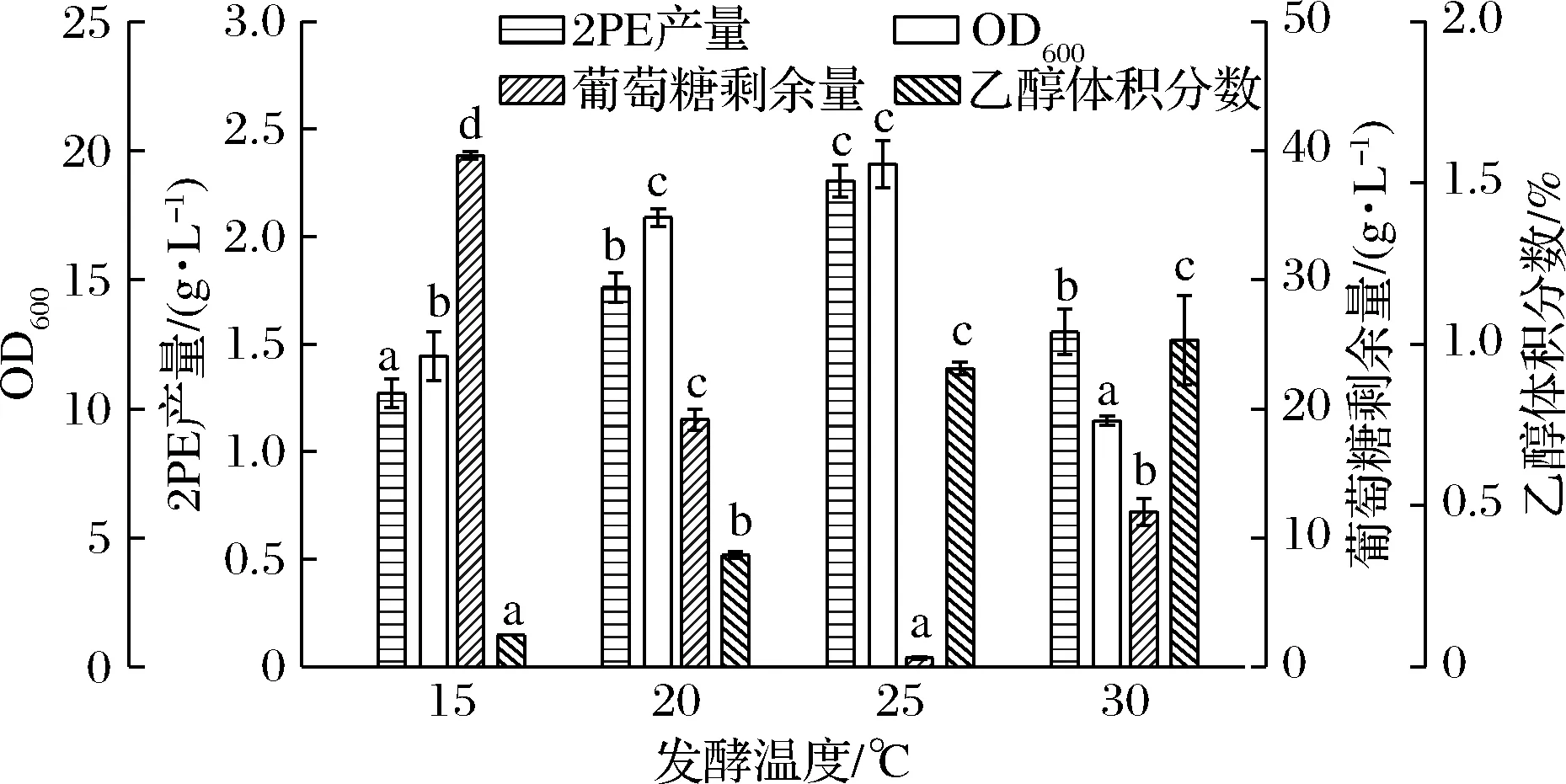
图5 发酵温度对M.pulcherrima生长、葡萄糖消耗、乙醇和2PE产量的影响
2.6 接种量对2PE产量的影响
低接种量有利于提高2PE产量和得率,但接种量过低会延长发酵周期,增加生产成本;接种量过高虽然能够缩短发酵时间,但会降低2PE产量和得率[31]。因此,接种量对合成2PE至关重要。本研究按照5%、10%、15%和20%的接种量(体积比,种子液OD600约为10)分别进行接种,考察其对2PE合成的影响(图6)。结果表明,接种量越高,菌体增殖速率、糖消耗速率和乙醇合成速率越高。2PE合成速率与菌体增殖速率正相关(图6-d),证明2PE合成与微生物生长相偶联,这与CHANTASUBAN等[16]的研究相吻合。就乙醇合成而言,接种量在10%以上时,终产量无显著差异(P>0.05),但均高于接种量为5%的发酵组(P<0.05)。当接种量为5%时,2PE产量在44 h达到最大值1.85 g/L,显著高于其他发酵组(P<0.05);而接种量为10%、15%和20%的发酵组合成的2PE最大产量分别为1.66、1.70和1.69 g/L,三者无显著性差异(P>0.05)。因此,最佳的接种量为5%。
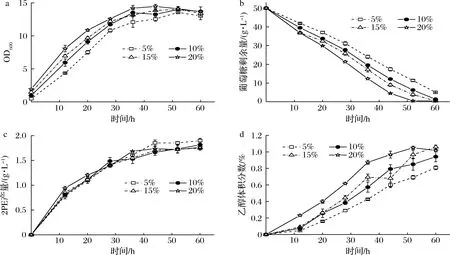
a-生物量;b-葡萄糖消耗;c-2PE产量;d-乙醇产量
2.7 非除菌条件下发酵潜力的探究
在工业生产上,培养基和发酵设备的灭菌过程会有较高的能耗成本和物料损失。美极梅奇酵母能够产生普切明酸抑制微生物生长[17],SANTAMAURO等[19]已在未灭菌条件下成功合成微生物油脂。因此,本研究对CICC 1467在非除菌条件下的发酵潜力进行了探究,初始L-Phe、葡萄糖、pH、接种量分别采用:4 g/L、50 g/L、pH 3.0和5%。结果表明,培养基除菌与否对2PE产量、葡萄糖剩余量和乙醇产量均无显著影响(P>0.05)(图7)。
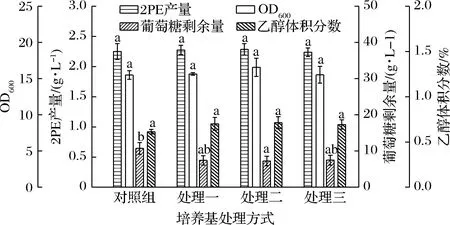
图7 培养基处理方式对M.pulcherrima生长、葡萄糖消耗、乙醇和2PE产量的影响
具体而言,以蒸馏水为溶剂制培养基时,除菌组2PE产量和得率为2.25 g/L、0.76,非除菌组则为2.27 g/L、0.77;用自来水配制培养基时,除菌组2PE产量和得率为2.28 g/L、0.77,非除菌组则2.24 g/L、0.76。本研究证明在摇瓶发酵水平上,自来水中可能存在的微生物对发酵过程不会造成影响,CICC 1467可以在非除菌条件下利用自来水配制的培养基高效合成2PE。
3 结论
微生物合成2PE是天然提取和化学合成的有效替代策略。当L-Phe 4 g/L、葡萄糖50 g/L、初始pH 3.0、发酵温度25 ℃、接种量5%,用自来水配制培养基后,直接在非除菌条件下进行发酵,2PE摩尔得率达0.76,是目前利用美极梅奇酵母单水相生产2PE的最高水平。虽然本文中,美极梅奇酵母可在摇瓶中利用未除菌培养基高效转化L-Phe合成2PE,但在更大体系中的转化效果需要进一步验证。此外,进一步提高2PE产量还需要解决其对微生物的细胞毒性问题。总之,本研究证明CICC 1467具备在非灭菌条件下高效转化L-Phe合成2PE的能力,这对实际应用具有重要的参考价值。
