携带大麦黄矮病毒蚜虫取食对小麦防御基因表达水平的影响
2021-08-09亢菊侠兰文学
亢菊侠,兰文学,杨 林
(1 杨凌职业技术学院 生物工程分院,陕西 杨凌 712100;2 西北农林科技大学 植物保护学院,陕西 杨凌712100)
在漫长的生物进化过程中,植物进化出一系列防御策略来应对不良的环境条件。这些防御策略分为组成型防御机制和诱导型防御机制[1]。组成型防御机制一般是指植物本身具有的、能够抵御外界病虫危害的物理因子和化学因子,这些因子在植物的一生中都不会发生重大改变;而诱导型防御机制是指植物自身不会主动发生,必须有外界胁迫发生时植物经过一段时间的适应后才会发生的防御反应。诱导型防御途径主要有茉莉酸(jasmonic acid,JA)途径、水杨酸(salicylic acid,SA)途径、脱落酸(abscisic acid,ABA)途径、乙烯(ethylene,Et)途径等[2]。JA途径是植物在创伤条件下激活的一类诱导防御反应,植物内部产生亚麻酸,在脂氧合酶(LOX)、丙二烯氧化物合成酶(AOS)等一系列酶促反应的作用下最终生成JA和茉莉酸甲酯[3]。SA途径在植物抗病原菌反应中起着重要的作用,苯丙氨酸解氨酶(PAL)是该途径的关键酶,催化合成SA前体物质肉桂酸,且在SA下游受病程相关基因非表达子1(NPR1)的调控,从而最终建立诱导型防御[4]。
在自然界中,植物病毒-介体昆虫-寄主植物三者间存在着复杂的相互联系。植物病毒可导致寄主植物发生变色、组织坏死和畸形等形态特征的变化[5],还能调节寄主体内氨基酸、碳水化合物等营养成分以及挥发性物质的种类与含量[6-8]。介体昆虫的取食也能对寄主植物产生重要影响,如刺吸式昆虫取食后,植物能够闭塞筛管并产生和释放次级代谢物[9-10]。目前,寄主植物对植物病毒和介体昆虫产生上述防御反应的机制尚不明确,前人曾报道寄主植物通过直接提高SA[11]、JA含量[12]来防御介体昆虫的胁迫,还通过体内重要保护酶和解毒酶活性的变化来应对病毒的影响[13],而有关植物病毒和介体昆虫诱导防御反应过程中寄主植物关键基因表达水平变化的报道不多。
小麦(TriticumaestivumL.)是世界上最主要的粮食作物。由大麦黄矮病毒(barley yellow dwarf virus,BYDV)所致的小麦黄矮病是小麦的重要病害,其中BYDV-GAV是我国主要流行的BYDV株系;麦二叉蚜Schizaphisgraminum(Rondani)和麦长管蚜Sitobionavenae(Fabricius)是小麦上的重要害虫,且是BYDV-GAV的传播介体。在田间,麦蚜和大麦黄矮病常常混合发生。由于SA和JA在寄主植物防御反应中往往作为信号物质,为探究植物病毒对介体昆虫取食和植物防御反应过程中SA和JA途径关键基因表达水平是否有影响,本研究以BYDV-GAV为测试病毒,以麦长管蚜和麦二叉蚜为试虫,设置无蚜虫取食、无毒蚜虫取食、有毒蚜虫取食小麦,于取食后不同时间,检测小麦叶片JA合成途径中的关键基因LOX和AOS及SA途径关键基因NPR1和PAL的表达水平,以期从寄主植物小麦的角度探讨造成防御反应差异的原因,为合理防治小麦蚜虫及黄矮病提供理论依据。
1 材料与方法
1.1 供试小麦的种植
供试小麦品种为矮抗58。小麦种植前先用水浸泡种子24 h,然后将育苗基质土装入一次性塑料杯中,将土铺平后在每个塑料杯中撒3粒种子,再盖上一层土壤,用洒水壶喷水浸透。将所有处理的塑料杯集中放置在托盘上,将托盘放置在人工气候室中(温度为(20±1) ℃,相对湿度为60%±5%,光照时间为16 h/d),待小麦出苗后,保留一株幼苗,待幼苗两片叶片完全展开时用于试验。
1.2 供试蚜虫的饲养
无毒蚜虫:无毒麦长管蚜、麦二叉蚜为试验室前期自西北农林科技大学北校区试验田(34°17′48.5″N,108°04′34.9″E)采集的单头无翅成蚜,在上述小麦上饲喂,并于人工气候箱中培养,培养条件:温度为(25±1) ℃,相对湿度为75%±5%,光照时间为16 h/d。 饲养3代后形成单克隆系。
感染BYDV-GAV蚜虫:在西北农林科技大学北校区试验田中采集出现小麦黄矮病症状的小麦植株,进行RT-PCR鉴定,确认小麦仅含有BYDV-GAV,具体试验方法同文献[14]。将上述无毒麦长管蚜、麦二叉蚜放入其中饲养,饲养条件同上。蚜虫每代均进行BYDV-GAV检测,确保成功感染。
1.3 试验设计
试验共设5个组:无蚜虫取食小麦(CK)、无毒麦长管蚜取食小麦(Mock-Sa)、无毒麦二叉蚜取食小麦(Mock-Sg)、感染BYDV-GAV麦长管蚜取食小麦(BYDV-Sa)和感染BYDV-GAV麦二叉蚜取食小麦(BYDV-Sg)。Mock-Sa、Mock-Sg、BYDV-Sa和BYDV-Sg处理:将单株种植的二叶期小麦一个叶片先用透明塑料薄膜包裹住,在另一个叶片上接10头相应的3龄无翅麦长管蚜或麦二叉蚜;CK处理不接蚜虫。接虫后用透明塑料罩子将小麦整体罩住,放入上述人工气候箱中。于蚜虫取食2 h(蚜虫达到稳定取食所需时间),26,50,74和98 h时,用体积分数1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)喷洒叶片,促使蚜虫口针从叶片中拔出,再用毛笔刷走蚜虫,剪下叶片用液氮速冻,放入-80 ℃超低温冰箱中保存。每组重复3次。
1.4 LOX、AOS、NPR1和PAL基因的荧光实时定量PCR(qRT-PCR)分析
1.4.1 荧光实时定量引物设计 参考GenBank中LOX、AOS、NPR1和PAL序列(登录号分别为GQ166692.1、AY196004、O0070069和AY00547-4),并以26S基因为内参(登录号为Ta22845),利用软件Primer 5.0设计引物(表1),引物由上海生工生物工程有限公司合成。用PCR对设计的引物进行特异性检测,各引物均可扩增出单一条带且无引物二聚体,片段大小都在200 bp左右,可以满足荧光实时定量PCR的引物设计要求。用qRT-PCR进一步确定引物特异性,从熔解曲线看,各引物均具有单一峰值,证明该引物具有特异性,可用于qRT-PCR试验。
1.4.2 总RNA提取与检测 将1.3的小麦叶片置于研钵中,加入液氮快速研磨后,按照50~100 mg/mL向研钵中加入Trizol Reagent试剂,然后按照试剂说明书提取各组小麦叶片的总RNA。对提取的总RNA进行1.2%琼脂糖凝胶电泳检测,验证提取总RNA的完整性。将获得的RNA置于-80 ℃备用,测定230,260和280 nm处的吸光值(OD230、OD260和OD280),检测提取组织RNA的浓度和质量后,用反转录试验获得 cDNA 模板。
1.4.3 相关基因的荧光实时定量检测 采用TB Green®Premix Ex TaqTM Ⅱ试剂盒和实时荧光定量PCR仪QuantStudio 3.0进行试验。参照试剂盒说明书,配制20 μL PCR扩增体系:TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)10 μL,PCR正向引物(10 μmol/L)0.8 μL,PCR反向引物(10 μmol/L)0.8 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,DNA模板2 μL,灭菌水6 μL。PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。每个样品重复3次,反应结束后收集循环阈值(Ct),采用2-ΔΔCt法[15]进行相对表达量分析。
1.5 数据处理
相对表达量数据利用SPSS 21.0 软件进行统计分析。符合正态分布的数据采用单因素方差分析,用Turkey法(P=0.05)进行多重比较,不符合正态分布的数据采用Kruskal-Wallis test非参数检验(P=0.05)。利用Sigma Plot 10.0 软件制图。
2 结果与分析
2.1 小麦叶片总RNA质量检测
使用Trizol提取各处理组小麦叶片总RNA,电泳结果见图1。图1显示,在各处理组均可清楚地看到2条rRNA条带(28 S和18 S),说明获得了完整性较好的RNA。对提取各处理组小麦叶片总RNA的质量进行检测,由检测结果(表2)可知,各处理组总RNA的OD260/OD280和OD260/OD230值为1.94~2.18,总RNA质量浓度为187~345 ng/μL,说明样品总RNA的纯度达到试验要求。

表2 不同处理小麦样品总RNA质量检测结果Table 2 Quality detection of total RNA in wheat under different treatments
2.2 携带BYDV蚜虫取食对小麦JA途径关键基因表达的影响
无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦LOX基因表达量的影响如图2所示。由图2可知,与CK相比,Mock-Sa和Mock-Sg处理小麦LOX基因的相对表达量在蚜虫取食26 h均显著下调,而在取食50和98 h均显著上调,且Mock-Sg处理在74 h也显著上调,结果表明随着取食时间的加长,麦蚜取食能显著提高小麦体内LOX的表达水平。
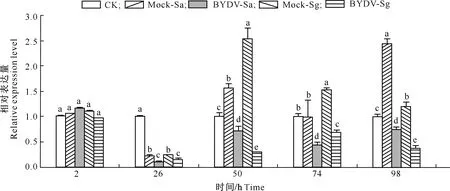
图柱上标不同小写字母表示同一时间下不同处理间差异显著(P<0.05)。下图同Different lowercase letters indicate significant differences at P<0.05 level among treatments at the same time.The same below图2 无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦LOX基因表达量的影响Fig.2 Relative expression of LOX in wheat plants after fed by virus-free or BYDV-GAV infected aphids
由图2还可知,与Mock-Sa处理相比, BYDV-Sa处理小麦LOX基因的相对表达量在蚜虫取食26,50,74和98 h均显著下调;与Mock-Sg处理相比, BYDV-Sg处理小麦LOX基因的相对表达量表现出与BYDV-Sa处理一致的趋势,即在蚜虫取食26~98 h均显著下调。上述结果表明,BYDV-GAV能显著降低小麦体内LOX的表达水平。
无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦AOS基因表达量的影响如图3所示。由图3可知,与CK相比,Mock-Sa和Mock-Sg处理小麦AOS基因的相对表达量在蚜虫取食26 h均显著下调,在取食50 h均显著上调,取食74 h时Mock-Sa处理显著下调;取食98 h时Mock-Sa处理小麦显著上调,Mock-Sg处理小麦显著下调。表明麦蚜取食对小麦体内AOS基因的表达水平影响不一致,因蚜虫种类而异。与Mock-Sa处理相比,BYDV-Sa处理小麦AOS基因的相对表达量在蚜虫取食26,50,74和98 h均显著下调;与Mock-Sg处理相比,BYDV-Sg处理小麦AOS基因的相对表达量在蚜虫取食26和74 h均显著下调。表明BYDV-GAV能显著降低小麦体内AOS的表达水平。

图3 无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦AOS基因表达量的影响Fig.3 Relative expression of AOS in wheat plants after fed by virus-free or BYDV-GAV infected aphids
2.3 携带BYDV蚜虫取食对小麦SA途径关键基因表达的影响
无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦NPR1基因表达量的影响如图4所示。由图4可知,与CK相比,Mock-Sa处理小麦NPR1基因的相对表达量仅在蚜虫取食50 h时显著下调,而Mock-Sg处理小麦在取食26 h显著下调,在50 h显著上调;其他时间2个处理均与CK无显著差异,表明麦蚜取食对小麦体内NPR1基因的表达水平总体上无显著影响。与Mock-Sa处理相比,BYDV-Sa处理小麦NPR1基因的相对表达量在蚜虫取食74和98 h显著下调;与Mock-Sg处理相比,BYDV-Sg处理小麦NPR1基因的相对表达量在蚜虫取食26 h显著上调,在取食50 h显著下调。表明BYDV-GAV在一定的时间段可降低小麦体内NPR1的表达水平。
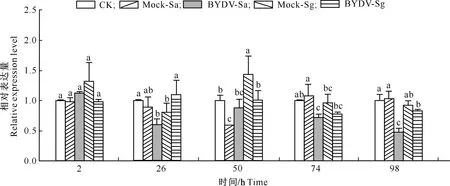
图4 无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦NPR1基因表达量的影响Fig.4 Relative expression of NPR1 in wheat plants after fed by virus-free or BYDV-GAV infected aphids
无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦PAL基因表达量的影响如图5所示。由图5可知,与CK相比,Mock-Sa和Mock-Sg处理小麦PAL基因的相对表达量在蚜虫取食50 h均显著上调,74 h时仅Mock-Sg处理小麦PAL基因显著上调,98 h时仅Mock-Sg处理小麦显著下调,表明麦蚜取食对小麦体内PAL基因表达水平的影响在不同时间表现不一致。与Mock-Sa处理相比,BYDV-Sa处理小麦PAL基因的相对表达量在蚜虫取食26,74和98 h均显著下调,在50 h 显著上调;与Mock-Sg处理相比,BYDV-Sg处理小麦PAL基因的相对表达量在蚜虫取食26,50,74和98 h均显著下调,表明BYDV-GAV能显著降低小麦体内PAL的表达水平。
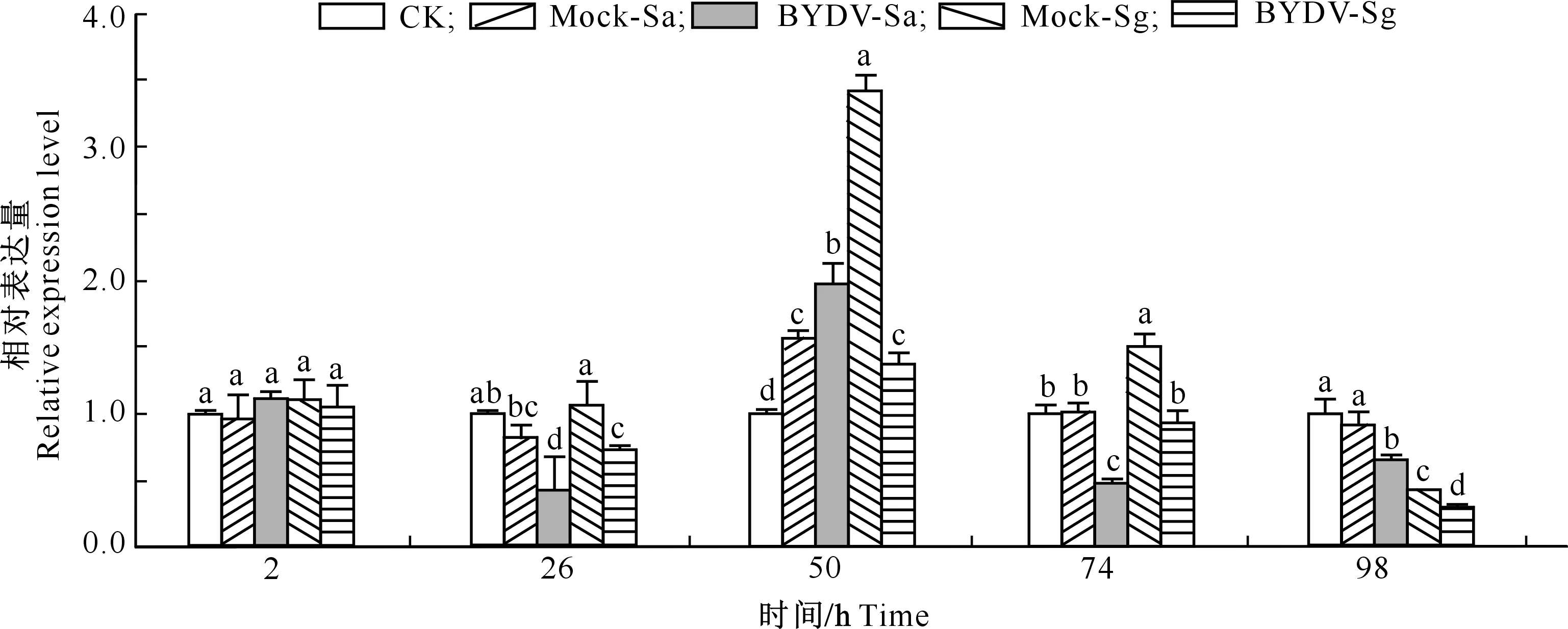
图5 无BYDV-GAV和有BYDV-GAV蚜虫取食对小麦PAL基因表达量的影响Fig.5 Relative expression of PAL in wheat plants after fed by virus-free or BYDV-GAV infected aphids
3 讨论与结论
近年来,研究植物病毒-介体昆虫-寄主植物三者间的交互作用来防治植物病毒和害虫,受到了越来越广泛的关注,而在寄主植物抵御外来胁迫的过程中,SA和JA防御途径起着非常重要的作用。本研究表明,与无蚜虫取食对照相比,麦蚜取食能显著提高小麦体内LOX的表达水平,对NPR1的表达水平无显著影响,而对AOS和PAL表达水平的影响因麦蚜种类或处理时间的不同而变化。与无毒蚜虫取食相比,携带BYDV-GAV蚜虫取食总体上能降低小麦体内LOX、AOS、NPR1和PAL的表达水平。史晓斌[16]研究发现,B型和Q型烟粉虱能显著提高番茄体内LOX基因的表达水平,这与本研究结果一致,但该研究还发现,携带番茄黄化曲叶病毒烟粉虱取食可致番茄体内NPR1基因的表达水平显著增加(B型)或无显著影响(Q型),这与本研究结果不一致,说明植物病毒对植物防御作用的影响具有种的特异性。
本研究结果发现,蚜虫取食的小麦体内LOX基因表达水平显著升高,表明蚜虫取食能提高增强JA途径基因的表达。张弛等[13]研究发现,麦长管蚜取食后小麦体内过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活性分别提高83.88%,126.45%,91.21%,197.26%和468.82%。上述结果说明,昆虫取食能显著改变寄主植物体内生理生化反应,从而实现对昆虫取食的防御作用。大多数刺吸式昆虫在取食的时候会分泌胶状和水状唾液,其中胶状唾液会在昆虫取食早期分泌并形成唾液鞘,保护口针;而水状唾液中包含了一系列的活性组分,如酚氧化酶、过氧化物酶、果胶酶、纤维素酶、碱性磷酸脂酶等[17]。笔者推测,唾液能帮助刺吸式昆虫穿刺植物、消化食物、解毒次生物质并破坏植物的防御反应。
携带植物病毒的昆虫取食寄主植物后,昆虫的生长发育显著加快[18],繁殖力显著提高[19-20],种群内禀增长率显著增加[21],取食行为显著增强[22],表明植物病毒能提高介体昆虫对寄主植物的适应能力,即植物病毒能协助介体昆虫应对寄主植物的防御作用。本研究发现,与无毒蚜虫取食处理相比,携带BYDV-GAV麦蚜取食处理小麦体内LOX、AOS、NPR1和PAL的表达水平总体降低,表明BYDV-GAV能显著降低小麦的诱导型防御水平,这为前人得出的“植物病毒能协助介体昆虫应对寄主植物的防御作用”研究结果提供了一个合理的解释。笔者推测出现该结果的原因可能是BYDV-GAV在麦蚜体内循环过程中激活了麦蚜体内抑制小麦防御途径的酶,或者麦蚜取食的过程中BYDV-GAV改变了麦蚜唾液的成分,从而对小麦防御途径产生了抑制作用。
前人研究表明,JA介导的信号转导途径是咀嚼式口器虫害和创伤诱导的主要途径,而SA介导的信号转导途径是刺吸式口器虫害和病原菌侵染的主要诱导途径[23-24],且一种激素的上升会导致另一种激素的下降[25]。蚜虫属刺吸式口器昆虫,SA途径应是其主要诱导途径。但本研究发现,与无蚜虫取食对照相比,麦蚜取食不同时间段均能显著提高小麦JA途径中LOX基因的表达水平,而对SA途径中NPR1基因的表达水平无显著影响,说明JA可能在麦蚜取食过程中发挥了主要的防御作用;但与无毒蚜虫取食相比,携带BYDV-GAV的麦蚜在取食不同时间段均能显著降低JA途径中LOX和AOS基因的表达水平,且均能降低SA途径中NPR1和PAL基因的表达水平,这与前人的研究不一致,需进一步探究其原因。
本研究表明,BYDV-GAV和麦蚜之间的互利共生促进了麦蚜对植物防御反应的抵抗作用,这可能是导致麦蚜大发生并造成BYDV-GAV病毒扩散的一个重要原因。但本研究只分析了携带BYDV蚜虫取食对小麦JA和SA途径重要基因表达水平的影响,其具体互作机理仍不明确,因此仍需要进一步利用转录组学、蛋白组学以及RNAi等方法深入研究,以明确植物病毒-介体昆虫-寄主植物三者之间更深层的基因适应机制。
