响应面法优化栀子中栀子苷的超声-微波协同提取工艺
2021-08-08宋登鹏韩安艳
宋登鹏, 韩安艳
(十堰市太和医院·湖北医药学院附属医院药学部,湖北十堰442000)
中药栀子是茜草科植物栀子Gardenia jasminoidesEllis的干燥成熟果实,别名为黄栀子、山栀、白蟾、黄果子、山黄枝、黄栀、山栀子、水栀子、越桃、木丹等[1]。栀子性寒、味苦,归心、肺、三焦经,内服具有泻火除烦、清热利湿、凉血止血的功效,外用具有消肿止痛的功效[2]。现代药理学研究发现,栀子具有保肝利胆[3]、降血糖[4]、降血脂、抗氧化[5]等作用,主要含有环烯醚萜类[6]、二萜类[7]、黄酮类[8]、挥发油类[9]、有机酸类[10]等成分。栀子是2002年国家卫生部颁布的第一批药食两用物质[11],已被开发成栀子面粉[12]、栀子复合饮料[13]、栀子酒[14]、栀子油[15]等。
栀子中分离的环烯醚萜类成分大约30种,含量最高的是栀子苷,也是栀子发挥药用价值的主要成分[16-17]。研究发现,栀子苷具有改善睡眠[18]、保肝利胆[19]、抗炎[20]、抗病毒[21]等药理活性,且栀子苷也可制成天然食用着色剂栀子蓝和栀子红等。目前,栀子中栀子苷的提取方法有加热回流提取法[22]、超声提取法[23]、减压提取法[24]、微波法[25]等。至今,超声微波法[26-27]提取栀子中栀子苷的提取工艺还未见报道。本研究拟采用Box-Behnken效应面法优化栀子中栀子苷的超声微波法提取工艺,并选用高效液相色谱(HPLC)法测定提取液中栀子苷的含量,以提高栀子苷的提取率,拓展栀子的应用,现将研究结果报道如下。
1 材料
1.1 药品与试剂实验用栀子果实购自湖北省十堰市太和医院药房。栀子苷对照品(上海源叶生物科技有限公司);乙腈为色谱纯,购自广州市昱浩贸易有限公司。
1.2 仪器GPD-1000C中药材粉碎机(台州国品乐机机械有限公司);BP211D型1/10万电子分析天平(德国赛多利斯公司);日本岛津LC-20AT高效液相色谱仪、SPD-20A紫外检测器、SIL-20A自动进样器、UV-2550紫外可见分光光度计(日本岛津公司);SK2510HP超声清洗机(深圳市歌能清洗设备有限公司);XH-300A电脑微波超声波足额和催化合成萃取仪(北京祥鹄科技发展有限公司)。
2 方法与结果
2.1 栀子苷含量测定方法的建立
2.1.1 色谱条件Hypersil C18色谱柱(5 μm,250 mm×4.6 mm),以乙腈-水(15∶85)为流动相,流速为1.0 mL/min,柱温为30℃,进样量为10 μL[28]。
2.1.2 对照品溶液的制备精密称取栀子苷对照品5.2 mg,置于100 mL容量瓶中,用乙醇定容,制成浓度为0.052 mg/mL的对照品储备溶液。将对照品适量稀释100倍,即得对照品溶液。将对照品溶液适量用0.22 μm微孔滤膜过滤。
2.1.3 供试品溶液的制备栀子药材粉碎,过筛,准确称取栀子药材1 g,加入60%的乙醇50 mL,称质量,按Box-Behnken效应面法优化的工艺条件超声微波协同提取栀子苷,冷却至室温;60%乙醇补足损失的质量,摇匀,过滤,精密量取续滤液2 mL,置于25 mL量瓶中;加乙醇至刻度,摇匀,0.22 μm微孔滤膜过滤。按照“2.1.1”项下的色谱条件进样,测定栀子提取液中栀子苷的含量。
2.1.4 标准曲线的制备将对照品溶液和供试品溶液根据“2.1.1”项下色谱条件进样,HPLC色谱图见图1。由图1可知,在此色谱条件下,栀子苷可以获得较好的基线分离。将对照品溶液按“2.1.1”项下的色谱条件分别进样1、2、5、10、15、20 μL测定峰面积。以色谱峰面积为纵坐标,进样质量(μg)为横坐标进行回归计算,得回归方程为Y=1 454 640X-249 227,R2=0.999 6。结果表明,栀子苷对照品在0.52~10.4 μg范围内线性关系良好。
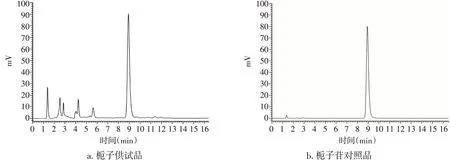
图1 栀子供试品及对照品高效液相色谱(HPLC)图Figure 1 HPLC profile of the test substance and reference substance
2.1.5 方法学考察
2.1.5.1精密度试验精密吸取按“2.1.2”项制得的栀子苷对照品溶液10 μL,重复进样5次,结果显示,栀子苷峰面积的相对标准偏差(RSD)为0.43%,说明仪器的精密度良好。
2.1.5.2重复性试验取栀子药材粉碎,过筛,准确称取栀子药材1 g,5份,分别编为供试品提取液1~5号。设定微波功率300 W,超声功率300 W,提取时间12 min,按“2.1.3”项下供试品制备的方法制备供试品提取液。将获得的溶液按“2.1.1”项下的色谱条件进样测定,结果显示,栀子苷峰面积的RSD为2.71%,表明该方法重复性良好。
2.1.5.3稳定性试验取按“2.1.3”项下的方法制备的1号供试品提取液,按“2.1.1”项下的色谱条件分别于0、2、4、6、12、24 h进样测定,结果显示,栀子苷峰面积的RSD为1.45 %,表明供试品溶液在24 h内稳定。
2.1.5.4加样回收率试验准确称取6份栀子粉末,各0.5 g,精确加入与样品成分含量相等的栀子苷对照品,按“2.1.3”项下方法制备供试品溶液,将获得的溶液按“2.1.1”项下的色谱条件进样测定,计算栀子苷的回收率。栀子苷的回收率为98.34%,RSD=2.29%(n=6),表明该方法的回收率良好。
2.2 单因素试验
2.2.1 提取时间对栀子中栀子苷提取率的影响固定微波功率300 W,超声功率300 W,提取时间分别 设 为3、6、9、12、15、18 min,其 余 按“2.1.3”项下的方法进行栀子苷的提取,并用“2.1.1”项下的色谱条件测定栀子提取液中栀子苷的含量,并计算栀子苷提取率。
从图2可以看出,栀子苷提取率随着提取时间的延长呈现先上升后平缓下降的趋势,提取时间达到12 min时,栀子苷的提取率最大。这可能是由于随着提取时间的延长,超声微波提取的各种效应也随之增强,有利于栀子苷的溶出。当提取时间达到12 min时,栀子苷溶出完全。提取时间继续延长,杂质溶出逐渐增多,影响栀子苷的溶出,导致栀子苷的提取率下降。因此,选择提取时间12 min作为后续条件优化的参数。
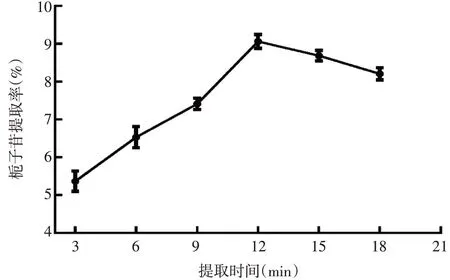
图2 提取时间对栀子苷提取率的影响Figure 2 The effect of extraction time on the yield rate of geniposide
2.2.2 微波功率对栀子中栀子苷提取率的影响固定超声功率300 W,提取时间12 min,微波功率分别设为100、200、300、400、500 W,其余按“2.1.3”项下的方法进行栀子苷的提取,并用“2.1.1”项下的色谱条件测定栀子提取液中栀子苷的含量,并计算栀子苷提取率。
从图3可知,微波功率增大,栀子苷提取率快速增大。当微波功率为300 W时,栀子苷提取率达到最大;微波功率继续增大,栀子苷提取率下降。这是由于微波功率增大,产生的热效应越大,有利于栀子苷的提取。微波功率超过300 W后继续增加,热效应的作用会导致部分栀子苷结构的破坏,从而导致栀子苷提取率下降。因此,选择微波功率300 W作为后续条件优化的参数。

图3 微波功率对栀子苷提取率的影响Figure 3 The effect of microwave power on the yield rate of geniposide
2.2.3 超声功率对栀子中栀子苷提取率的影响固定微波功率300 W,提取时间12 min,超声功率分别设定为100、200、300、400、500 W,其余按“2.1.3”项下的方法进行栀子苷的提取,并用“2.1.1”项下的色谱条件测定栀子提取液中栀子苷的含量,并计算栀子苷提取率。
从图4可以看出,超声功率增加,栀子苷提取率增大,当超声功率达到300 W时,栀子苷率达到最大。这可能是由于超声功率达到300 W时,所产生的空化效应及热效应使栀子苷基本溶出完全。超声功率继续增加,空化效应及热效应也随之增加,会破坏栀子苷的结构,增加杂质的溶出。因此,选择超声功率300 W作为后续条件优化的参数。
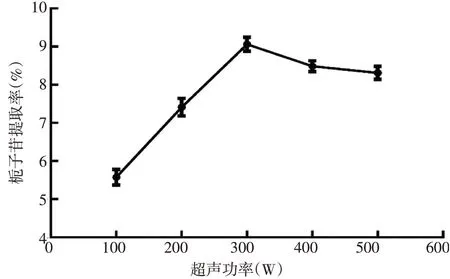
图4 超声功率对栀子苷提取率的影响Figure 4 The effect of ultrasonic power on the yield rate of geniposide
2.3 Box-Behnken效应面法优化试验的因素与水平根据单因素试验的结果,以栀子苷提取率为响应值,微波功率、超声功率、提取时间为自变量,采用Design-Expert 8.0.6软件进行Box-Behnken效应面法试验设计,优化栀子中栀子苷的提取工艺。优化试验的因素与水平见表1,结果见表2。
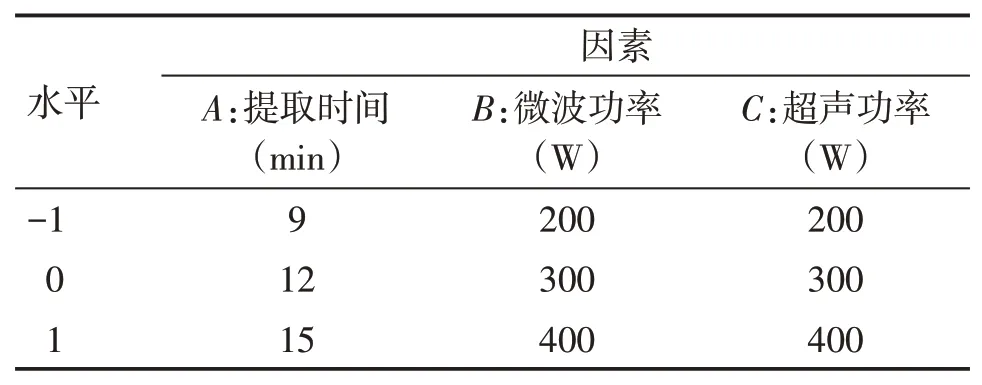
表1 Box-Behnken响应面法优化试验的因素水平表Table 1 Levels and factors of Box-Behnken response surface methodology test
2.3.1 模型建立与方差分析利用软件Design-Expert 8.0.6软件对表2中的数据进行多元二次回归,建立回归模型,得到的二次多项回归方程为:Y=9.058+0.247 5A-0.422 5B+0.237 5C+0.61AB+0.64AC+0.085BC-0.514A2-1.064B2-2.129C2。该模型的决定系数R2=0.991 1,调整系数R2Adj=0.979 7,说明所建立的模型稳定可靠,可用于栀子苷提取的优化及栀子苷提取率的预测。对回归方程进行方差分析,结果见表3。
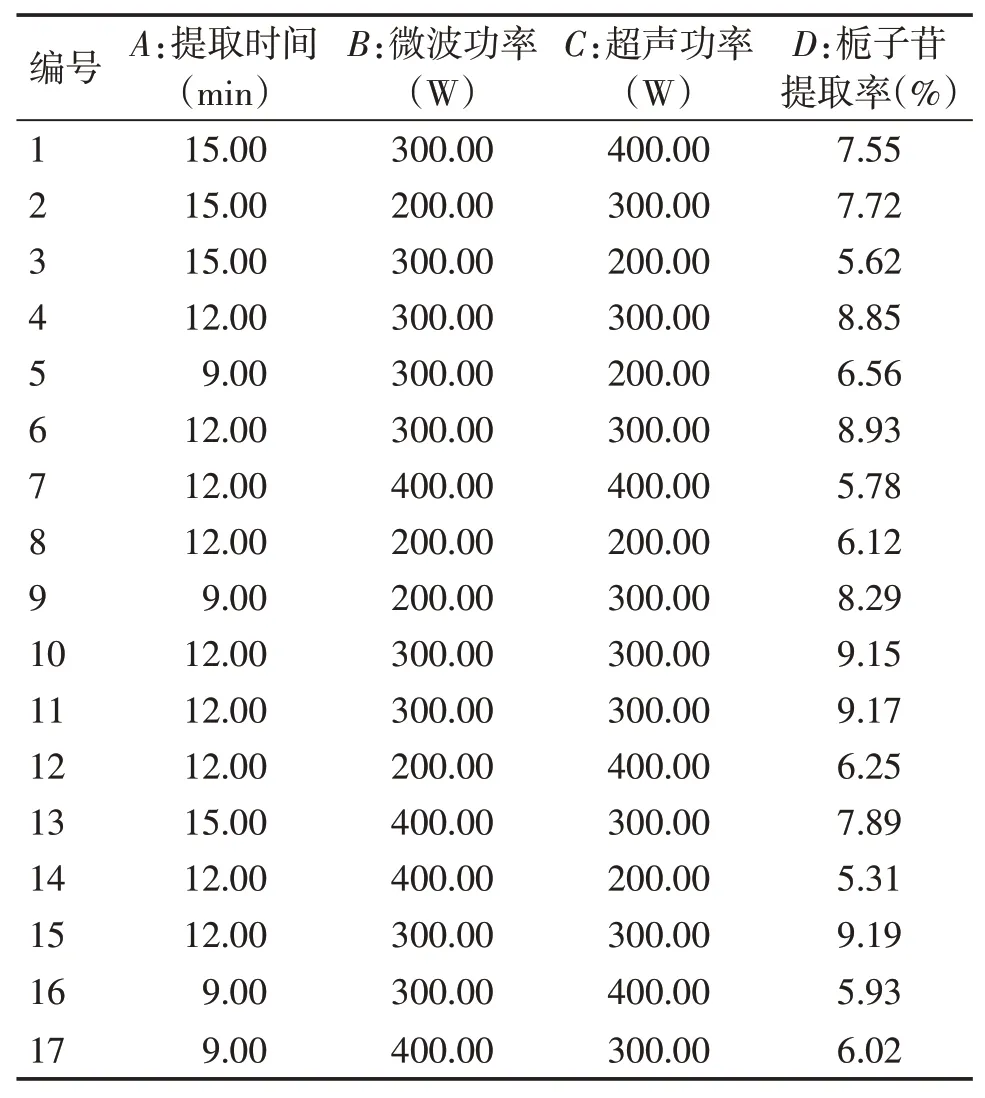
表2 Box-Behnken响应面法试验设计及结果Table 2 Design and results of Box-Behnken response surface methodology test
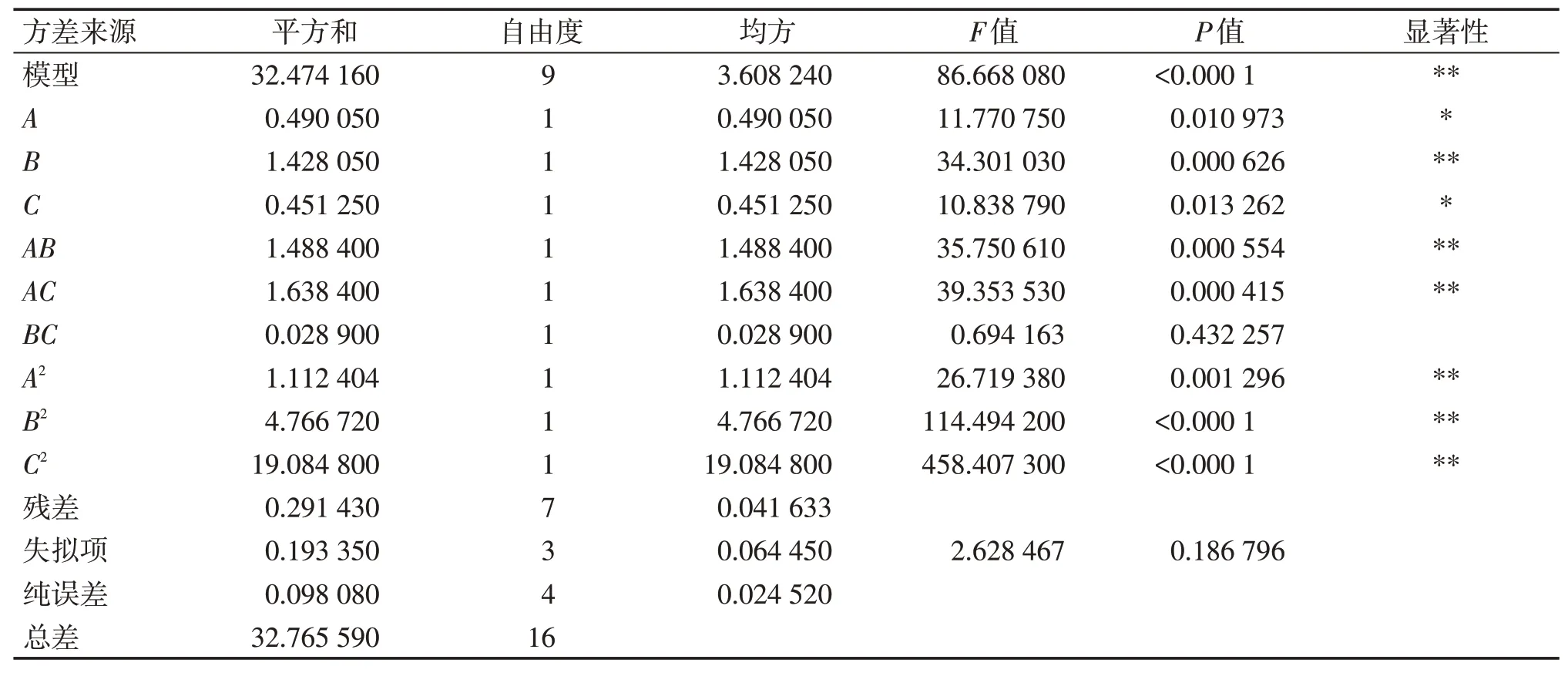
表3 回归模型的方差分析Table 3 Variance analysis results of regression model
根据表3数据可知,Box-Behnken效应面法试验所建立的回归模型F=86.668 08,P<0.000 1,说明所建立模型非常显著,具有统计学意义;失拟项P=00.186 796>0.05,无失拟项存在,说明本试验所选择的因素合理。由P值大小可知,各因素对栀子苷提取率的影响顺序为:微波功率>提取时间>超声功率。其中,B、AB、AC、A2、B2、C2对栀子苷提取率影响较大,达到非常显著水平(P<0.01),A、C对栀子苷提取率影响为显著水平(P<0.05),B、C影响不显著。
2.3.2 效应面分析交互因素的响应面图和等高线图见图5。从图5可知微波功率与提取时间、超声功率与提取时间的交互作用中等高线呈椭圆形,曲面较陡峭,微波功率与超声功率交互作用的等高线呈圆形,曲面坡度较缓。交互项的响应面和等高线的形状可知微波功率与提取时间、超声功率与提取时间取时间的对栀子苷提取率的影响较大,呈非常显著,而微波功率与超声功率对栀子苷的影响不显著,与回归分析的结果相吻合。
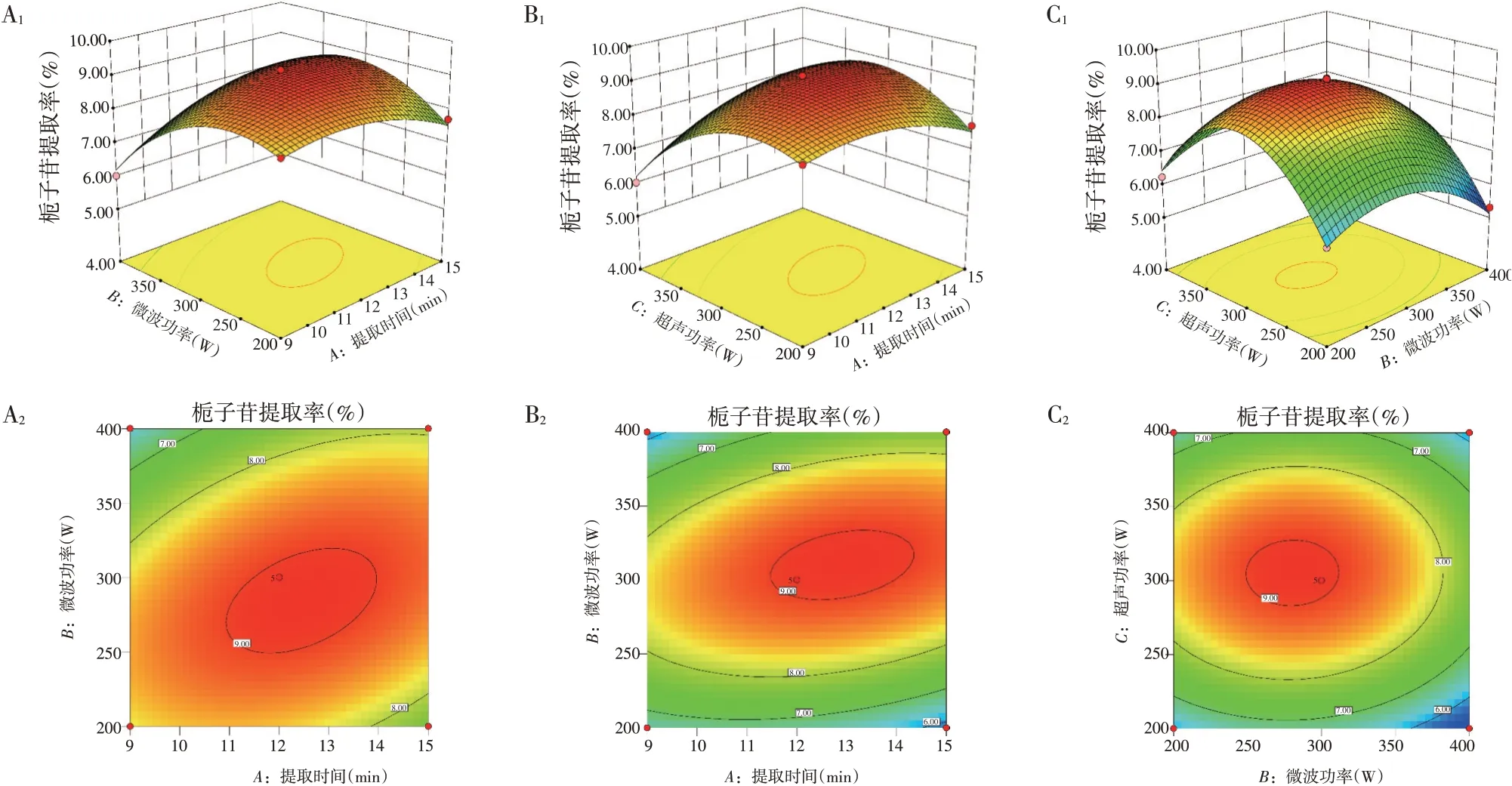
图5 不同因素的交互作用对栀子苷提取率影响的响应面图(A1、B1、C1)及等高线图(A2、B2、C2)Figure 5 The response surface diagrams(A1、B1、C1)and contour line plots(A2、B2、C2)for the effects of interaction of different factors on the yield rate of geniposide
2.3.3 工艺验证及不同提取方法比较Box-Behnken效应面法所拟合的响应面及等高线形状和已建立的回归模型,得到栀子苷提取的最佳工艺参数为:提取时间12.655 min,微波功率286.713 W,超声功率308.662 W,此条件下栀子苷的预测提取率为9.123%。为便于操作,将最佳提取工艺参数修正为:提取时间13 min,微波功率287 W,超声功率309 W,栀子苷的提取率为9.03%,与预测值相符,表明所建立的模型预测性良好。
按照最佳工艺参数分别进行微波提取和超声-微波协同提取,同时根据参考文献报道的超声提取方法[29]进行试验,结果见表4。从表4可知,在提取时间相同的条件下,同其他提取方法相比,超声-微波协同提取法获得的栀子中栀子苷提取率最高,可用于栀子中栀子苷的提取。

表4 不同提取方法所得栀子中栀子苷提取率的比较Table 4 Comparison of the yield rate of geniposide obtained by different extraction methods
3 讨论
前期通过预实验确定了提取溶剂为60%乙醇,液料比为50∶1(mL/g)。超声微波提取法得到的栀子苷提取率优于文献报道[30],且耗时较少。这可能是因为微波能节约时间,超声波能快速穿透细胞,超声微波相结合的提取方法充分利用了微波的高效能和超声的空化效应,能够强化传质、导致细胞分裂、提高渗透性,有利于成分的溶出。
本研究以栀子中栀子苷提取率为响应值,选用Box-Behnken效应面法对栀子苷提取中微波功率、超声功率、提取时间的影响因素进行了优化,得到栀子苷的最佳提取工艺为:提取时间13 min,微波功率287 W,超声功率309 W,栀子苷的提取率为9.03 %。该方法提取率高于单独微波提取和超声提取,可以提高栀子苷的提取率,有利于栀子苷的开发利用。
