影像组学联合表观弥散系数评估低级别脑胶质瘤IDH-1基因突变状态
2021-08-08程海平毛椿平刘余民
李 军 程海平 毛椿平 刘余民
荆门市第一人民医院,湖北 荆门 448000
根据最新2016年世界卫生组织(World Health Organization,WHO)中枢神经系统(central nervous system,CNS)肿瘤分类显示低级别脑胶质瘤(lower grade gliomas,LGGs)异柠檬酸脱氢酶-1(isocitrate dehydrogenase-1,IDH-1)突变状态的差异会导致患者的预后迥异[1-2]。国内外研究显示,根据IDH-1的突变状态对LGGs进行分子分型有助于协助临床制定个体化的治疗方案[3-4]。肿瘤异质性分为肿瘤时空异质性、肿瘤组成成分异质性、肿瘤微环境异质性,因此,针对LGGs患者进行IDH-1检测时,易由于肿瘤异质性导致准确性降低,且IDH-1突变的检测需通过取样活检的方式,对患者而言具有侵袭性[5-6]。通过磁共振弥散加权成像(diffusion-weighted imaging,DWI)计算水分子表观扩散系数(apparent diffusion coefficient,ADC),可用于评估组织内水分子的扩散运动。研究表明,ADC可用于作为无侵袭性方法评估脑胶质瘤的级别以及患者的预后[7-8]。影像组学(radiomics)可基于感兴趣区域影像提取纹理特征构建模型评估肿瘤信息,目前影像组学广泛用于评估肿瘤异质性[9-12]。因此,本研究尝试基于DWI提取影像组学特征联合ADC构建联合影像模型评估LGGs患者IDH-1的突变状态。
1 资料与方法
1.1一般资料本研究通过单位依托伦理委员会审查及批准,入组患者均签署知情同意书。回顾性纳入荆门市第一人民医院2015-05—2020-12经手术切除病理证实为Ⅱ~Ⅲ级的LGGs患者。排除标准:(1)患者IDH-1分子信息检测结果不明;(2)患者接受多模态磁共振扫描(multi-parametric MRI,mpMRI)后其MRI图像质量未满足诊断标准,或序列扫描不完整;(3)由于不可知因素导致ADC值无法测量。
1.2IDH-1突变检测IDH-1目前检测方法分为高通量测序方法和免疫组化染色法[3]。取术中切除肿瘤样本,切成大小≤1 cm3组织块常规石蜡包埋,切5 m切片。90℃烤片1 h,程序脱蜡后,pH 6.0的柠檬酸盐90℃抗原修复3 min,滴加10μL 3%过氧化氢3 min,加IDH-1鼠抗人单克隆抗体孵育1 h,5%PSB溶液洗片3次,加二抗孵育1 h,5%PSB溶液洗片3次,DAB显色,苏木精复染,中性树脂封片。由两位病理科医师进行独立阅片,随机取视野下5个视野点,进行阅片。IDH-1表达于细胞浆,因此细胞胞质内有棕黄色或棕褐色颗粒判为阳性细胞,结果按阳性细胞百分比评分,0~5%则属于IDH-1野生型,6%~100%则属于IDH-1突变型,每个患者的切片阅片均由两位病理医师独立阅片,最终取平均分。
1.3MRI扫描所有MRI扫描均采用3.0T MRI(Discovery 750,GE,USA),采用16通道头部线圈,患者仰卧位,头侧先进。所有患者接受T2WI、T2/FLAIR、DWI、增强T1WI扫描。DWI扫描参数:TR/TE=3 000 ms/60 ms,b1=0 s/mm2,b2=1 000 s/mm2,FOV=250 mm,层厚/层间距=5 mm/2 mm,重建矩阵=256×256,扫描时长48 s;增强T1WI扫描参数:TR/TE=10.2 ms/4.8 ms,翻转角(Flip angle)=10°,FOV=250 mm,层厚/层间距=5 mm/2 mm,重建矩阵=512×512,静脉团注钆造影剂Gd-DOTA(恒瑞医药,中国),采用0.1 mmol/kg浓度,2 mL/s流速;T2WI扫描参数:TR/TE=3 000 ms/80 ms,成像时长4 min 30 s,FOV=200 mm,层厚/层间距=5 mm/2 mm,重建矩阵=512×512;T2/FLAIR扫描参数:TR/TE=9 000 ms/100 ms,成像时长2 min 10 s,FOV=200 mm,层厚/层间距=5 mm/2 mm,重建矩阵=512×512。
1.4影像组学分析由本科室两位5~10年诊断经验医师遵循单盲原则进行肿瘤病灶分割,首先分别基于b=0 s/mm2、1 000 s/mm2DWI图像在工作站上转换为ADC mapping,并在工作站中计算病灶的平均ADC值。分割时基于T2WI、FLAIR、增强T1WI作为结构对比,将ADC mapping导入ITK-SNAP(version 3.8.0)上勾画肿瘤每一层病灶,最后合成3D病灶。勾画时需注意尽量避免血管以及坏死区域。基于python导 入 pyradiomics包(https://pyradiomics.readthedocs.io/en/latest/)提取影像组学特征,共395个特征,其中包括First order features、shape features、GLCM features、GLRLM features、GLSZM features、RLM features。继而按照随机分层的原则将患者按照7∶3比例分为训练组和测试组,基于训练组患者进行影像组学特征去冗除杂,首先采用最小冗余、最大相关(max-relevance and min-redundancy,mRMR)进行特征降维,继而以IDH-1是否突变采用套索回归(least absolute shrinkage and selection operator,LASSO)构建影像组学标签,并联合患者ADC构建多元逻辑回归模型评估患者IDH-1是否突变,最后采用ROC、Hosmer-Lemeshow以及ADC评估模型效能。
1.5统计学分析采用R4.0.3和R studio进行统计分析,采 用“tidyverse”“caret”“pROC”“rms”“Publish”“glmnet”“ModelGood”“ggpubr”“rmda”“DescTools”“mRMR”“e1071”程辑包。以P<0.0为差异有统计学意义。
2 结果
2.1临床资料回顾性筛选280例,其中112例由于mpMRI扫描序列不全排除,48例无IDH-1突变检查结果;最终纳入120例患者,按照7∶3的比例分层随机的原则分为训练组和测试组,其中训练组患者85例,测试组患者35例;训练组患者年龄(51.3±7.2)岁,女39例,男46例;测试组患者年龄(51.7±7.6)岁,女18例,男17例;其中训练组IDH-1野生型30例,突变型55例,测试组IDH-1野生型12例,突变型23例;训练组中ADC为(0.916±0.246)×10-3mm2/s,测试组中ADC为(0.954±0.197)×10-3mm2/s。训练组与测试组患者的年龄、性别、WHO分级类型、肿瘤病理类型、IDH-1类型、ADC差异均无统计学意义(P>0.05,表1)。
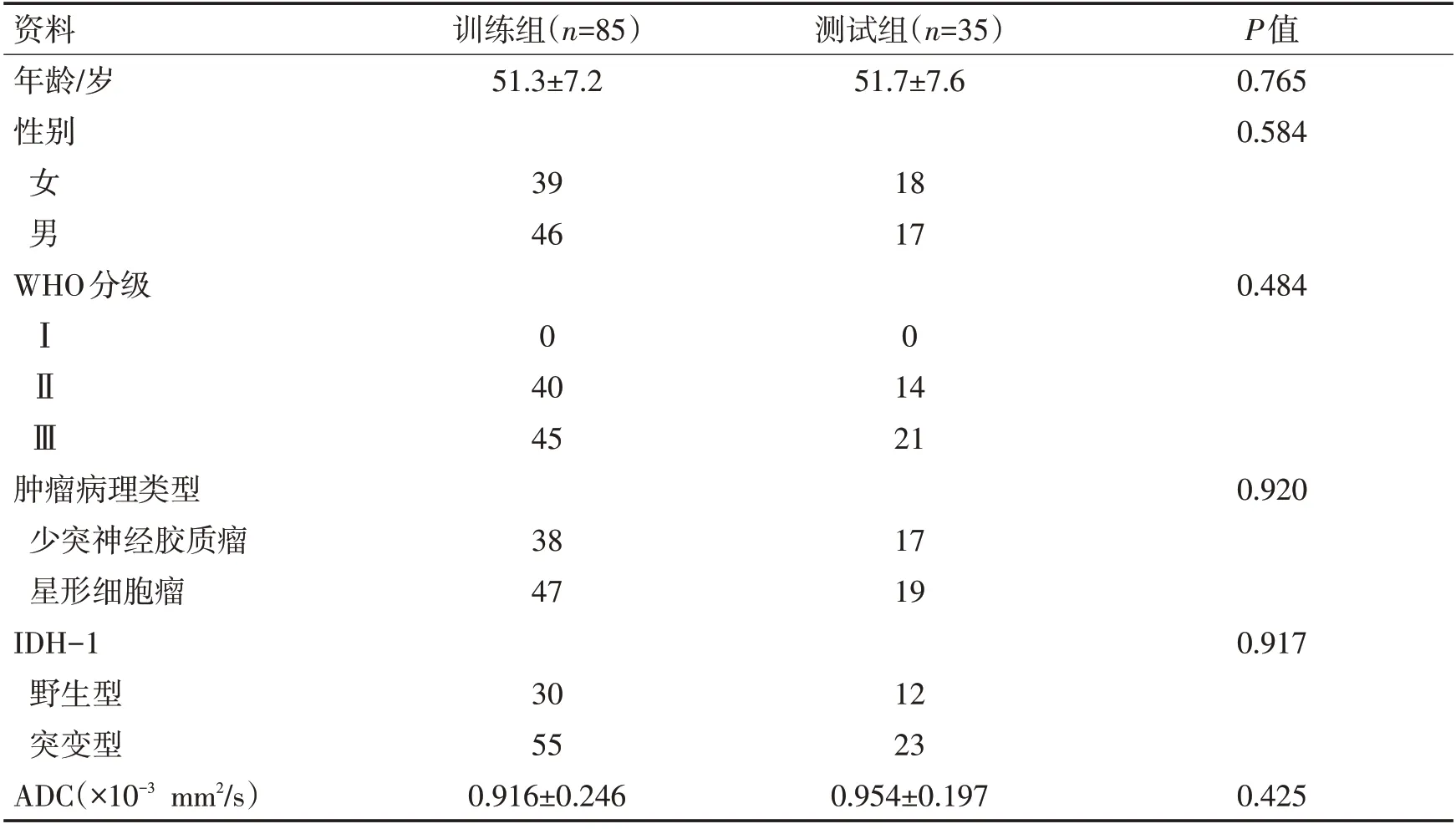
表1 训练组和测试组患者的临床特征Table 1 Clinical data of patients in two groups
2.2IDH-1突变影像组学标签构建基于训练组中所有患者的影像组学特征,以IDH-1是否突变为分类标签,采用LASSO进行影像组学特征降维后,取最小惩罚系数Logλ=0.005 2对应的特征集合(图1A),共15个影像组学特征构建影像组学标签Rad_score,15个影像组学特征在构建Rad_score时权重系数不同(图1B)Rad_score的计算公式如下:
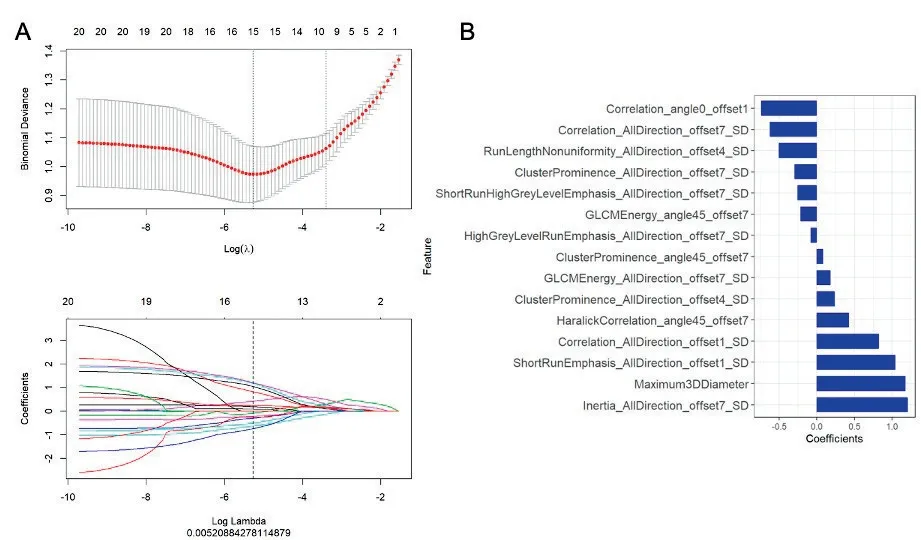
图1 影像组学特征降维LASSO图以及构建影像组学标签影像组学特征权重系数图A:LASSO回归中采用十折交叉验证方法,A上图通过调节惩罚系数从而降低影像组学标签的二项式偏差,最小二项式偏差对应最小惩罚系数对应的特征集合则具有最佳分类效能;A下图为LASSO筛选特征的特征系数收敛图,图中的每条曲线代表了不同惩罚系数对应的自变量系数的变化轨迹,虚线为上图中最小惩罚系数,此时特征个数为15个;B:当取最小惩罚系数时,对应的特征集合以及每个特征的权重系数值Figure 1 Dimension reduction LASSO diagram of radiomics features and weight coefficient diagram of radiomics constructed for radiomics signature.A:10-fold cross validation method was used in LASSO regression.In figure A,the binomial deviation of radiomics signature was reduced by adjusting the penalty coefficient,and the feature set corresponding to the minimum binomial deviation corresponding to the minimum penalty coefficient had the best classification efficiency.In figure A,the following figure is the feature coefficient convergence graph of LASSO screening features.Each curve in the figure represents the change track of the independent variable coefficient corresponding to different penalty coefficients.The dotted line in the figure is the minimum in the figure above,and the number of features is 15.B:when the minimum is taken,the corresponding feature set and the weight coefficient value of each feature

2.3影像组学标签鉴别IDH-1突变效能根据Rad_score公式计算训练组和测试组中每个患者的Rad_score,训练组中IDH-1野生型患者Rad_score低于IDH-1突变型患者,且差异有统计学意义(P=0.000 002 5,图2A);测试组中IDH-1野生型患者Rad_score低于IDH-1突变型患者Rad_score,且差异有统计学意义(P=0.001 8,图2B)。采用ROC评估Rad_score鉴别训练组和测试组中IDH-1突变和野生型患者,训练组AUC为0.83(95%CI:0.74~0.92,图2C),测试组AUC为0.83(95%CI:0.66~1.00,图2D)。
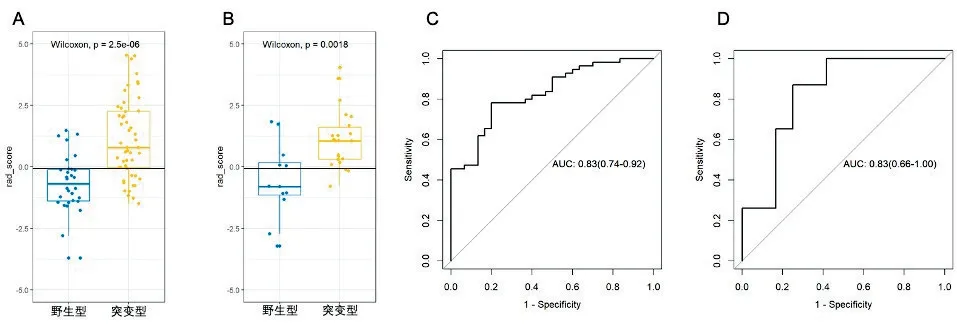
图2 影像组学标签Rad_score在IDH-1野生型和突变型的差异以及Rad_score鉴别IDH-1野生型和突变型的ROC分析A:训练组IDH-1野生型和突变型患者Rad_score箱图,基于Rad_score计算公式计算训练组中IDH-1野生型和突变型患者的Rad_score,采用Mann-Whitney检测,P<0.05;B:测试组IDH-1野生型和突变型患者Rad_score箱图;C:训练组中Rad_score鉴别IDH-1野生型和突变型效能ROC分析;D:测试组中Rad_score鉴别IDH-1野生型和突变型效能ROC分析Figure 2 The difference between IDH-1 wild-type and mutant by Rad_score and ROC analysis of Rad_score in identifying IDH-1 wild-type and mutant.A:Rad_score box chart of wild type and mutant IDH-1 patients in the training group.Rad_score of wild type and mutant IDH-1 patients in the training group was calculated based on the calculation formula of Rad_score,and the difference of Rad_score between wild type and mutant IDH-1 patients was detected by Mann-Whitney,P<0.05,which means statistically significant.B:Rad_score box diagram of wild type and mutant IDH-1 patients in the test group.C:ROC analysis of the efficacy of Rad_score in identifying wild-type and mutant IDH-1 in the training group.D:ROC analysis of the efficacy of Rad_score in identifying wild and mutant IDH-1 in the test group
2.4Rad_score联合ADC构建联合模型评估IDH-1突变以训练组患者ADC和Rad_score构建多元逻辑回归模型Imagemodel,Imagemodel中截距值为16.091,ADC权重系数值为 16.326 1,Rad_score权重系数值为0.874 7,并采用Nomogram可视化(图3A)。分别采用ROC评估Imagemodel、ADC以及Rad_score鉴别IDH-1突变,训练组中Imagemodel的AUC值>ADC>Rad_score(0.98 vs 0.95 vs 0.83,图3B),测 试 组 中Imagemodel的AUC值>ADC>Rad_score(0.99 vs 0.97 vs 0.83,图3C)。
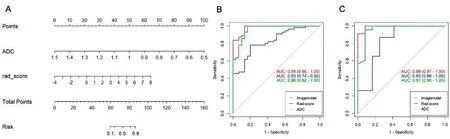
图3 ADC联合Rad_score构建多元逻辑回归模型Imagemodel可视化Nomogram评估IDH-1突变型风险以及Imagemodel、ADC和Rad_score鉴别IDH-1突变型效能 A:Imagemodel可视化Nomogram,使用Nomogram时,首先提取患者影像组学特征,计算患者Rad_score,带入Nomogram中Rad_score基线上垂直于Points基线得到Rad_score得分,继而带入患者ADC值于Nomogram中ADC基线上垂直于Points基线得到ADC得分,将ADC得分与Rad_score得分相加得到该患者的总得分,并找到Total Points上总得分值的相应位置,最后垂直于Risk线即得到该患者为IDH-1突变型的风险值;B:Imagemodel、ADC以及Rad_score在训练组中鉴别IDH-1突变型和野生型的ROC分析;C:Imagemodel、ADC以及Rad_score在测试组中鉴别IDH-1突变型和野生型的ROC分析Figure 3 Multi-Logistic regression model built by ADC and Rad_score,Imagemodel visualized by Nomogram to assess the risk of IDH-1 mutation and the efficacy of Imagemodel,ADC and Rad_score in identifying IDH-1 mutation.A:For this Nomogram,take the patient's Imagemodel visual Nomogram and calculate the patient's Rad_score,then take the patient's ADC score from the Nomogram baseline perpendicular to the points baseline to get the Rad_score,add the ADC score to the Rad_score to get the total score,and find the corresponding position of the total points,and finally perpendicular to the risk line,the risk value of the patient is IDH-1 mutant.B:ROC analysis of Imagemodel,ADC and Rad_score to identify IDH-1 mutant and wild-type in the training group.C:ROC analysis of Imagemodel,ADC and Rad_score to identify mutant and wild-type IDH-1 in the test group
2.5Imagemodel模型诊断效能评估校准曲线表明,Imagemodel在训练组(图4A)和测试组(图4B)中预测IDH-1突变的概率和实际IDH-1突变的概率具有良好的一致性。Hosmer-Lemeshow检验表明,训练组和测试组的Imagemodel预测IDH-1与实际情况的差异无统计学意义(P=0.414 7 vsP=0.896 7)。Imagemodel、ADC以及Rad_score预测模型的ADC曲线显示,Imagemodel的曲线净收益高于其他两种预测模型(图4C)。
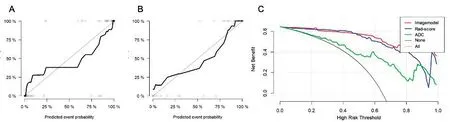
图4 Imagemodel预测IDH-1突变的校正曲线和Imagemodel、ADC以及Rad_score决策曲线分析 A:训练组中Imagemodel预测IDH-1突变的校正曲线;B:测试组中Imagemodel预测IDH-1突变的校正曲线;C:Imagemodel、ADC以及Rad_score评估IDH-1突变型的决策曲线,Imagemodel、ADC以及Rad_score进行预测后的临床收益均优于随机预测(粉色)和拒绝评估(黑色)Figure 4 Correction curve of Imagemodel predicting IDH-1 mutation and DCA analysis of Imagemodel,ADC and Rad_score.A:Calibration curve of Imagemodel predicting IDH-1 mutation in the training group.B:calibration curve of IDH-1 mutation predicted by ImageModel in the test group.C:DCA analysis of IDH-1 mutant was evaluated by Imagemodel,ADC,and Rad_score.The clinical benefits predicted by Imagemodel,ADC,and Rad_score were all superior to random prediction(pink)and rejection assessment(black)
3 讨论
本研究基于DWI生成ADC mapping提取影像组学构建Rad_score进行LGG患者是否IDH-1突变研究,训练组及测试组中野生型患者Rad_score均低于突变型患者(P<0.05),且Rad_score在训练组和测试组的LGG患者均展示较高诊断效能,因此基于ADC构建Rad_score可以协助临床进行IDH-1无侵袭性评估。同时,利用LGG病灶平均ADC值进行直线回归模型评估,结果显示,ADC评估LGG患者IDH-1是否突变也具有较高诊断效能,继而联合ADC与Rad_score构建多元逻辑回归模型Imagemodel用以评估LGG患者IDH-1突变,Imagemodel有效提高IDH-1分子分型的诊断,Hosmer-lemeshow以及ADC分析均显示采用Imagemodel对患者进行分子分型评估时具有较高临床收益。
前期研究中,ADC值作为无侵袭性水分子标志物在脑胶质瘤的诊断、预后均具有较好的诊断效能。TAKAHASHI等[13]检测55例胶质瘤患者发现,胶质母细胞瘤和LGG患者之间ADC值差异显著,利用ADC鉴别胶质母细胞瘤和LGG准确度>95%;同时ADC可用于脑胶质瘤患者治疗后的疗效分析,NOWOSIELSKI等[14]研究发现HGG患者接受抗血管生成治疗后,可利用治疗期间的ADC mapping的直方图偏斜度评估HGG患者对于该治疗方案的疗效。因此,ADC可用于尝试无侵袭性的途径评估脑胶质瘤疾病。本研究在构建影像组学标签后,同时利用训练组患者ADC构建模型评估患者IDH-1突变状态,ADC在训练组和测试组中鉴别IDH-1突变的诊断效能较高,可有效分辨IDH-1突变型和野生型。MAYNARD等[15]针对82例IDH-1野生型患者和107例IDH-1突变患者测量ADC,分类准确度达80%以上,与本研究结果类似。本研究显示ADC构建模型评估IDH-1突变的效能高于Rad_score。国内外研究显示,联合ADC与影像组学可有效提高影像定量评估的准确性,KIM等[16]研究发现单个ADC或血流灌注参数构建模型诊断胶质瘤的疾病进展较好,然而再联合Radiomics后,可提高无侵袭性定量评估胶质瘤疾病进展的预测效能。本研究中虽然ADC的诊断效能高于Rad_score,然而联合两者后发现诊断效能高于ADC及Rad_socre,与KIM等[16]研究相符。因此,在目前功能MRI定量诊断、预测疾病的同时,联合影像组学可提高模型诊断效能。
本研究中联合ADC与Rad_score构建多元逻辑回归模型进行疾病评估,该模型最终可采用公式进行表达,然而在实际运用过程中,将患者的数据直接带入公式存在一定的计算量,因此本研究采用Nomogram进行模型可视化,Nomogram可在平面坐标中基于分类模型中不同参数值的权重系数做线段,直接将患者的指标值带入对应线段中进行加和,最终获得患者是否某一种分类的风险值,可提高模型的实用性,因此目前Nomogram常见于分类模型以及生存模型的可视化[17-19]。
IDH-1基因突变对于胶质瘤患者的预后具有重要意义。研究表明LGG患者若出现IDH-1突变,预示患者接受放化疗预后较好,可较好延长患者生存期[20-22]。然而IDH-1的检测方法始终存在侵袭性[23-25],因此本研究尝试给予影像无侵袭性的方式评估LGG患者IDH-1突变状态,联合模型Imagemodel最终显示较好的诊断效能。
本研究存在以下局限性:(1)本组病例样本偏少,后期需要扩大样本量研究;(2)本组患者均属于本院患者,Imagemodel的可重复性以及稳定性需要在非本院的多中心医院进行验证,后期需要扩大中心进行研究。
本研究基于LGG患者术前DWI影像计算ADC mapping提取患者病灶ADC值,并联合影像组学构建联合模型,从而在术前预测患者的IDH-1突变状态,协助临床评估患者是否需要术前采取放化疗,从而改善患者的预后。
