新型心肌锚定器械设计
2021-08-07王奔姚天平马正宇姚瑶李俊菲
王奔,姚天平,马正宇,姚瑶,李俊菲
1 上海微创医疗器械(集团)有限公司,上海市,201203
2 上海市医疗器械检验研究院,上海市,201318
0 引言
左心室室壁瘤(left ventricular aneurysm,LVA),是指左心室壁的部分区域出现运动减弱、运动停止、运动失常的现象,包含经典的由瘢痕组织形成的囊袋性室壁瘤和所有导致左室射血分数减少的无收缩功能,含存活心肌的薄壁瘢痕区域。室壁瘤通常发生在急性心肌梗死之后,因心肌坏死区域的收缩力减弱或消失,导致其在心室压力下向外膨胀而形成,充血性心力衰竭、致死风险的室性心律失常、猝死是其常见临床现象。室壁瘤的治疗机理基于拉普帕斯定律,Wallstress=K× (Pressure×Radius)/Thickness,通过降低室壁应力延缓或者逆转心室重塑、心室扩张的进程[1-2]。在血压不变的情况下,减小左室容积,增加左室壁厚是常规治疗理念。经典的左心室减容术疗效确切,包括标准线性缝合术和补片术,均是对室壁瘤薄壁区域切除后缝合,从而降低左室容积,提高平均壁厚,以达到左室重建的目的。然而传统手术需要患者在心脏停跳、体外循环下进行,开胸尺寸大、风险大、死亡率高、并发症发生率高,对医生的技能和患者的身体素质要求较高。
心肌锚定作为一种微创伤手术器械,可不通过心脏停跳及体外循环的方式对室壁瘤进行锚定折叠,从而完成对左心室的减容。现有的器械已完成初步的临床试验,术后效果良好,但也面临一些问题,如测力信噪比低、操作繁琐等。下面介绍一种新型心肌锚定器械以克服此类问题。
1 心肌锚定器械手术原理
心肌锚定是一种通过对室壁瘤进行折叠、铆合从而降低左室容量、提高平均壁厚的手术器械。该手术无需切除室壁瘤,无需对患者进行体外循环,开胸尺寸小,属于微创伤手术。心肌锚定原理,如图1所示。
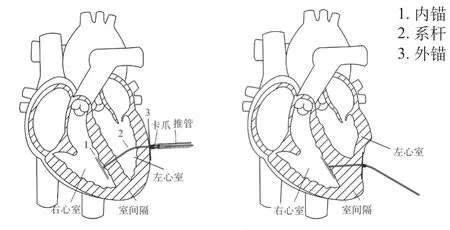
图1 心肌锚定原理Fig.1 Schematic diagram of Revivent TC system
在从颈静脉-右心室-左心室-胸腔至体外的通道建立完成后,内锚被留在了右心室室间隔位置,系杆的近端穿过左心室被送至体外。内锚植入原理,如图2所示。外锚中的方孔穿过系杆,并沿着系杆被推向内锚。两者配合,如图3所示。当外锚被推至与室壁瘤贴合后,测力手柄开启测力模式,使外锚在被进一步推进时显示推送力。测力手柄工作原理,如图4所示。当推送力超过舒张压力2~6 N时,停止推送外锚,完成内、外锚对室壁瘤的锚定。
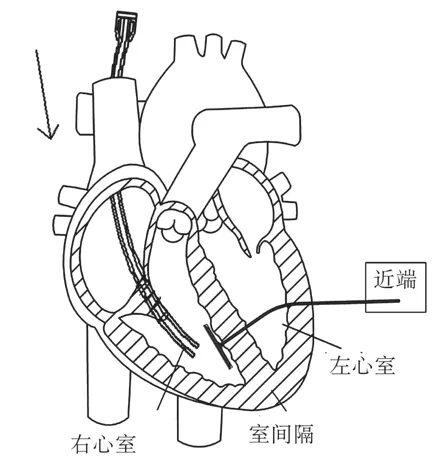
图2 内锚植入原理Fig.2 Impant method of internal anchor
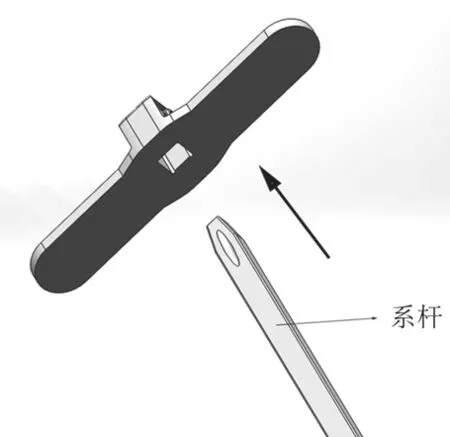
图3 系杆-外锚配合示意图Fig.3 Matching of tether and external anchor
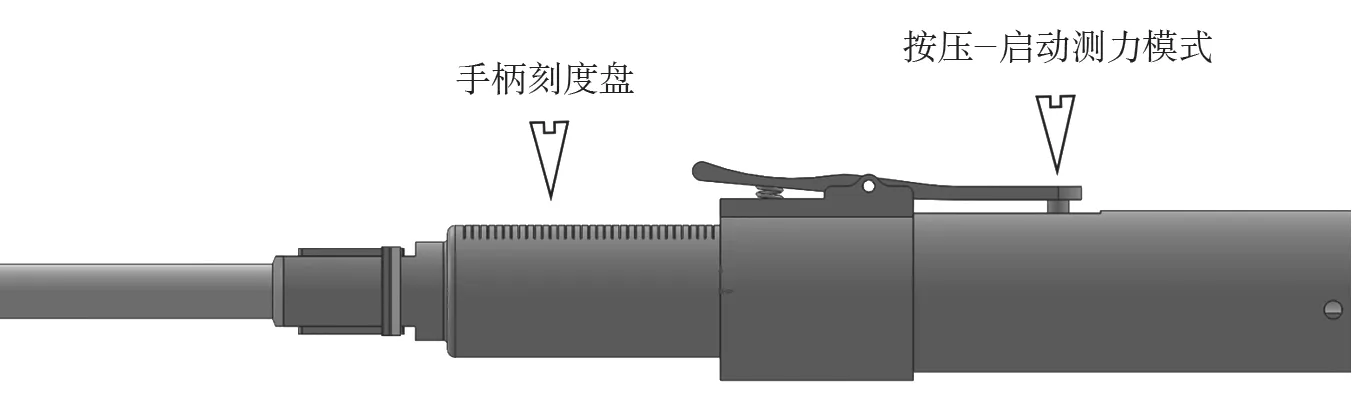
图4 测力手柄工作原理Fig.4 Working principle of force-measuring device
外锚沿着系杆的单向运动和测力手柄是心肌锚定器械的两项关键技术。
(1)其中单向运动是指当外锚的内孔穿过系杆后,外锚只能沿着系杆往朝向内锚的方向运动,反向运动则被自锁。目的是当外锚在推到底之前,能够自锁在系杆上不至滑落,由于手术过程中,心脏不断的跳动,这种步步为营的推进方式为术者提供更便捷的操作空间。
(2)测力手柄除推送功能外,可精确测量内、外锚的贴合力,以此作为外锚可释放的依据。因为若内、外锚贴合力过低,则室间隔和室壁瘤的贴合不紧,易产生残余缝隙从而导致血栓。若贴合力过高,锚定区域血流不畅易导致组织坏死。
2 心肌锚定器械的现状
Bioventrix公司于2005年[3]开始研发心肌锚定器械,目前该公司的器械已进入临床试验阶段,取得良好的短期疗效[4]。该器械通过一种棘轮弹簧结构实现外锚相对系杆的单向无极运动,通过释放器控制棘轮使其不与系杆啮合,保证外锚方孔顺利穿过系杆,通过测力手柄对外锚进行推送,并在测力模式下将内、外锚的贴合力控制在适当水平。其中,外锚结构,如图5所示。外锚啮合(解啮合)原理,如图6所示。
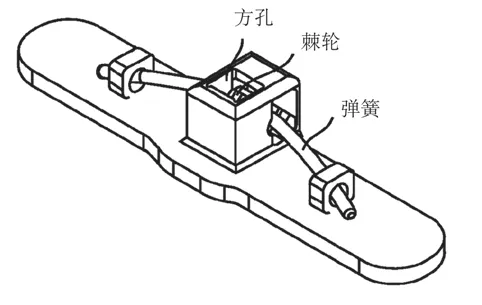
图5 外锚结构示意图[5]Fig.5 Structure of external anchor[5]
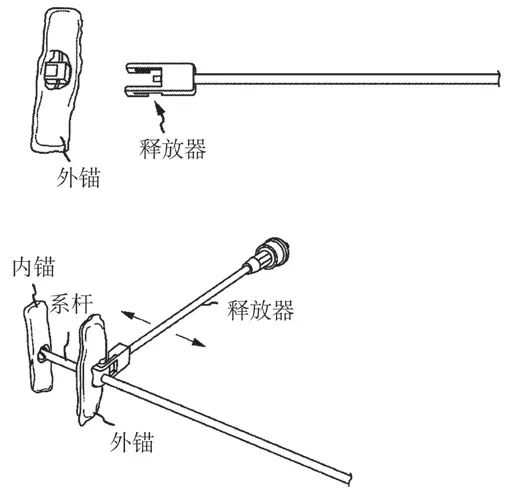
图6 外锚啮合(解啮合)原理[5]Fig.6 Engage(or dis-engage) of external anchor[5]
该器械在临床使用过程中面临一些难题:
(1)外锚在向系杆远端推送测力时,弹簧仍然联动棘轮与系杆啮合,因此外锚与系杆之间存在一定的摩擦力,因该摩擦力波动大、难以预估,影响测力手柄测力的准确性。
(2)释放器的目的仅用于辅助外锚穿过系杆,在穿过系杆后必须撤去释放器并更换测力手柄。若需回收外锚时,则又须从外锚上撤出手柄更换为释放器,对术者而言较为繁琐,手术过程较长。
(3)伸出的弹簧丝包覆于覆膜中,释放器远端的抓钩不易抓捕。
3 新型心肌锚定器械的设计
基于对已有器械的总结分析,从以下三点对器械进行重新设计:①测力时,须消除棘轮、系杆啮合带来的摩擦力;②取消释放器的设计,使其集成至测力手柄中;③棘轮、系杆的啮合情况须被自由方便地控制。
新型心肌锚定器械设计如下:
(1)外锚(棘轮弹簧结构)设计:扭杆弹簧代替镍钛弹簧,可有效地防止弹簧的突出,节约空间,方便覆膜,同时防止脱落。正常情况下,扭杆弹簧对棘轮有一定的预压力,使棘轮与系杆啮合。转轴机构可通过前轴的上下运动,将运动传递至后轴,使其带动棘轮作前后转动,实现棘轮对系杆的啮合和解啮合。外锚的转轴机构,如图7所示。
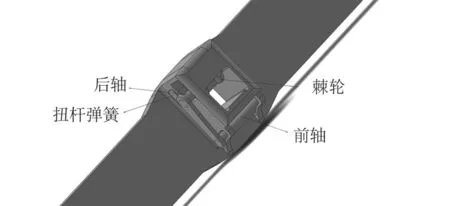
图7 外锚的转轴机构Fig.7 Shaft-turning of external anchor
(2)测力手柄设计:测力手柄的远端设有镍钛弹性抓钩,初始状态下存在径向朝外的弹性力,用于抓取外锚的前轴,赋予其上下运动的动力。测力手柄,如图8所示。测力手柄与外锚的配合,如图9所示。
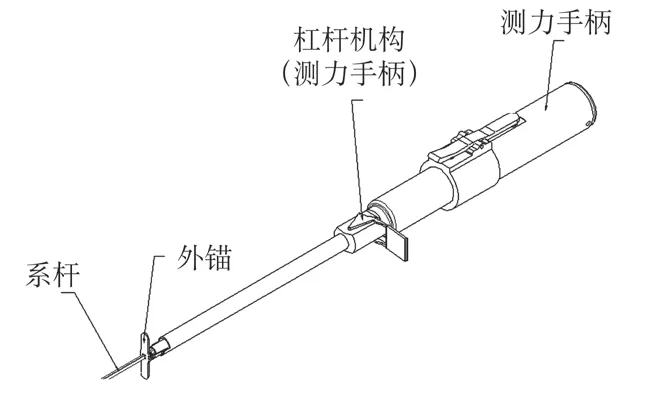
图8 测力手柄示意图Fig.8 Schematic diagram of force-measuring device
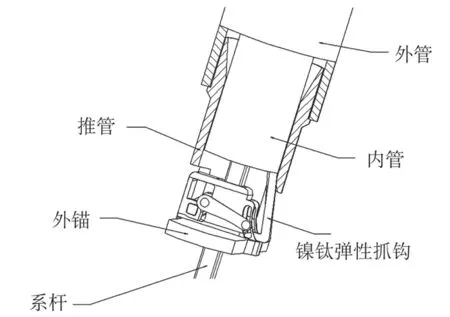
图9 测力手柄与外锚的配合示意图Fig.9 Matching of force-measuring device and external anchor
新型心肌锚定器械工作原理:使用前,外锚预安装在测力手柄上,手柄的推管压住外锚的上表面,手柄最远端的镍钛弹性抓钩勾住外锚的前轴,逆时针扳动手柄上的杠杆机构使其带动内管(及镍钛弹性抓钩)相对于外管往里运动,同时外锚的前轴跟随镍钛弹性抓钩往上运动带动棘轮往后转动,到达解啮合状态。
此时系杆从外锚的中心孔穿过并一直穿过测力手柄直至其近端。术者手持手柄近端的系杆,推动测力手柄和外锚沿着系杆向心脏滑去,当外锚贴合心脏时,将测力手柄调至测力模式,继续推进直至超过舒张压力的2~6 N后停止推送。由于此时外锚对系杆处于解啮合状态,因此推送测力时,可达到无摩擦力状态,提高内、外锚贴合力测试的信噪比。顺时针扳动杠杆机构,使镍钛弹性抓钩径向弹出,释放前轴,此时棘轮在扭杆弹簧的作用下旋转啮合系杆,实现对室壁瘤区域的锚定。
当需调整锚定位置时,测力手柄可用同样的方式与外锚配合,使其解啮合,从系杆上取出,实现外锚的可回收。
4 临床应用
对患者而言,左室壁与室间隔的贴合力(锚定力)直接影响术后的安全性,锚定力过低则贴合不紧,容易引起贴合间隙处产生血栓等不良事件,锚定力过高则容易导致贴合处产生瘀斑进而导致组织坏死。相较于目前的心肌锚定器械,新型心肌锚定器械在推进外锚时实现精确测力,能更有效地降低血栓、瘀斑等不良事件的发生概率,提高手术的安全性。表1为新型器械与现有器械的测力性能对比。对术者而言,新型心肌锚定器械无需通过释放器辅助器械配合、回收,在释放器和测力手柄之间反复切换,仅通过一套测力手柄实现全套过程,简化了手术流程,缩短了手术时间。

表1 新型器械与现有器械的测力性能对比Tab.1 Comparison of force-measuring performance between the new design and the existing device
5 总结与展望
介绍了室壁瘤及其治疗对策,总结和分析现有心肌锚定器械的临床使用现状,从精确测力和简化手术两个主要方面,提出心肌锚定器械的设计思路,研发出一款新型的心肌锚定器械。本设计的安全有效性尚需研究和验证,将在后续阶段中通过实际的动物实验和临床试验来进一步确认。
