免疫缺陷小鼠奇异变形杆菌的分离鉴定与药物治疗
2021-08-06马贯中刘婕妤王利云张韬
马贯中 刘婕妤 王利云 张韬

摘要 从有腹泻症状的免疫缺陷小鼠体内分离出1株病原菌。对该分离菌株进行生化鉴定、16S rDNA测序和迁徙行为观察。经迁徙行为观察发现,该菌在1.5%LB上呈现弥漫性生长,在0.5%、1.0%的LB平板上的未见迁徙现象。该菌在DHL平板上的菌落特点与沙门氏菌相似,通过沙门氏菌手工生化鉴定、ATB细菌鉴定及16S rDNA分子测序比对证实该菌为奇异变形杆菌。通过药敏试验发现,该菌株对喹诺酮类药物敏感,抑菌圈直径为18~20 mm,而对多数药物中度敏感或不敏感。给腹泻小鼠饲喂喹诺酮类药物后,腹泻症状明显改善,发病率明显下降。该研究结果为奇异变形杆菌引起的免疫缺陷小鼠腹泻疾病的诊断和治疗提供了参考。
关键词 奇异变形杆菌;NYG小鼠;生化鉴定;动物试验;迁徙行为
中图分类号 S-852.61+2 文献标识码 A 文章编号 0517-6611(2021)13-0086-06
doi:10.3969/j.issn.0517-6611.2021.13.021
开放科学(资源服务)标识码(OSID):
Isolation, Identification and Medical Treatment of Proteus mirabilis in Immunodeficient Mice
MA Guan zhong, LIU Jie yu, WANG Li yun et al
(Animal Core Facility of Nanjing Medical University,Nanjing,Jiangsu 211166)
Abstract A strain of pathogen was isolated from immunodeficient mice with diarrhea symptoms. The isolated strain was identified by biochemical identification, 16S rDNA sequencing and migration behavior observation. Through the migration behavior observation, it was found that the isolated strain showed diffuse growth on 1.5% LB and no migration on 0.5% and 1.0% LB plates. The colony characteristics of this strain on DHL plate were similar to that of Salmonella sp. The isolated strain was confirmed as Proteus mirabilis by manual biochemical identification, ATB bacterial identification and 16S rDNA molecular sequencing comparison. The drug sensitivity test also showed that the strain was sensitive to quinolones, with the inhibition zone diameter of 18-20 mm. But it was moderately sensitive or not sensitive to a variety of drugs. After the diarrhea mice were fed with quinolones, diarrhea symptoms were significantly improved, the incidence was significantly reduced. This study results provided references for the diagnosis and treatment of diarrhea caused by Proteus mirabilis.
Key words Proteus mirabilis;NYG mice;Biochemical identification;Animal experiment;Migration behavior
奇异变形杆菌为无荚膜、无芽孢、有鞭毛和有菌毛的革兰阴性杆菌,其广泛分布于自然界、动物粪便、临床标本以及人和动物的肠道内,是导致人和动物感染的重要条件致病菌。当机体抵抗力下降时,可引起脑膜炎、腹膜炎、败血症、尿路感染和呼吸道感染[1-2]。近年来,奇异变形杆菌感染流行趋势不断扩大,关于猪[3]、狐狸[4]、鸽子[5]、貂[6-7]、大熊猫[8]、大黄鱼[9]等动物及动物性食品[10-11]感染奇异变形杆菌的报道屡见不鲜,给人类和畜牧業发展带来较大的经济损失。此外,该菌还可引起人类原发性或继发性感染,也能造成人类食物中毒,其作为人畜共患传染病病原,应引起重视。
NYG小鼠为南京医科大学医药实验动物中心自主研发建立并拥有自主知识产权的高度免疫缺陷模型鼠,通过CRISPR-Cas9技术直接在NOD小鼠上敲除Prkdc及IL2RG基因,是目前免疫缺陷程度最高、最适合人源细胞移植的工具小鼠。因为该小鼠背景单一、异种移植成活率高、比NOD-scid小鼠寿命更长的特点,所以它具有广泛的应用前景和研究等领域。
2019年8月,NYG小鼠在正常饲养过程中发生水样腹泻为主要特征的急性传染病,病死率为100%。在病后3~4 d出现死亡现象,初期死亡率低,为0.6%,14 d后开始出现大面积发病并死亡,发病率高达42.3%。笔者从送检小鼠体内分离出一株致病菌,通过生化鉴定以及16S rDNA基因序列分析,鉴定为奇异变形杆菌。通过药敏试验,发现该菌对喹诺酮类药物敏感。 由于该菌在DHL平板上生长形态和部分生化指标与沙门氏菌相同[12],常常会被误判为沙门氏菌,给动物生产和使用单位带来不应有的损失。尽管国家标准(GB 14922—2001)并未将其列为SPF级实验小鼠的必检项目,但仍需指出的是该菌为条件致病菌,一旦携带者受不良条件的影响或外来因素的刺激,可能引发传染病,造成严重后果[13]。另外,该菌对人畜均易感,迅速准确的诊断、检测和治疗对于控制该病的流行显得尤为重要。
1 材料与方法
1.1 材料
1.1.1 动物来源。16周龄ICR哨兵小鼠2只、8周龄NYG发病小鼠2只,均来自南京医科大学江苏省医药实验动物中心。
1.1.2 试剂。血平板、革兰氏染色试剂盒均购自上海科玛嘉微生物技术有限公司;胆硫乳琼脂培养基(DHL)、卵黄甘露醇高盐琼脂(SP)培养基、生化鉴定试剂均购自北京陆桥生物试剂有限公司;ID 32E购自法国梅里埃公司;香柏油(国药);生理盐水(自配);饱和食盐水(自配);ELISA检测试剂盒购于X-Press Bio;DNA提取试剂盒、dNTP、rTaq DNA聚合酶、MgCl2、10×Buffer、DNA DL2000 Marker等购自Tiangen公司。
1.1.3 试验耗材与仪器。试验耗材有手术器械、棉签、载玻片等;试验仪器有光学显微镜(Olympus)、移液器(Thermo)、ATB细菌鉴定仪(梅里埃)、生化培养箱(SPX-150BS)、PCR仪(Eppendorf)、凝胶成像系统(BIO-RAD)、电泳仪(北京六一)等。
1.1.4 细菌标准菌株。沙门氏菌(Salmonella spp.)和金黄色葡萄球菌(Staphylococcus aureus)购自中国药品生物制品检定所;木糖葡萄球菌(Staphylococcus xylose)为南京医科大学医药实验动物中心提供。
1.1.5 诊断血清。沙门氏菌诊断血清购于宁波天润生物药业有限公司。
1.2 方法
1.2.1 动物处理。采集哨兵小鼠血清,用于抗体检测;哨兵鼠与NYG小鼠处死,无菌操作,取肠内容物,在血平皿、DHL平皿、SP平皿上划线培养,用于细菌检测;肠道内容物镜下观察,用于寄生虫检测。
1.2.2 细菌检测。
1.2.2.1 细菌培养。将DHL平皿、血平皿、SP培养皿置于37 ℃生化培养箱内培养16~24 h,挑取疑似病原菌菌落用于分纯传代培养。
1.2.2.2 形态鉴定。对培养16~18 h的菌株进行菌落形态观察。
1.2.2.3 革兰氏染色。无菌挑取菌落,均匀涂抹于双蒸水中,采用革兰氏染色方法进行鉴定。
1.2.2.4 生化鉴定。对疑似病原菌进行手工生化与ATB细菌鉴定仪交叉鉴定。
1.2.2.5 血清凝集试验。采用玻片法,用接种环挑取沙門氏菌(购自中国药品生物制品检定所的标准菌株)及疑似病原菌,分别与沙门氏菌诊断血清及生理盐水混匀,上下摇动玻片数次,1~3 min后观察结果。
1.2.2.6 PCR检测与16S rDNA测序。采用细菌基因组DNA试剂盒提取细菌DNA,使用通用引物进行PCR扩增,对PCR产物进行测序鉴定。
(1)总DNA模板的提取。从平板上挑取少许单菌落,移入5 mL LB液体培养基中,37 ℃扩大培养16~18 h。从试管中吸取1 mL菌液,离心收集菌体,使用DNA抽提试剂盒抽提细菌的基因组DNA。
(2)PCR扩增。使用通用引物[10]对16S rDNA进行PCR扩增,扩增产物送交南京金斯瑞生物科技有限公司测序。测序结果在GenBank数据库中进行Blast比对,使用MEGA软件对相近序列进行同源性分析,并构建系统发育树。
1.2.2.7 药敏试验。制备0.5麦氏菌悬液,均匀涂布于MH培养基上,5 min后将药敏片均匀贴服于培养基上,每皿5个药敏片,15 min后将贴服于药敏片的培养基放入37 ℃培养箱内培养24 h,观察结果。
1.2.2.8 迁徙行为的检测。制备0.5麦氏菌悬液,将NJDWZY1.1点种在血平皿,琼脂浓度分别为0.5%、1.0%、1.5%、2.0%、2.5%的LB平板上,37 ℃培养20 h,每小时观察并记录其迁徙距离。
1.2.2.9 动物用药试验。根据药敏试验结果与文献报道,选用50 μg/mL环丙沙星对发病房间内动物进行区域性给药,用药7 d后发病率与死亡率明显降低,发病率由用药前的42.3%下降到9.6%,病死率未见异常,均为100%,持续给药14 d后发病率下降到0。
1.2.3 抗体检测。由于NYG小鼠为高度免疫缺陷小鼠,只能通过对哨兵鼠血清进行抗体检测,从而间接的达到NYG小鼠检测的目的。
1.2.4 寄生虫检测。将肠内容物溶于生理盐水与饱和食盐水中,显微镜下观察蠕虫、线虫、鞭毛虫、纤毛虫等寄生虫体。
2 结果与分析
2.1 细菌检测
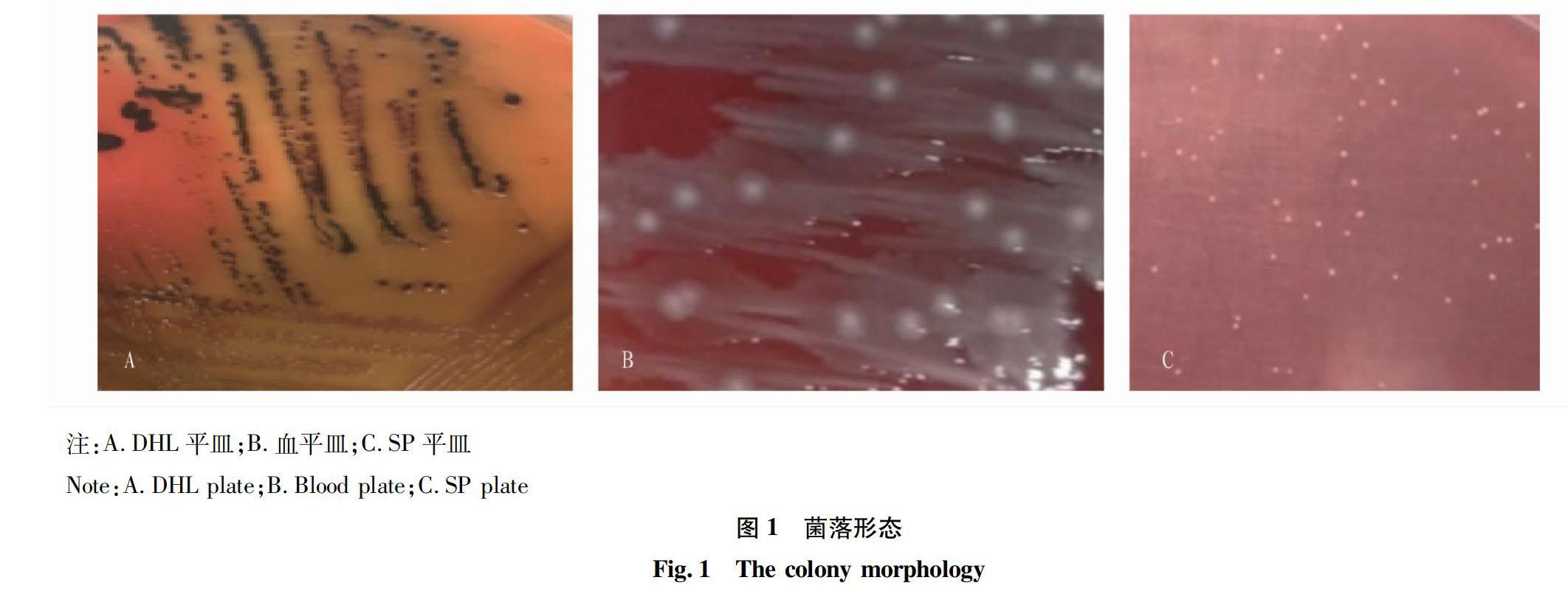
2.1.1 菌落形态。37 ℃ DHL平皿培养16~18 h后,可见中间黑心、四周扁平、无色透明的菌落,分纯培养,命名为NJDWZY1.1,如图1A所示。血平皿上生长良好,约0.5 cm大小菌落,表面光滑湿润、不溶血、半透明、有黏性的菌落,可见迁徙生长现象,分纯培养,命名为NJDWZY1.2,如图1B所示。SP 平皿上生长良好,约0.1 cm大小菌落,表面光滑,呈现淡黄色小菌落,分纯培养,命名为NJDWZY1.3,如图1C所示。
2.1.2 革兰氏染色。对分离菌株进行革兰氏染色,NJDWZY1.1与NJDWZY1.2结果均为阴性短杆菌,见图2A、B;NJDWZY1.3结果为阳性球菌,见图2C。
2.1.3 手工生化鉴定。由于DHL平皿上菌落有黑心,触酶试验为阳性,革兰氏染色为阴性短杆菌,疑似沙门氏菌,对其进行手工鉴定,鉴定结果见表1。结果表明,排除掉沙门氏菌的可能,需要对该菌进一步生化与PCR鉴定。SP平皿上菌落呈淡黄色,革兰氏染色为阳性球菌,疑似金黄色葡萄球菌,对其进行手工生化鉴定,结果见表2~3。结果表明,排除金黄色葡萄球菌的可能,对其进行进一步生化鉴定。
2.1.4 血清凝集试验。以沙门氏菌为阳性对照,对疑似沙门分离菌的NJDWZY1.1进行补充鉴定,结果见表4。
2.1.5 ATB细菌鉴定仪生化反应。根据仪器使用要求,对NJDWZY1.1、NJDWZY1.2与NJDWZY1.3制备菌悬液进行生化反应,其中NJDWZY1.1与NJDWZY1.2结果相同,为奇异变形杆菌,T值为1.0,见表5。NJDWZY1.3鉴定结果为不可接受的鉴定,对其进行PCR鉴定。
2.1.6 PCR扩增与16S rDNA测序。
2.1.6.1 PCR扩增。采用PCR方法对分离菌进行扩增。PCR产物在1%琼脂糖凝胶电泳分析结果表明,阳性对照与分离菌均扩增到目的条带,空白对照未见条带,不存在非特异性条带。与Marker相比,PCR扩增产物片段大小约1 450 bp(图3),与预期结果相一致。
2.1.6.2
16S rDNA测序。将分离菌的PCR产物送检测序,结果在 NCBI GenBank 数据库中进行 BLAST 比对分析,发现NJDWZY1.1与NJDWZY1.2分离菌与其同源性最高的序列均为奇异变形杆菌,同源性均在 99%以上,确定该2株分离菌为同一菌株,为奇异变形杆菌,为此次分离的致病菌。NJDWZY1.3鉴定为腐生葡萄球菌,排除金黄色葡萄球菌的可能。
2.1.6.3 进化树分析。将分离的奇异变形菌株16S rDNA基因序列与从GenBank数据库中获得的变形杆菌属细菌及质检中常见细菌进行统计和聚类分析,结果见图4。从图4可以看出,分离菌株与奇异变形杆菌的同源性在99%以上。
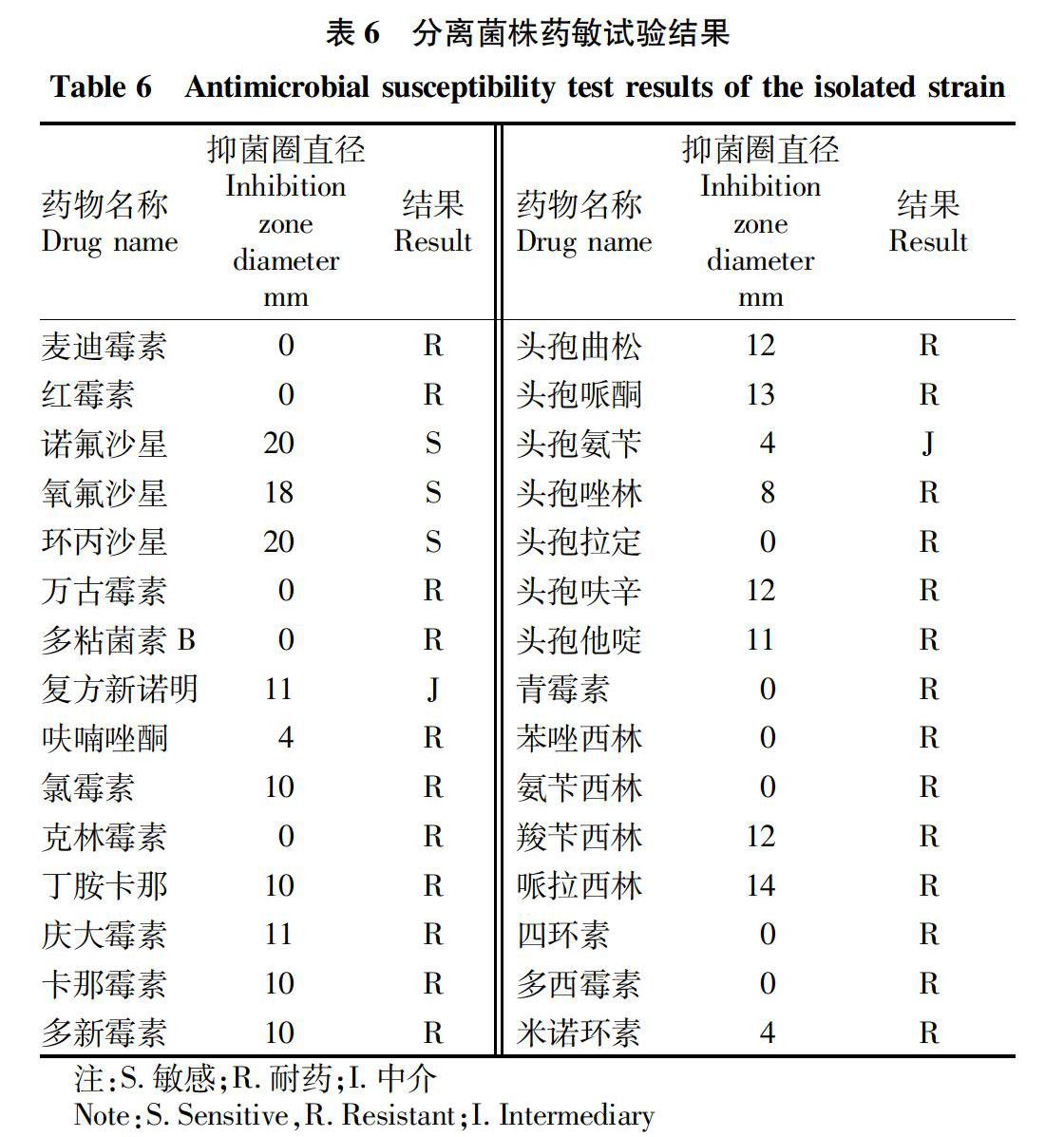
2.1.7 药敏试验结果。根据CLSI(2018年)颁布抗菌药物体外药敏试验判定标准,利用不同种类的抗生素检测该分离株的药敏特性,敏感度根据抑菌圈直径的大小来判断。结果显示,在测定的30种常用药物中,该菌株对诺氟沙星、氧氟沙星、环丙沙星等喹诺酮类药物敏感,抑菌圈直径为18~20 mm;该菌株对复方新诺明与头孢氨苄中度敏感,而对大环内酯类、多肽类、β-内酰胺类、四环素类等多种药物不敏感(表6)。
2.1.8 迁徙行为结果分析。NJDWZY1.1在血平皿,琼脂浓度分别为2.0%、2.5%的 LB平板上呈现周期性向四周迁徙运动,形成多圈同心圆环,在1.5%LB上呈现弥漫性生长,在0.5%、1.0%的LB平板上未见迁徙现象,结果见图5。
2.1.9 动物用药试验。对房间内93笼小鼠用药,持续给药7 d后,小鼠状态得到明显改善,死亡数量较用药前明显减少;经观察发现有9笼小鼠发病并死亡,持续给药超过7 d未见小鼠死亡(表7)。
2.2 抗体检测 采用ELISA方法对哨兵鼠的泰泽病原体、鼠肝炎病毒、轮状病毒、呼肠孤病毒、小鼠腺病毒进行检测,结果见表8。
2.3 寄生虫检测
将肠道内容物溶于生理盐水中,用于检测鞭毛虫、阿米巴变形虫与纤毛虫;将肠道内容物溶于饱和食盐水中,用于检测线虫,结果见表9。
3 讨论
该试验中在DHL平板上分离的菌落特点与沙门氏菌相似,故在此次检测中最初误判为沙门氏菌,但通过沙门氏菌手工生化鉴定,排除了沙门氏菌的可能。经过进一步的生化鉴定,初步判定为奇异变形杆菌。在SP平板上分离菌落与金黄色葡萄球菌相似,经过生化鉴定与PCR鉴定判定为腐生葡萄球菌,排除了金黄色葡萄球菌的可能。由于NYG小鼠在常规监测中检出了腐生葡萄球菌,所以认为腐生葡萄球菌不是此次发病的致病菌。
通过对细菌中16S rDNA序列分析比较来对细菌进行鉴定已经是国际上通用的鉴定技术[14],一般认为同源性为99%~100%,判定为同一个种,97%~99%的同源性即判定为同一个属,根据此标准,对此次致病菌的16S rDNA进行测序并比对结果表明,该菌与奇异变形杆菌的同源性高达100%,故该分离菌株可鉴定为奇异变形杆菌。
在現代临床医学检验中,检验工作的仪器化、电脑化、智能化、快速化是其中的一个发展方向,微生物检验也不例外。该试验中使用的ATB细菌鉴定仪是一台在微量生化反应环节实现电脑自动化的仪器,由于在制备菌悬液浓度、加样等操作过程中存在人为原因与系统误差,会出现ATB鉴定结果与手工结果不符现象[15-16],所以通过PCR方法对该菌进一步诊断,确定为奇异变形杆菌。此次检测中ATB鉴定结果与PCR鉴定结果相一致,最终该菌鉴定为奇异变形杆菌。ATB细菌鉴定仪试剂在样品的制备与加样过程中,在颜色比对过程中存在人为因素造成的误差,而PCR方法具有反应快速、灵敏度高、成本低、假阳性等特点,所以需要生化与PCR交叉鉴定来最终确诊。
抗生素自发现以来,拯救了无数生命,但随着抗生素越来越多被不合理使用,它们正在迅速失去效力,而此种现象被人们称为耐药性。现今耐药菌株出现的速度远远超过了抗生素的研发速度[17],近年来,由于广谱抗菌药物的广泛大量使用,奇异变形杆菌的耐药性日益严重,不断诱导出新的耐药菌株。此次药敏试验发现在常用的30种抗生素中,有11种抗生素完全耐药、药敏直径为0 mm,14种抗生素不完全耐药,2种抗生素中度敏感,3种抗生素高度敏感。在11种完全耐药的抗生素中,涉及大环内酯类抗生素2种,100%耐药;多肽类抗菌素2种,100%耐药;林可胺类抗菌素1种,100%耐药;头孢菌素类抗菌素1种,12.8%耐药;β-内酰胺类抗菌素2种,60%耐药;四环素类抗菌素2种,75%耐药。该分离菌株的药敏试验结果与已有报道[18-20]的药敏试验结果相差较大,这提示该地区这几种抗生素已不适用于治疗由奇异变形杆菌引起的各种感染,而喹诺酮类药物敏感率为100%,可作为该地区的临床经验用药和临床首选用药。南京医科大学医药实验动物中心在选用喹诺酮类药物治疗后,小鼠的发病率呈现明显的下降趋势。用药14 d后,已无死亡现象,笼盒内可见成型粪便,死亡率由用药前的42.3%下降到0,已有效控制了该疾病的发展。该病在发病初期零星发生,持续14 d后开始大量暴发,从0.4笼/d死亡剧增到13笼/d,给药2 d后死亡率出现明显下降,达到9笼/d,可见通过饮水饲喂的药物已发挥作用。持续给药7 d后死亡率持续下降,达到0.3笼/d,持续给药14 d后未见发病动物。持续给药21 d后停药,停药7 d又出现复发现象,出现1笼死亡,又继续给药,未见发病。该病从发病到暴发需要14 d的潜伏期,在潜伏期给予药物治疗可以很好地控制该病的发展。持续给药21 d后有复发现象,说明环丙沙星仅能抑制该菌,但不能有效杀灭或只有持续给药才能杀灭该菌,这需要在后续延长给药的治疗中证实。该试验中发病动物多为生产后的雌性小鼠,可能为妊娠和生产压力对小鼠肠道屏障产生损害,从而受到奇异变形杆菌的入侵和感染[21]。
奇异变形杆菌的迁徙行为有2种形态,即VC型与CGC型。其中,VC型细菌产生大量酸性物质,阻碍细菌生长,而CGC型菌体鞭毛变长变密,由于趋化作用,细菌向外部扩散生长。因此,奇异变形杆菌是处于这2种状态变化中生长[22-23]。NJDWZY1.1的迁徙距离随着培养试剂的延长而增加,其中血平皿最先达到阈值,然后依次为琼脂浓度2.0%、2.5%、1.5%的LB平皿,在4、7~8、10与12 h迁徙速度最快,有4个峰值,在这几个时间段应该处于CGC型状态,其余时间段处于VC型状态。在琼脂浓度0.5%与1.0%的LB平皿上未见明显的迁徙现象,其原因可能是0.5%与1.0%的LB平板表面水分含量高,有助于酸性代谢产物的扩散,导致未见迁徙现象。该试验中的迁徙行为与文献报道[24]差别较大,可能是由于不同菌属造成的。奇异变形杆菌通过迁徙行为有效提高了其抵抗力和致病力,而此次分离的奇异变形杆菌对NYG小鼠具有较强的致病性。
引起小鼠腹泻的原因多种多样,主要分为饲养环境的改变与病原体的感染。由于试验用小鼠饲养在屏障环境中,所以季节的变化已不是造成该小鼠腹泻的主要因素,着重检测了引起小鼠腹泻的病原体,主要分为病毒、细菌与寄生虫。轮状病毒感染通常表现在幼崽腹泻,成年小鼠一般不会发生,而油毛效应是呼肠孤病毒感染的典型特征,根据以上特征可初步排除,而泰泽病原体[25]一般为阴性感染,且持续时间较长,但为预防漏检,该试验依然对其抗体进行了检测,结果发现血清中抗体均为阴性。对寄生虫的检测应着重考虑鞭毛虫、纤毛虫、阿米巴变形虫与线虫发现分别检测了2只发病NYG小鼠与未见症状的哨兵鼠,通过镜检均未发现目标虫体。在病毒与寄生虫均排除的情况下,着重考虑细菌感染的因素。在此次检测中,由于哨兵鼠一直未表现出腹泻症状,因此仅对NYG发病鼠采样,最终检测到引起此次发病的致病菌为奇异变形杆菌。对于NYG小鼠,因为其高度免疫缺陷性,有其特殊性,极易引起各种病原体与条件性病原体的感染,因此在饲养管理等方面应该更加严格。
参考文献
[1] 陈淑惠.奇异变形杆菌致败血症1例[J].检验医学与临床,2011,8(6):763,768.
[2] ZUNINO P,SOSA V,ALLEN A G,et al.Proteus mirabilis fimbriae(PMF)are important for both bladder and kidney colonization in mice[J].Microbiology,2003,149(Pt11):3231-3237.
[3] 马婷婷,韦显凯,闭璟珊,等.猪源奇异变形杆菌的分离鉴定及其毒力的测定[J].中国兽医科学,2017,47(10):1234-1239.
[4] 段二珍,夏平安,张凤华,等.狐狸奇异变形杆菌的分离与鉴定[J].中国兽医科学,2008,38(12):1050-1054.
[5] 孙化露,卢艳,邹晓艳,等.3株鸽源奇异变形杆菌的分离与鉴定[J].畜牧与兽医,2012,44(1):68-70.
[6] 王建科,程悦宁,易立,等.水貂奇异变形杆菌的分离鉴定及16S rRNA 基因序列分析[J].中国畜牧兽医,2015,42(4):852-858.
[7] 史同瑞,李丹,刘宇,等.貂奇异变形杆菌的分离及其生物学鉴定[J].中国预防兽医学报,2013,35(10):817-820.
[8] 王承东,李德生,汤纯香,等.大熊猫生殖道感染奇异变形杆菌一例[J].四川动物,2007,26(1):167.
[9] 张庆华,熊清明,肖琳琳,等.大黄鱼溃烂症的一种致病菌——奇异变形杆菌ZXS02菌株[J].水产学报,2005,29(6):824-830.
[10] 罗兆飞,张为宇,杨得胜.动物性食品中奇异变形杆菌PCR检测方法的研究[J].福建畜牧兽医,2008,30(1):1-3.
[11] 朱明华,朱瑞良,馬荣德,等.鸡奇异变形杆菌的分离鉴定和16S rRNA基因序列测定与系统进化分析[J].中国兽医学报,2011,31(6):804-808.
[12] 王锦彤,钟广辉,熊定凯,等.珠江水中检出与沙门氏菌具有共同抗原的奇异变形杆菌[J].口岸卫生控制,2008,13(2):23-24.
[13] 王丹阳,王旭荣,张康,等.牛病毒性腹泻病毒、大肠杆菌和奇异变形杆菌混合感染致犊牛腹泻的研究[J].中国畜牧兽医,2018,45(1):189-195.
[14] 马迪根 M T,马丁克 J M.微生物生物学[M].李明春,杨文博,译.8版.北京:科学出版社,2001:765-773.
[15] 毛凌哲,王小琼,马远东,等.3 种细菌鉴定方法鉴定结果的比较和分析[J].检验医学,2016,31(1):49-51.
[16] 邵小华.ATB 细菌鉴定仪与手工法鉴定结果比较分析[J].安徽医学,2009,30(4):472-473.
[17] 乔虹.临床因素与抗生素耐药的相关性[J].国外医学(药学分册),2006,33(1):18-20.
[18] 刘娜,史瑞雅,闫金坤,等.鸡源奇异变形杆菌的分离鉴定及药物敏感性分析[J].中国家禽,2016,38(24):48-51.
[19] 皇甫和平,许文博,石冬梅.奶牛蜂窝织炎奇异变形杆菌的分离鉴定及药敏试验[J].中国兽医杂志,2016,52(10):32-34.
[20] 徐传和,朱洪权,郑连荣,等.奇异变形杆菌培养及其药敏结果分析[J].中国实验诊断学,2008,12(12):1566-1568.
[21] 陈力川.免疫缺陷小鼠的死亡问题探究及抗生素准确用药策略研究[D].南京:南京中医药大学,2018.
[22] PRβ B M,CAMPBELL J W,VAN DYK T K,et al.FlhD/FlhC is a regulator of anaerobic respiration and the entner doudoroff pathway through induction of the methyl accepting chemotaxis protein Aer[J].J Bacteriol,2003,185(2):534-543.
[23] 赵振鹏,杨振,林伟东,等.猪源奇异变形杆菌的分离鉴定及集群运动分析[J].中国畜牧兽医,2014,41(10):219-224.
[24] 周建波,胡丽萍,马宁宁,等.致羔羊腹泻奇异变形杆菌的分离鉴定及迁徙行为分析[J].中国兽医学报,2017,37(7):1274-1282.
[25] 陈园生,李红.泰泽病原体研究现状[J].中国比较医学杂志,2004,14(1):45-49.
