大孔树脂纯化白背天葵多酚及其体外抗氧化研究
2021-08-06马景蕃谢晓倩杨昊坤刘喜明陈雪梅
马景蕃 谢晓倩 杨昊坤 刘喜明 陈雪梅
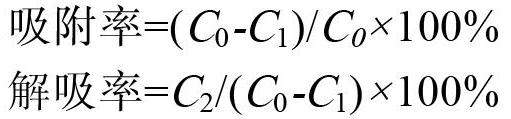
摘 要:为了分离纯化白背天葵多酚,并探讨其体外抗氧化活性,本研究比较了8种大孔树脂对白背天葵多酚的静态吸附和解吸能力,优选出D101为最适宜纯化白背天葵多酚的树脂,并对其分离纯化的工艺进行了优化。采用DPPH和ABTS法评价其抗氧化活性。结果表明,D101树脂最佳纯化工艺为上样液浓度1 mg/mL、pH 3.1、上样液流速2 mL/min,解吸的乙醇体积分数70%、体积60 mL、流速2 mL/min;白背天葵多酚的含量由14.73%提高到45.21%;其清除DPPH及ABTS自由基的能力为 Vc>纯化物>粗提物。研究结果为进一步开发利用白背天葵多酚提供了数据支持。
关键词:白背天葵;多酚;纯化;DPPH;ABTS
Abstract: Eight macroporous resins were compared to separate and purify Gynura formosana Kitam polyphenols and its antioxidant activity in vitro was determined. The optimal purify technology was optimized through static absorption and desorption experiments. Furthermore, the antioxidant activity of the polyphenols from G. formosana Kitam was analyzed by DPPH and ABTS methods. The results showed that D101 was the most optimal resin. The optimal purification process parameters were as follows: the concentration of polyphenols 1 mg/mL with pH 3.1, the loading flow rate 2 mL/min. The eluting solvent was 70% alcohol, the volume and flow rate was 60 mL and 2 mL/min respectively. Under the condition, the concentration of polyphenols increased from 14.73% to 45.21%. The DPPH and ABTS radicals scavenging activity was as follows: Vc>purified polyphenols>crude polyphenols. The result would provide a basis for the further utilization of polyphenols from G. formosana Kitam.
Keywords: Gynura formosana Kitam; polyphenols; purification; DPPH; ABTS
白背天葵(Gynura formosana Kitam)又名白背三七、白凤菜,是菊科(Compositae)菊三七属(Gynura)多年生草本植物[1]。在福建、海南、广东等地多有分布。它是一种保健药膳和珍稀蔬菜,有“最佳保健药膳蔬菜”之称[2]。白背天葵营养丰富,味道鲜美,且根、茎、叶均可入药,主入肝、肺、肾、大小肠诸经,具有抗炎[3]、解热、抗氧化、利尿、抗癌等作用,主治肝炎、肝硬化、肺癌、高血压、发烧及防治心脑血管等疾病[4]。目前白背天葵在利用上主要作为一种理想的无公害特色蔬菜鲜食,尚未见对其天然有效成分开发利用的研究报道。
植物中的多酚类化合物具有多种生物活性,如具有抗氧化、降血脂、增强身体抵抗力以及防止动脉硬化、血栓形成等作用,还具有抑制细菌与癌细胞生长等功效,因此近年来很多学者对多酚类化合物的研究引起了广泛的兴趣。前期我们应用超临界CO2萃取法提取白背天葵粗多酚,提取得率为5.32%,但该法提取获得的粗多酚含有较多杂质,影响多酚纯度及后续抗氧化效果的研究,因此有必要对白背天葵粗多酚进行纯化。大孔树脂纯化法是依靠大孔树脂和被吸附的分子(吸附质)之间的范德华引力,通过其巨大的比表面进行物理吸附,再通过合适的溶剂洗脱,从而达到目标物质分离、纯化的目的,近些年来,大孔树脂纯化法在天然多酚等功能性活性成分的分离纯化中得到广泛应用。白背天葵资源丰富,且含有丰富的多酚类物质,将白背天葵多酚类物质作为功能性活性物质进行开发利用对于其高值化产业链延伸具有重要意义。目前,利用大孔树脂纯化白背天葵多酚及其活性的研究尚未见报道,因此本文通过比较8种不同型号大孔吸附树脂的吸附和解吸能力,筛选出最适宜纯化白背天葵多酚的大孔树脂,并确定吸附与解吸的最佳纯化工艺参数。以Vc为阳性对照,比较纯化前后白背天葵多酚的体外抗氧化活性,旨在为进一步开发利用白背天葵多酚提供依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 白背天葵种植于龙岩学院植物房内。没食子酸标准品(≥98%)、1,1-二苯基-2-三硝基本肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)、2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate), ABTS]、Vc对照品(≥98%)购自美国Fluka公司;大孔树脂D-101、HPD-300、HP-750、ADS-17、AB-8、DM130、NKA-9、XDA-9购自天津鸿博美化工科技有限公司,其他试剂均为国产分析纯。
1.1.2 仪器与设备 UV-1800紫外可见分光光度计,日本Shimadzu公司;Bio-TekELX800酶标仪,美国宝特公司;Re-52A旋转蒸发器,上海亚荣生化仪器厂。
1.2 方法
1.2.1 白背天葵多酚粗提物的制备 在前期工作的基础上,采用超临界CO2萃取法提取白背天葵多酚。取白背天葵茎叶部分于60 ℃烘干、粉碎后,在萃取压力为35 MPa,时间为2 h,温度为40 ℃、CO2流量20 L/h的条件下进行超临界CO2提取多酚,经真空冷冻干燥机干燥24 h,得到多酚粗提物备用。
1.2.2 白背天葵多酚含量的测定 参照文献[5-7]的方法,以没食子酸为标准品,在765 nm波长下,以吸光度(A)为纵坐标,没食子酸质量浓度(C)为横坐标绘制标准曲线,得回归方程为A=0.3527C+0.0316, R2=0.9985,对照没食子酸标准曲线计算样品中多酚的含量。
1.2.3 大孔树脂预处理 将大孔树脂D-101、HPD-300、HP-750、ADS-17、AB-8、DM130、NKA-9、XDA-9用95%乙醇浸泡24 h后,用蒸馏水洗涤至无醇味。用5% HCl溶液浸泡12 h,蒸馏水洗至中性,再用5% NaOH溶液浸泡12 h,蒸馏水洗至中性,将树脂滤干备用。
1.2.4 大孔树脂的静态吸附与解吸性能 分别称取上述8种型号的大孔树脂各1 g,放入100 mL三角瓶中,加入30 mL浓度为1.058 mg/mL的白背天葵多酚溶液,置于25 ℃恒温摇床中,100 r/min振荡12 h,将吸附饱和的大孔树脂用150 mL蒸馏水洗涤,抽滤后,用30 mL 75%的乙醇解吸附12 h。按下式计算各树脂的吸附率与吸附率:
式中,C0为吸附前多酚的质量浓度(mg/mL);C1为吸附后多酚的质量浓度(mg/mL);C2为解吸后多酚的质量浓度(mg/mL)。
1.2.5 大孔树脂的静态吸附动力学曲线 选取上述树脂中吸附和解吸效果最好的3种树脂,按上述操作,进行恒温振荡吸附,分别于0.5、1、2、4、8、16 h吸取上清液,在波长765 nm处测定吸光度值,计算吸附率并绘制大孔树脂的静态吸附曲线。
1.2.6 多酚树脂吸附单因素试验 采用湿法装柱,选取16 mm×20 cm(柱体积约为20 mL)的玻璃层析柱,分别对上样液质量浓度、上样量、上样液pH、上样液流速进行单因素试验,确定各因素的最佳选择范围。
1.2.7 响应面优化 在单因素试验的基础上,采用Design Expert 8.0.6软件设计响应面优化试验,选择上样液质量浓度(X1)、上样液pH(X2)、上样液流速(X3)3个因素作为自变量,以多酚吸附率为响应值,设计三因素三水平的响应面试验。
1.2.8 体外抗氧化活性测定 白背天葵多酚清除DPPH及ABTS自由基的测定分别参照文献[8]及文献[9]的方法,以抗坏血酸为对照。
1.3 数据处理
每项试验至少重复3次,试验结果以平均数±标准差()表示。单因素方差分析及自由基清除率IC50计算使用SPSS 22.0统计软件包。采用Design Expert 8.0.6软件进行数据分析,Origin 8.0软件制图。
2 结果与分析
2.1 树脂的筛选
2.1.1 大孔树脂的静态吸附与解吸 为了选择合适的白背天葵多酚纯化树脂,本文结合文献[10-11]纯化多酚的基础上分别选择了2种极性树脂、1种中极性树脂、2种弱极性树脂和3种非极性树脂。由表1可知,吸附效果较好的3种树脂分别为AB-8、DM130、D-101,其中DM130的吸附率最高为(87.42±0.58)%;解吸效果较好的4种树脂分别是XDA-9、AB-8、DM130和D-101,其中AB-8的解吸率最高为(86.34±0.81)%。综合考虑吸附率和解吸率这2个指标,我们选择AB-8、DM130和D-101这3种树脂做静态吸附动力学曲线来进一步筛选。
2.1.2 大孔树脂静态吸附动力学曲线 由图1可见,3种树脂对白背天葵多酚的吸附均为快速平衡型。DM130和AB-8树脂在2 h达到吸附平衡,D-101树脂在4 h达到吸附平衡,平衡后3种树脂的吸附动力学曲线均随着时间的延长逐渐趋于平缓。DM130树脂对白背天葵多酚的最大吸附率大于AB-8和D-101树脂的最大吸附率。从节约时间和吸附效果考虑,DM130树脂更适合富集纯化白背天葵多酚类化合物,因此,后续试验采用DM130树脂作为纯化树脂。
2.2 大孔树脂吸附单因素试验结果
2.2.1 上样液体积的确定 设定上样液浓度1 mg/mL、pH 5.0、流速为1.0 mL/min,分段收集流出液,每10 mL收集1管,测定白背天葵多酚浓度,并绘制动态吸附渗透曲线。如图2所示,开始阶段,多酚浓度很低,说明多酚几乎被大孔树脂全部吸附,无渗透;但当流出液体积大于70 mL时,大孔树脂吸附有泄漏,说明多酚吸附量已基本达到饱和;当流出液体积为130 mL时,流出液多酚浓度约是上样液浓度的10%时,此时已达到树脂的渗透点,故选择上样液体积为130 mL。
2.2.2 上样液质量浓度对白背天葵多酚吸附的影响 设定上样液pH 5、流速为1.0 mL/min、体积为150 mL,考查当上样液质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.0 mg/mL時DM130树脂对白背天葵多酚吸附率的影响。由图3可知,随着上样液质量浓度的提高,吸附率呈现先升高后下降的趋势。浓度低时吸附率低,可能是由于树脂的表面与多酚分子的接触面积小,树脂未达到饱和吸附;而当浓度增加到一定值后吸附率下降,可能是由于多酚分子含有的羰基和羟基通过氢键而聚合成大分子,不容易被树脂吸附基团所吸附[12]。本研究选择上样液质量浓度范围为0.5~1.5 mg/mL。
2.2.3 上样液pH对白背天葵多酚吸附的影响 上样液质量浓度为1 mg/mL、流速为1.0 mL/min、体积为150 mL,考查当上样液pH分别为1、2、3、4、5、6 时DM130树脂对白背天葵多酚吸附率的影响。由图4可知,随着pH的增加,多酚吸附率先增加后下降,当pH为3时,吸附率达到最大。其原因可能是当溶液pH较小时,多酚类化合物的溶解度在酸性条件下降低,呈现分子形式,可通过范德华力被树脂吸附,但当pH过小时,因溶液酸性过强而导致多酚类化合物发生沉淀,所以吸附率不高;当pH过高时,多酚类化合物中的酚羟基容易失去H+,削弱了与溶液中水分子的相互作用力,从而不易被树脂吸附[13]。另外,当pH过高时,大孔树脂容易结块,不利于多酚的吸附。本研究选择上样液pH范围为2~4。
2.2.4 上样液流速对白背天葵多酚吸附的影响 设定上样液质量浓度为1 mg/mL、pH为5、体积为150 mL,考查当上样液流速分别为1、2、3、4、5、6 mL/min时DM130树脂对白背天葵多酚吸附率的影响。由图5可知,随着上样液流速的增加,多酚吸附率逐渐下降,其原因可能为流速较小时,白背天葵多酚类化合物可与树脂充分接触使得吸附率较高[14]。本研究选择上样液流速范围为1~3 mL/min。
2.3 响应面优化试验结果
2.3.1 试验设计与结果 通过三因素三水平的Box-Benhnken 中心组合试验设计,考察上样液质量浓度(A)、上样液pH(B)、上样液流速(C)对白背天葵多酚吸附率(R)的影响,试验设计及结果见表2。
对回归方程进行显著性检验分析,结果如表3所示,该模型极显著(P<0.0001),相关系数R2=0.9950, 校正决定系数R2adj=0.9886,其失拟项不显著(P= 0.1575>0.05),说明回归方程拟合度较好,模型试验误差小,可以用该方程对白背天葵多酚吸附率进行准确预测和分析。模型的A、A2、B2为极显著,B、AB、C2为显著。由F值可知,各单因素对白背天葵多酚吸附率影响的大小顺序为:A>B>C;交互项对吸附率影响的大小顺序为:AB>BC>AC。
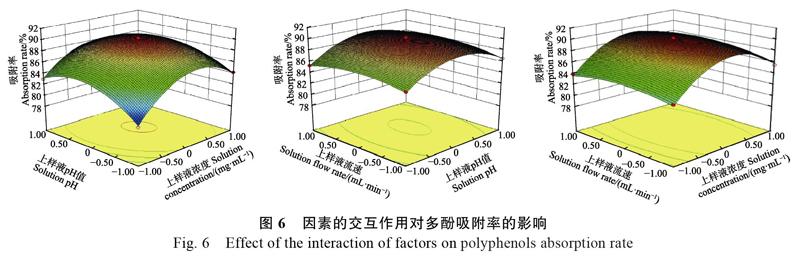
2.3.2 响应面分析 由图6可知,上样液浓度和上样液pH交互作用最为显著,上样液浓度和上样液流速、上样液pH和上样液流速作用均不显著,这与模型中F值分析结果相一致。
2.3.3 验证试验 通过响应面回归方程,得到大孔树脂吸附白背天葵多酚的最佳条件为上样液浓度为1.07 mg/mL,上样液pH为3.12、上样液流速2.06 mL/min,在此条件下模型预测白背天葵多酚吸附率为90.49%。为方便实际操作,修正后的条件为上样液浓度为1 mg/mL,上样液pH 3.1、上样液流速2 mL/min,此条件下多酚吸附率为90.38%,与理论值接近,RSD为0.37%。证明该回归模型是可靠的。
2.4 大孔树脂解吸单因素试验结果
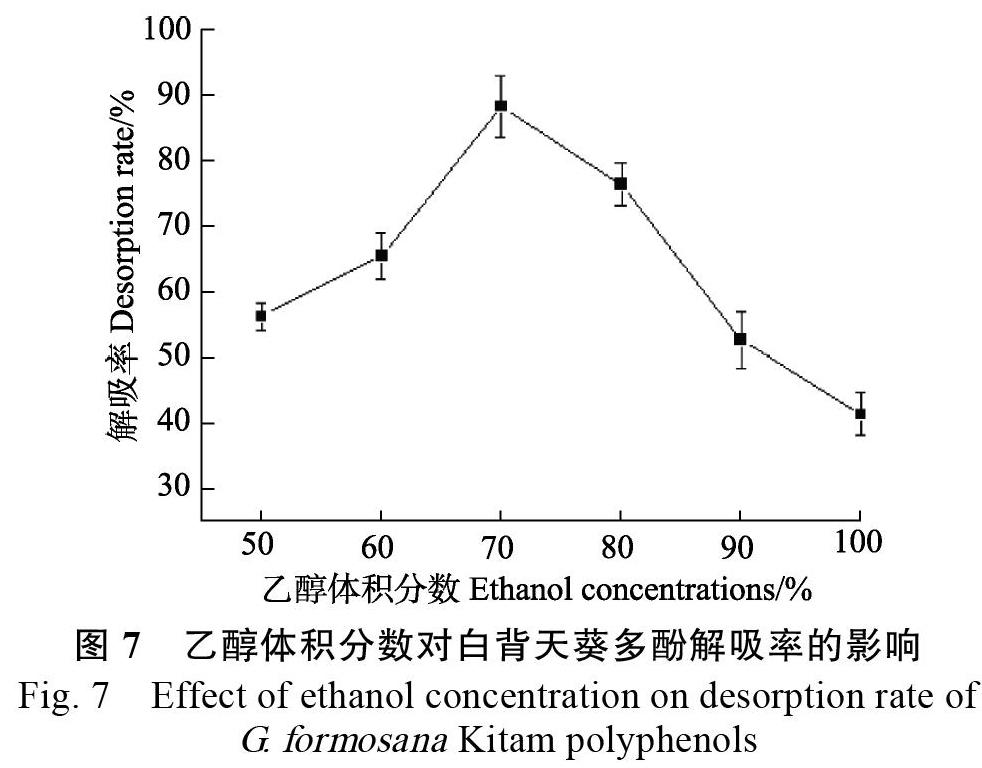
2.4.1 乙醇体积分数对白背天葵多酚解吸的影响 设定乙醇洗脱流速为1 mL/min,体积为60 mL,考查当乙醇体积分数分别为 50%、60%、70%、80%、90%、100%对白背天葵多酚解吸率的影响。由图7可以看出,随着乙醇体积分数的增加,解吸率先升高后下降,當体积分数为70%时,解吸率达到最大(88.21%)。因此选择乙醇体积分数为70%。
2.4.2 洗脱流速对白背天葵多酚解吸的影响 设定乙醇体积分数为70%,体积为60 mL,考查当流速分别为 1、2、3、4、5、6 mL/min对白背天葵多酚解吸率的影响。由图8可以看出,随着流速的增加,解吸率逐渐减小,但太低的流速不利于工业化生产,因此,选择乙醇洗脱流速为2 mL/min。
2.5 白背天葵多酚的纯化结果
按上述最佳工艺条件对白背天葵多酚粗提物进行上样、吸附和洗脱,测定多酚的含量,再经浓缩,真空冷冻干燥。纯化结果表明,白背天葵多酚粗提物中多酚的含量为14.73%,经DM101树脂纯化后多酚的含量为45.21%,约为纯化前的3.07倍。
2.6 白背天葵多酚体外抗抗氧化活性
2.6.1 DPPH方法测定白背天葵多酚的抗氧化能力 如图9显示,随着白背天葵多酚浓度的增加,DPPH自由基清除率呈现上升趋势,白背天葵多酚粗提物、纯化物及Vc清除DPPH自由基的IC50值分别为131.786、16.574、0.021 mg/mL,说明Vc的清除能力强于白背天葵多酚粗提物和纯化物,清除率大小顺序为Vc>纯化物>粗提物。当浓度达200 mg/mL时,白背天葵多酚粗提物和纯化物对DPPH自由基的清除率分别为72.19%和88.49%。
2.6.2 ABTS方法测定白背天葵多酚的抗氧化能力 对ABTS自由基的清除效果见图10,与清除DPPH自由基相似,其清除ABTS自由基的作用也随着浓度的增加而增加,白背天葵多酚粗提物、纯化物及Vc清除ABTS自由基的IC50值分别为74.375、27.456、0.015 mg/mL,当浓度达到200 mg/mL时,白背天葵多酚粗提物和纯化物对ABTS自由基的清除率分别为81.22%和92.36%。
3 讨论
大孔树脂是一种有机高聚物吸附剂,因其具有选择吸附性强、物理化学稳定性高、分离效果好等优点被广泛应用于中草药活性物质成分的分离纯化,韦琴等[15]利用AB-8型大孔树脂富集金鸡毛草叶总黄酮,纯化后的样液纯度提高了5.24倍;罗磊等[16]利用NKA-9大孔树脂对绿豆皮黄酮进行纯化,绿豆皮黄酮的纯度由28.26%上升到 75.74%;本研究使用DM101大孔树脂纯化白背天葵多酚,其纯度提高了3.07倍,可见使用大孔树脂纯化中草药活性物质效果明显。且该方法所用的设备简单、成本低、操作方便[17],适于白背天葵多酚的富集与纯化。
中草藥具有的独特疗效,可能与其高效清除体内自由基密切相关,植物多酚类物质现己被证明是一种天然的抗氧化活性剂,具有较强的清除自由基能力[18]。Sakihama等[19]研究表明,植物多酚能够清除有害的活性氧种类,如O2·–,H2O2,·OH等。本研究表明,白背天葵多酚具有显著的清除DPPH和ABTS自由基的能力,且纯化物的清除能力强于粗提物。植物多酚的抗氧化活性与其含量、结构、种类、分子量等有密切的关系,因此,今后还要对白背天葵多酚的抗氧化物质基础做进一步的研究。
本研究所用的白背天葵多酚纯化方法简单、快速,且纯化效果明显,白背天葵多酚具有显著的清除自由基作用,说明其具有较强的生物学活性,具备进一步开发成为保健产品的潜力,同时本研究也为进一步开发利用白背天葵多酚提供了一定的技术支持。
参考文献
林燕燕, 许新恒, 黄仲庆, 等. 白凤菜总黄酮对肝癌HepG2细胞生长、增殖和凋亡的影响[J]. 厦门大学学报(自然科学版), 2019, 58(1): 54-61.
Lin Y, Huang T, Lin Y, et al. First record of Phytophthora drechsleri on Gynura formosana[J]. Australasian Plant Disease Notes, 2019,14(16): 1-4.
马景蕃, 刘喜明, 陈晶晶, 等. 白背天葵不同提取部位抗炎活性及机制研究[J]. 安徽农业大学学报, 2018, 39(2): 90-93.
Ma J, Guo C, Pan Y, et al. Antioxidant and anti-inflammatory activities of ethyl acetate extract of Gynura formosana (Kitam) leaves[J]. Experimental & Therapeutic Medicine, 2017, 14(3): 2303-2309.
Conde T, Mussatto S I. Isolation of polyphenols from spent coffee grounds and silverskin by mild hydrothermal pretreatment[J]. Preparative Biochemistry, 2017, 46(4): 406-409.
Jovanovic A A, Dordevic V B, Zdunic G M, et al. Optimization of the extraction process of polyphenols from Thymus serpyllum L. herb using maceration, heat- and ultrasound-assisted techniques[J]. Separation and Purification Technology, 2017, 179: 369-380.
Sun H, Chen Y, Cheng M, et al. The modulatory effect of polyphenols from green tea, oolong tea and black tea on human intestinal microbiota in vitro[J]. Journal of Food Science and Technology, 2018, 55(1): 399-407.
Ullah F, Iqbal N, Ayaz M, et al. DPPH, ABTS free radical scavenging, antibacterial and phytochemical evaluation of crude methanolic extract and subsequent fractions of Chenopodium botrys aerial parts[J]. Pakistan Journal of Pharmaceutical Sciences, 2017, 30(3): 761-766.
Song J, Kim M J, Kim Y J, et al. Monitoring changes in acid value, total polar material, and antioxidant capacity of oils used for frying chicken[J]. Food Chemistry, 2017, 220: 306-312.
Silva E M, Pompeu D R, Larondelle Y, et al. Optimisation of the adsorption of polyphenols from Inga edulis leaves on macroporous resins using an experimental design methodology[J]. Separation & Purification Technology, 2007, 53(3): 274-280.
Zhang Q, Jia D Y, Yao K, et al. Purification of polyphenols from pomegranate peel by macroporous adsorbent resin[J]. Fine Chemicals, 2007, 24(4): 345-349.
Fu R, Wang Y, Yu F, et al. Optimization of the macroporous resin-based adsorption of apple polyphenol through response surface methodology[J]. Toxicological & Environmental Chemistry Reviews, 2016, 98(3-4): 479-491.
Zhuang M, Zhao M, Lin L, et al. Macroporous resin purification of peptides with umami taste from soy sauce[J]. Food Chemistry, 2016, 190: 338-344.
Guo Y, Wang J, Lu L, et al. Application of mid-infrared spectroscopy in analyzing different segmented production of Angelica by AB-8 macroporous resin[J]. Journal of Molecular Structure, 2016, 1103: 61-69.
韦 琴, 梅 辉, 江咏雪, 等. 金鸡毛草叶总黄酮大孔树脂的富集及抗氧化活性研究[J]. 食品研究与开发, 2019, 40(19): 88-94.
罗 磊, 姬青华, 马丽苹, 等. NKA-9大孔树脂对绿豆皮黄酮的纯化研究[J]. 中国食品学报, 2019, 19(6): 157-167.
Zou Y, Zhao, Mouming, Yang, Kun, et al. Enrichment of antioxidants in black garlic juice using macroporous resins and their protective effects on oxidation-damaged human erythrocytes[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2017, 1060: 443-450.
Pulido R, Bravo L, Saura-Calixto F. Antioxidant activity of dietary polyphenols as determined by a modified ferric reducing/antioxidant power assay[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3396-3402.
Sakihama Y, Cohen M F, Grace S C, et al. Plant phenolic antioxidant and prooxidant activities: phenolics-induced oxidative damage mediated by metals in plants[J]. Toxicology, 2002, 177(1): 67-80.
責任编辑:崔丽虹
