氯代乙酸水溶液中低电压电沉积类金刚石薄膜的研究
2021-08-06卫杰吴敏娴王历王文昌陈智栋
卫杰,吴敏娴,王历,王文昌,陈智栋
(常州大学石油化工学院,江苏常州213164)
类金刚石薄膜由于具有硬度高、摩擦系数低、耐磨性好、化学惰性和从红外到紫外较宽范围内的高透射比等一系列优点,可以广泛应用于机械、电子、化学、军事和航空航天等领域[1-3]。因此,类金刚石薄膜的研究在近20年中得到了广泛关注。
研究表明,以乙酸为碳源,在其水溶液中可在常温、低电压条件下电沉积得到类金刚石薄膜。以乙酸水溶液作为碳源,既没有危险气体放出,也符合当今绿色环保化学的要求,所以广受关注。Gupta[4]等电解乙酸体积比为1%和0.5%的乙酸水溶液,用氧化铟锡导电玻璃为基材,在2.1 V,85℃的条件下,得到厚度为0.5~1 μm的类金刚石薄膜;并得出:在不同的沉积电压下,薄膜的粗糙度不同。但是由于以乙酸为碳源得到的薄膜表面普遍比较疏松,颗粒粒径大,又由于乙酸为弱电解质,使得后续的沉积过程中有效碳源的浓度降低,导致薄膜不能持续生长。有研究者尝试使用卤代羧酸作为碳源电沉积类金刚石薄膜,如张倩[5]等在常温,低电压(3 V)条件下,在氯乙酸水溶液中,在FTO导电玻璃上成功的得到了类金刚石薄膜,并且薄膜比较致密,颗粒粒径较小,所以可能以氯取代乙酸作为碳源能够改善薄膜的表面形貌以及结构。
根据之前的研究,包含有活性甲基(分子中甲基直接有极性基团键合)的有机物适合做电化学沉积类金刚石薄膜的碳源,因为在反应过程中甲基容易断键,生成活性中间体,进而能够形成类金刚石薄膜。乙酸作为有活性甲基基团的有机酸,适合作为沉积类金刚石薄膜的碳,又因为卤族元素的电负性大于氢原子,当碳源中甲基一侧含有卤族元素时,甲基一侧更容易和羧基断裂,从而更容易生成类金刚石薄膜,所以卤代乙酸更适合作为电化学沉积类金刚石薄膜的碳源。因此本文以不同数量氯原子取代的羧酸:乙酸、氯乙酸、二氯乙酸、三氯乙酸为碳源,在这四种氯代乙酸的水溶液中电化学沉积类金刚石薄膜,考察了不同数量氯原子取代乙酸体系中氯原子的取代数量对类金刚石薄膜的厚度、形貌、结构以及电导率的影响。
1 实验部分
1.1 碳膜的制备
采用两电极体系,以纯度为99.99%的铂网(15 mm×15 mm)为阳极,以掺杂氟的二氧化锡导电玻璃(FTO)为阴极(10 mm×40 mm×2.2 mm)。分别在乙酸、氯乙酸、二氯乙酸和三氯乙酸(国药集团)水溶液中电沉积类金刚石薄膜。碳源浓度为0.1 mol/L,沉积电压为-3.0 V,沉积时间为15 min,电极间距为7 mm,沉积温度为25℃,扫描速度为50 mV/s。为增大碳源的流动性,沉积过程中持续搅拌。电沉积前FTO导电玻璃表面先经丙酮超声清洗去油,再经乙醇超声清洗去除丙酮及其他污染物,最后经水洗吹干待用。沉积结束后,样品经水洗吹干待测。
1.2 测试与表征
通过扫描电子显微镜(JSM-6360LA、日本电子株式会社)、拉曼光谱仪(DXR、赛默飞世尔科技)分析薄膜的形貌和结构,通过四探针测试仪(RST-9、上海精密科学仪器有限公司)测试薄膜的电导率,通过台阶仪(BRUKER-DektakXT、美国布鲁克公司)测量薄膜的厚度,使用pH计(PHS--3C、上海仪电有限公司)测量碳源的pH值,使用电导率测试仪(DDS-11A、上海创益仪器有限公司)测试碳源的电导率。
2 结果与讨论
2.1 碳源分子的空间结构
由于氯原子的电负性(3.16)大于氢原子的电负性(2.20),所以碳源分子中电子云偏向氯取代甲基一端,因此比单纯的甲基容易与羧基断键,使得氯代乙酸水溶液比乙酸水溶液更适合作为沉积类金刚石薄膜的碳源,其次因为C-Cl键的键能为351 kJ/mol小于C-H键的键能414 kJ/mol[6],所以前者更容易断裂,然后形成C-C键,四种碳源的空间立体结构如图1所示,所以推测出在四种碳源中电化学沉积类金刚石薄膜由易到难的顺序为:三氯乙酸、二氯乙酸、氯乙酸、乙酸。为研究这四种碳源被还原成碳的难易程度,在含有这四种碳源的水溶液中进行类金刚石薄膜的电沉积。

图1 四种有机酸的空间立体结构(1为氢原子,2为碳原子,3为氧原子,4为氯原子)Fig 1 The three-dimensional structure of four organic acids.(1 hydrogen atom,2 carbon atom,,3 oxygen atom,,4 chlorine atom)
2.2 不同碳源中的极化曲线测试
在0.1 mol/L的乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液中进行极化曲线测试,获得的电流密度随槽电压的变化曲线如图2所示。随着槽电压的逐渐增加,工作电极上的电流密度也逐渐增大,从图中可以看出,在相同槽电压下在四种水溶液中工作电极上的电流密度由大到小的顺序为:三氯乙酸、二氯乙酸、氯乙酸、乙酸水溶液。因此推测氯原子的取代可以显著的提高电化学沉积过程中工作电极上的电流密度,并且随着氯原子取代数量的增多,电流密度也随之增大。

图2 不同溶液中(0.1 mol/L乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液)的极化曲线Fig.2 Polarization curves in different solutions:0.1 mol/L acetic acid,chloroacetic acid,dichloroacetic acid,trichloroacetic acid aqueous solution.
2.3 不同碳源的pH和电导率测试
0.1 mol/L的乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液的pH值以及电导率变化如图3所示。随着碳源中氯原子数量的不断增加,溶液的pH值逐渐减小,这是因为氯原子的电负性大于碳原子,致使亚甲基的电子云偏向于氢原子,由于共轭效应,氯甲基吸引羧基上的电子云,致使羟基上的氢原子和氧原子之间作用力减小,促使氢原子更容易失电子电离,氢离子浓度增大,所以溶液的pH值减小[7]。溶液的酸性增强,说明其中的氢离子浓度增大,从而使得溶液的导电性能有所提升,从图中可以看出,随着碳源中氯原子数量的增加,溶液的导电性能更佳,这是因为酸性溶液的导电性能主要由溶液中氢离子浓度决定,随着氢离子浓度的增加,溶液的导电性能相应增强。

图3 不同溶液中(0.1 mol/L乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液)溶液的pH和电导率Fig.3 pH and conductivity of solutions in different solutions(0.1 mol/L acetic acid,chloroacetic acid,dichloroacetic acid,trichloroacetic acid aqueous solution)
2.4 氯离子干扰实验
为了排除溶液中氢离子浓度对实验结果的影响,采用适量的浓硫酸(98%)溶液调节溶液的pH,在相同浓度下将其他三种水溶液的pH值调到与三氯乙酸水溶液相同(0.62),此时四种水溶液的电导率都为25 mS/cm,进行极化曲线测试,得到电流密度随槽电压的变化曲线如图4所示。随着槽电压逐渐增加,工作电极上的电流密度逐渐增大,从图中可以看出,调节pH相同后,在相同槽电压下,在四种水溶液中工作电极上的电流密度近乎相等,说明溶液中氢离子的浓度对电流密度有直接影响。此时可以排除氢离子浓度对后期实验结果的干扰。

图4 不同溶液中(0.1 mol/L乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液pH均为0.62)的极化曲线Fig.4 Polarization curves in different solutions(pH of 0.1 mol/L acetic acid,chloroacetic acid,dichloroacetic acid,and trichloroacetic acid aqueous solutions are all 0.62)
2.5 薄膜的表面形貌
在0.1 mol/L的乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液(pH均为0.62)中沉积获得类金刚石薄膜,并利用扫描电子显微镜对薄膜的形貌进行表征,得到薄膜的表面形貌如图5所示。可以看出在没有氯取代的乙酸水溶液中导电玻璃基体上沉积的薄膜(图5(a))颗粒粒径较大,颗粒之间存在间隙,薄膜不够致密,而在氯乙酸水溶液中在导电玻璃基体上沉积的薄膜(图5(b))颗粒粒径减小,颗粒之间无明显间隙,薄膜较为致密,在二氯乙酸水溶液中在导电玻璃基体上沉积的薄膜(图5(c))和三氯乙酸水溶液中在导电玻璃基体上沉积的薄膜(图5(d))颗粒粒径很小,颗粒之间间隙极小,薄膜更为致密。因此可以得出随着氯原子数量的增加,电沉积生成的薄膜的颗粒粒径逐渐减小,并且颗粒之间的间隙越来越小,薄膜更为致密。

图5 不同溶液中(0.1 mol/L乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液pH均为0.62)电沉积类金刚石薄膜的形貌Fig.5 Morphology of electrodeposited diamond-like carbon films in different solutions(0.1 mol/L acetic acid,chloroacetic acid,dichloroacetic acid,and trichloroacetic acid aqueous solution pH are 0.62)
2.6 薄膜的厚度及电导率测试
为了探究溶液中氯原子数量对电沉积的类金刚石薄膜的厚度的影响,采用台阶仪对导电玻璃表面上沉积的薄膜的厚度进行测量,得到分别在0.1 mol/L的乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液中沉积的薄膜的厚度变化如图6所示。可以看出,在四种水溶液中沉积的薄膜厚度由大到小为:氯乙酸(300 nm)、乙酸(200 nm)、二氯乙酸(20 nm)、三氯乙酸(17 nm)。根据厚度的结果可以得出,当一个数量的氯原子取代乙酸水溶液作为碳源时,能够促进类金刚石薄膜的电沉积,薄膜的厚度增加,但是随着氯原子取代数量增多时,抑制了类金刚石薄膜的沉积,使得薄膜的厚度减小。这可能是由于氯原子的原子体积大于氢原子,所占据的空间较大,增大了取代基的空间位阻,导致碳原子取代基的碳原子之间难以形成C-C键,从而薄膜难以持续生长,所以较多的氯原子取代导致二氯乙酸水溶液和三氯乙酸水溶液中沉积的类金刚石薄膜厚度较低。
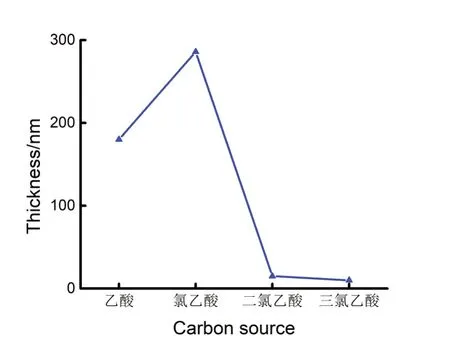
图6 不同溶液中(0.1 mol/L乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液pH均为0.62)电沉积类金刚石薄膜的厚度Fig.6 Thickness of electrodeposited diamond-like carbon film in different solutions(0.1 mol/L acetic acid,chloroacetic acid,dichloroacetic acid,and trichloroacetic acid aqueous solution pH are 0.62)
为了探究溶液中氯原子数量对沉积的薄膜的电导率的影响,使用四探针测试仪测试在0.1 mol/L的乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液中沉积的类金刚石薄膜的电阻,再根据公式1得到薄膜的电导率变化如图7所示。

图7 不同溶液中(0.1 mol/L乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液pH均为0.62)电沉积类金刚石薄膜的电导率Fig.7 Conductivity of electro-deposited diamondlike carbon films in different solutions(0.1 mol/L acetic acid,chloroacetic acid,dichloroacetic acid,and trichloroacetic acid aqueous solution pH are 0.62)

式中:κ表示电导率,(Ω·cm)-1,δ表示薄膜厚度,cm,R表示电阻,Ω。
可以看出,随着溶液中氯原子数量的增加,沉积的类金刚石薄膜的电导率的变化趋势是和图6中厚度的变化趋势是一致的,可以看出在氯乙酸水溶液中薄膜的电导率最大,在二氯乙酸和三氯乙酸水溶液中薄膜的电导率是比在乙酸水溶液中更低的,这是因为在氯乙酸水溶液中沉积的薄膜的厚度最大,但是薄膜的电阻最小,最终薄膜的电导率也是最大的,同理,在三氯乙酸水溶液中沉积的薄膜厚度最小,薄膜电阻最大,电导率最小。
2.7 薄膜的结构表征
利用拉曼光谱仪对在0.1 mol/L的乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液中沉积的类金刚石薄膜的结构进行表征,得到薄膜的拉曼光谱如图8所示。可以看出在没有氯取代的乙酸水溶液中导电玻璃上沉积的碳膜(图8(a))拉曼光谱在1350 cm-1和1580 cm-1附近存在两个峰,这两个峰分别对应碳材料的D峰和G峰[8],而且D峰峰高高于G峰,而D峰和G峰分别对应于金刚石和结晶石墨的特征峰。由此谱图可以看出该薄膜属于类金刚石薄膜,而在氯乙酸水溶液中时导电玻璃基体上沉积的碳膜(图8(b))也出现同样的D峰和G峰,D峰峰高同样大于G峰,在二氯乙酸水溶液中时导电玻璃基体上沉积的碳膜(图8(c))和三氯乙酸水溶液中时导电玻璃基体上沉积的碳膜(图8(d))G峰峰高明显高于D峰峰高,可能是由于薄膜的石墨化程度更明显。

图8 不同溶液中(0.1 mol/L乙酸、氯乙酸、二氯乙酸、三氯乙酸水溶液pH均为0.62)电沉积类金刚石薄膜的拉曼光谱Fig.8 Raman spectra of electro-deposited diamond-like carbon films in different solutions(0.1 mol/L acetic acid,chloroacetic acid,dichloroacetic acid,and trichloroacetic acid aqueous solution pH are 0.62)
3 机理分析
在电化学沉积的过程中,通过电源在两个电极之间施加一个电场,使得碳源分子发生极化甚至电离,并在电极表面发生电化学反应,在电极表面逐渐形成连续的薄膜,即类金刚石薄膜。
在目前液相电沉积类金刚石薄膜的实验中,电化学反应是通过碳源中分子的极化导电。Zhu[9]等人通过研究不同的有机溶剂作为碳源,提出了极化-反应机制,基本反应过程为极性分子中电子分布偏向极性基团,极性分子被诱导极化,在电极之间施加高电位使电极表面活化,成为活化的反应点,活化分子在电极表面发生电化学反应生成类金刚石薄膜、气体等产物;电解过程中自由基与基体表面结合,形成碳核。在外加电场的作用下,甲基正离子不断取代碳核上的氢,核不断长大,形成碳颗粒,相邻的碳颗粒紧密排列成膜。
由此可以类推,在乙酸、氯乙酸、二氯乙酸、三氯乙酸这四种有机酸水溶液中,在常温、低电压条件下均可以得到类金刚石薄膜。在相同的碳源浓度、沉积电压、沉积时间条件下,电沉积得到类金刚石薄膜的难易顺序由易到难依次为:氯乙酸、乙酸、二氯乙酸、三氯乙酸。这是由元素原子的电负性以及空间位阻共同作用的结果。由于氯原子的电负性(3.16)大于氢原子的电负性(2.20),所以碳源分子中电子云偏向于氯取代的甲基一端,因此比单纯的甲基更容易与羧基断键,使得以卤代乙酸为碳源更容易沉积。另一方面,根据类金刚石薄膜的沉积机理,氯取代的甲基沉积在FTO导电玻璃表面,多个氯取代的甲基通过进一步的反应,脱氢,形成连续碳膜。随着碳源中氯取代数量的增加,又由于氯原子体积大于氢原子,增大了取代基的空间位阻,使得取代基无法与中间位置的碳相连,无法形成C-C键,导致沉积困难,薄膜难以持续生长,无法形成连续的类金刚石薄膜[7]。
4 结论
本文在常温、低电压条件下,分别在乙酸、氯乙酸、二氯乙酸和三氯乙酸水溶液中电沉积类金刚石薄膜,结果表明,在这些水溶液中均能电沉积制备出类金刚石薄膜,说明氯取代羧酸溶液是可以作为低电压下电沉积类金刚石薄膜的碳源的。且氯乙酸水溶液为碳源电沉积的薄膜的形貌以及厚度和电导率均优于以乙酸水溶液作为碳源沉积的薄膜,但是二氯乙酸和三氯乙酸水溶液作为碳源比乙酸为碳源时电沉积类金刚石薄膜沉积的薄膜厚度降低,薄膜的电导率下降。因此可以推测在常温、低电压条件下,在相同的碳源浓度、沉积电压和沉积时间的条件下沉积类金刚石薄膜的难易程度,由易到难依次为氯乙酸、乙酸、二氯乙酸、三氯乙酸。
