基于木质素单体含量的园林生物质降解菌评价
2021-08-06吴桐路强强赵叶子陈智坤刑国强贾锐鱼
吴桐,路强强,赵叶子,陈智坤,刑国强,贾锐鱼
(1.陕西省科学院土壤资源与生物技术应用重点实验室,陕西省西安植物园(陕西省植物研究所),西安 710061;2.西安科技大学地质与环境学院,西安 710043;3.西安市阎良区国强瓜菜专业合作社,西安 710089)
园林生物质是园艺生产及农林作业所产生的废弃物,是地球生物圈储量最为丰富的碳水化合物资源[1]。按照化学组成分类,园林生物质主要是由纤维素、半纤维素和木质素构成的大分子交联体——木质纤维素,是参与生态系统物质循环的重要有机物[2]。其中纤维素是由D−葡萄糖以β−1,4 糖苷键键合而成的大分子多糖,是构成植物细胞壁的主要骨架;半纤维素是由多种单糖构成的异质多聚体,起保护纤维素的作用[3];从物质组成与生物合成途径看,木质素主要是由愈创木基(Guaiacyl nuit,G)、紫丁香基(Sy⁃ringy unit,S)和对羟基(p−Hydroxyphenyl,H)3 种苯丙烷结构单元通过酚基氧化和脱氢聚合,并以C—O 键和C—C 键耦合而成的多酚高分子物质。其中,G 型木质素主要沉积于木质部疏导组织的管道壁,具刚性和疏水特性,给予细胞壁更强的抵抗性[4],S 型则沉积于纤维薄壁,具有明显的亲水性和灵敏度[5],H型于胞间层和细胞角隅内,且以微量形式存在而未表现出功能特性[6],3 种木质素单体起到共同支撑木质部输导组织结构稳定性的作用。
木质纤维素的结构特异性决定了其高效降解是各菌系酶间协同作用的结果[7−8]。目前,具木质纤维素降解能力的微生物主要包括真菌、细菌和放线菌,其中真菌起主导作用,放线菌次之,细菌降解能力最弱[9]。降解型真菌包括木腐菌(Wood−rot fungi)、木霉菌(Trichoderma)和曲霉菌(Aspergillus)等,其通过产胞内纤维素酶、半纤维素酶、胞外木质素酶等,经菌丝作用侵入木质纤维素结构腔体间隙,在酶水解和物质代谢中发挥解聚功能[10−11]。王加友等[12]筛选的真菌蓝状菌属(Talaromyces stollii)SY−403 在降解处理玉米秸秆40 d 时,失重率达42.67%;于慧娟等[13]筛选的高纤维素胞外酶真菌Z−5,对秸秆的降解率最高达47%。细菌则是通过分泌胞间纤维素酶等,并附着于木质纤维素表面进行糖苷键的裂解[14],酶活力较高的细菌主要有梭菌属(Clostridium)、单胞菌属(Xan⁃thomonas)、杆菌属(Bacillus)等[15]。KUMAR 等[16]筛选的假单胞菌(Pseudoxanthomonassp)R−28发酵5 d后,对滤纸和纯纤维素废料的降解率分别为96%和95%;亦有细菌产木质素过氧化物酶,可促进木质素降解[17],BILLINGS等[18]从热带雨林土壤中分离得到以木质素为主要碳源的甲苯单胞菌属(Toluomonas)新种,具有较强的木质素过氧化物酶活力。降解型放线菌多为中、高温菌,主要包括诺卡氏菌属(Nocardia)、小单孢菌属(Micromonospora)及链霉菌属(Streptomyces)等,主要来自土壤和腐殖质环境,其通过提高纤维素水溶性、增强菌丝穿透性,达到解聚木质纤维素的作用[19]。刘晓飞等[20]从寒地黑土筛选所得放线菌GS−3−39 可实现对玉米芯的高效发酵,其堆肥降解率高达27.26%;另外,放线菌降解特性在于其对高温、高碱等极端环境的适应,尤其在堆肥高温环境中,其有效活菌数占总菌群的80%以上[21]。而园林生物质的高效酶解更是各菌种协同作用的结果。
水解所得还原糖换算酶活力和木质纤维素降解失重率是评价微生物降解能力最为常用的指标。FANG 等[22]从园林废弃物中筛选到复合微生物群落DM −1,在培养16 d 后其木质素酶活力依然高达67.44 U·mL−1;马欣雨等[23]从腐烂秸秆中分离的高效纤维素降解菌NX9,经液态发酵15 d,其降解失重率达到53.88%。同时,也有通过测定各物质组分含量评价微生物降解效率,如王天珍[24]利用桦褐孔菌(Ino⁃notus obliquus)降解甘蔗渣,培养发酵14 d时,木质素、纤维素和半纤维素的含量较未添加菌株的空白组分别减少了29.6%、24.3%和21.0%。ZHANG 等[25]利用商品酶的选择酶解特性和气相色谱−质谱联用技术(GC−MS),对木质纤维素酶解过程中木质素结构的解聚变化进行分析,发现木质素含量减少与聚合物结构变化存在显著关系。然而,木质素结构变化将会导致怎样的单体含量变化目前仍未知,且未见通过木质素单体结构变化表征降解效率的报道。为此,本文以降解剩余物中木质素单体含量的动态变化作为量化指标,并结合酶活力和失重率综合评价各降解菌的酶解效率。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
降解菌株筛选所用腐殖质层取自祁连山国家公园(海拔2 350 m)天然青海云杉(Qinghai Pine)林下表层0~10 cm土壤。
1.1.2 培养基选择
筛选所用培养基配制为:羧甲基纤维素钠10 g、蛋白胨10 g、氯化钠5 g、磷酸二氢钾1 g、琼脂20 g、纯水1 L;培养所用培养基为:溶菌肉汤LB、营养琼脂NA、马铃薯PDA和刚果红培养基。
1.2 试验方法
1.2.1 菌株的筛选与鉴定
1.2.1.1 菌种筛选分离
取腐殖质层土壤10 g 于含有90 mL 无菌水的250 mL 锥形瓶中,无菌封口后摇床振荡1 h,静置,并于无菌操作台制备浓度依次为10−1~10−7的稀释液,分别吸取200 µL 涂布于筛选培养基(各浓度均3 个平行),于30 ℃恒温培养箱中培养并每日观察其生长情况,经多次纯化和传代分离后得到单一菌株。
1.2.1.2 刚果红透明圈试验
将各菌株点接于刚果红培养基上培养3 d 后,用1 mol·L−1NaCl 溶液脱色30 min,分别测定菌落直径(d)和降解圈直径(D)[26]。
1.2.1.3 理化性质试验
根据所筛选目的性要求,依据《常见细菌系统鉴定手册》[27],选取以下特征指标进行鉴定试验:葡萄糖发酵、木糖发酵、半乳糖发酵、淀粉水解和纤维素水解。
1.2.1.4 菌种鉴定
分别提取细菌和真菌基因组DNA,以27F(AGAGTTTGATCMTGGCTCAG)、1492R(TACGGY⁃TACCTTGTTACGACTT)和ITS1(5′ −TCCGTAGGT⁃GAACCTGCGG −3′)、ITS4(5′−TCCTCCGCTTATT⁃GATATGC−3′)作为16S rDNA 和18S rDNA 引物,利用细菌和真菌基因组DNA 的PCR 扩增产物进行测序,并用BLAST 软件进行NCBI 序列数据比对。引物扩增与测序由北京六合华大基因科技有限公司提供技术支撑。
1.2.2 酶活力测定
纤维素酶活力(CMC)和总酶活力(FPA)测定:离心使菌体与酶液分离,试管中分别加入1%的羧甲基纤维素钠(或50 mg 滤纸条)、1.5 mL 柠檬酸钠缓冲溶液(0.05 mol·L−1pH 5)、粗酶液0.5 mL,以加入0.5 mL无菌水为对照,3 组平行,50 ℃水浴1 h 后向各试管加入3 mL DNS 试剂,于热水浴中煮沸5 min 后取出,冷却至室温后定容至20 mL,摇匀,吸取300 µL 溶液到酶标板,于波长540 nm 下测吸光值,在葡萄糖标准曲线上查出还原糖含量,通过公式换算酶活力值[28]。
酶活力定义:1 mL 酶液催化底物生成1 µg 葡萄糖为一个酶活力单位,以U·mL−1表示。
1.2.3 产酶条件优化
通过5因素4水平正交实验组合对菌株的产酶条件进行优化,选取的因素分别为:碳源(包括葡萄糖、淀粉、羧甲基纤维素钠和蔗糖)、氮源(包括硝酸钾、硫酸铵、酵母粉和蛋白胨)、温度(25~40 ℃)、时间(12~48 h)和pH(3~9),通过紫外分光光度计以OD600值作为结果,以极差法作为分析方法,并以CMC 和FPA 酶活力进行结果验证。
1.2.4 枯茎降解试验
将阴干枯茎(取自西安植物园水景区自然枯萎芦苇的茎秆、枯叶、花穗)剪碎至1~2 cm,蒸馏水浸泡过夜以冲洗可溶性有机物,85 ℃烘干待用。称取枯茎(mP)3 g、硫酸铵0.4 g、硫酸镁0.1 g 于500 mL 锥形瓶,加入60 mL 磷酸缓冲液(5 mmol·L−1pH 7)后121 ℃灭菌,冷却后加入菌液6 mL(3 组平行),以加入6 mL 蒸馏水作为空白对照组(CK),混匀后置于50 ℃恒温培养箱培养15 d,定期观察枯茎发酵降解情况,分别于第5、10、15 d 取出,过滤发酵物,蒸馏水冲洗去除菌体,将剩余物置于105 ℃烘干至恒质量,称取未降解质量(mS),测定其降解率(Dr)[29]:
1.2.5 木质素单体含量测定
木质素单体结构苯丙烷基的α、β 位羟基在高温条件下可与乙硫醇发生硫代酸解反应,形成分子量不等的木质素硫化烷衍生物。其中,愈创木基(G 型)硫化物的分子离子峰(m/z)为269、紫丁香基(S 型)硫化物的分子离子峰(m/z)为299,可利用GC−MS 技术进行定性分离和离子峰定量测定,从而表征木质素各单体含量[30]。
样品制备[31]:10 mg 样品中加入1 mL 硫代酸解试剂(2.5%三氟化硼乙醚、10%乙硫醇、87.5%1−4 二氧六环),100 ℃水浴反应4 h,每隔0.5 h 摇动搅拌一次。快速冷却后添加0.2 mL 二十四烷(1 mg·mL−1)作为内标,加入0.3 mL 碳酸氢钠溶液(0.4 mol·L−1)使pH 为3~4,再加入1 mL 二氯甲烷分别萃取3 次,放置5 min以分层,转移有机相(下部颜色较深物质)到另一小瓶中,加入50~70 mg 无水硫酸钠,氮吹浓缩后将残留物重新溶解在0.3 mL 二氯甲烷中,并加入35µL 嘧啶和75µL N,O−(三甲基硅烷基)双乙酰胺,室温静置4 h,进行GC−MS分析。
GC 条件:进样温度250 ℃,进样量1 µL,分流进样(10∶1),色谱柱恒定流速为1.8 mL·min−1,柱箱初始温度为160 ℃,然后以20 ℃·min−1的速度升至250 ℃并保持5 min。MS 条件:电子电离(EI)模式,离子源温度230 ℃,界面温度250 ℃,电子能量70 eV,溶剂延迟3.5 min,扫描范围40~650 amu。采用Lapierre[32]的方法对目标单体进行量化,将响应因子K定义为内标物相对浓度与样品相对面积的比值,为1.5。
式中:K为响应系数;Cs和Ci为样品和内标物的浓度,mg·mL−1;As和Ai为二者的峰面积,mV·min。
2 结果与分析
2.1 菌种筛选与产酶优化
2.1.1 菌种筛选与鉴定
经定向筛选、刚果红染色及酶活力测定发现,菌株QL−1 和QL−4 的透明圈最为明显,对应D/d值分别为(2.84±0.20)和(3.16±0.13),其初始酶活力及相关理化特性表征结果见表1。
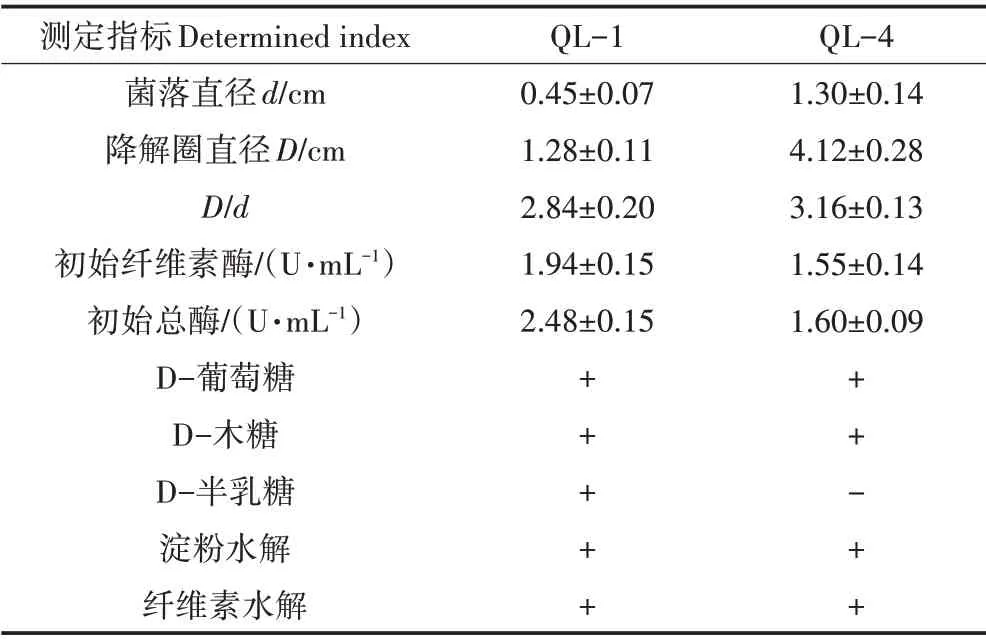
表1 菌种基本特性Table 1 Basic characteristics of strains
菌株形态观察发现,QL−1 具细菌形态特征,菌落呈乳白色、表面光泽,呈圆形凸起、边缘扁平,有较明显气味;而QL−4 表面为烟绿色,背面为白色或淡黄色,呈绒毛状,具真菌形态特征。经16S rDNA 和18S rDNA 的基因组PCR 扩增测序及NCBI 数据库Blast相似性对比发现,菌株QL−1与标准菌株Pseudo⁃monas mandelii相似性最高达99.72%,鉴定为曼氏假单胞菌,QL−4与标准菌株Asperqillus fumiqatus相似性达100%,鉴定为烟曲霉。菌株QL−1 和QL−4 为筛选菌中酶活力最高的细菌和真菌,为便于木质素单体含量和综合降解效率的对比评价,本文以下研究工作均基于该两菌株开展。
2.1.2 产酶条件与酶活力
极差分析结果显示,氮源是菌株QL−1 和QL−4的最主要影响因素,而培养时间则为最不重要的影响因素。另外,pH 为菌株QL−1 的次要影响因素,碳源则为QL−4的次要因子;均值结果显示,QL−1和QL−4对应的碳、氮源分别为葡萄糖、酵母粉和淀粉、蛋白胨,发酵条件为36 h、35 ℃、pH 7.0。
经产酶条件优化,两菌株酶活力均有显著提高(图1),其中QL−1 的纤维素酶活力达到14.10 U·mL−1,较优化前提高了7.27 倍,总酶活力则提高了8.15倍,达到20.22 U·mL−1;QL−4的纤维素酶活力、总酶活力分别达到8.15、9.20 U·mL−1,较优化前提高了5.26 倍和5.75 倍。总体上,QL−1 的酶活力及优化倍数均稍优于QL−4。
2.2 枯茎降解效率
如图2 所示,从降解时间看,菌株QL−1 在第5 d时降解失重率为6.96%,其降解失重峰值出现于第10 d,为9.48%;而QL−4在5 d时的降解失重率为7.66%,降解峰值亦出现在第10 d,为13.91%。两菌株的共同特征为:培养至第10 d 时达到降解失重率峰值,而在第10~15 d 时,微生物代谢缓慢,降解趋于稳定。由此可见,10 d为降解失重率的最大时效期。
从净降解率看,菌株QL−4 和QL−1 在第5、10、15d的净降解率分别为4.08%、10.11%、10.57%和3.38%、5.68%、6.05%。尽管净降解率均随时间逐渐增加,但QL−4在第5~10d的降解速率最快,为59.64%,而在第10~15 d 降解速率仅为4.35%;同样,QL−1在第5~10 d的降解速率是第10~15 d的6.62倍。由此表明,若从时间成本和降解效率考量,10 d 仍可作为最佳降解时间。综合失重率和净降解率,均呈现真菌QL−4优于细菌QL−1,且远高于CK的结果。
2.3 降解剩余物中的木质素单体含量
2.3.1 木质素单体含量占比
表2 为菌株降解剩余物中木质素各单体的含量占比。从时间看,菌株QL−1 和QL−4 降解剩余物中木质素各单体含量均随降解时间增加而减少,表明其对木质素具有一定的解聚作用;从组别看,在降解第5 d 时,QL−1 剩余木质素各单体含量占比均少于QL−4,表明此时细菌的降解作用更为突出,然而到第10 d时,真菌表现出显著的降解作用,其剩余物中G+S 单体含量从16.25%降至2.01%,而细菌试验组仅减少了2.86 个百分点,此后直到第15 d,两菌株均表现为降解减少或不降解现象。以上结果表明,第10 d时两菌株对木质素单体的解聚效率最高。
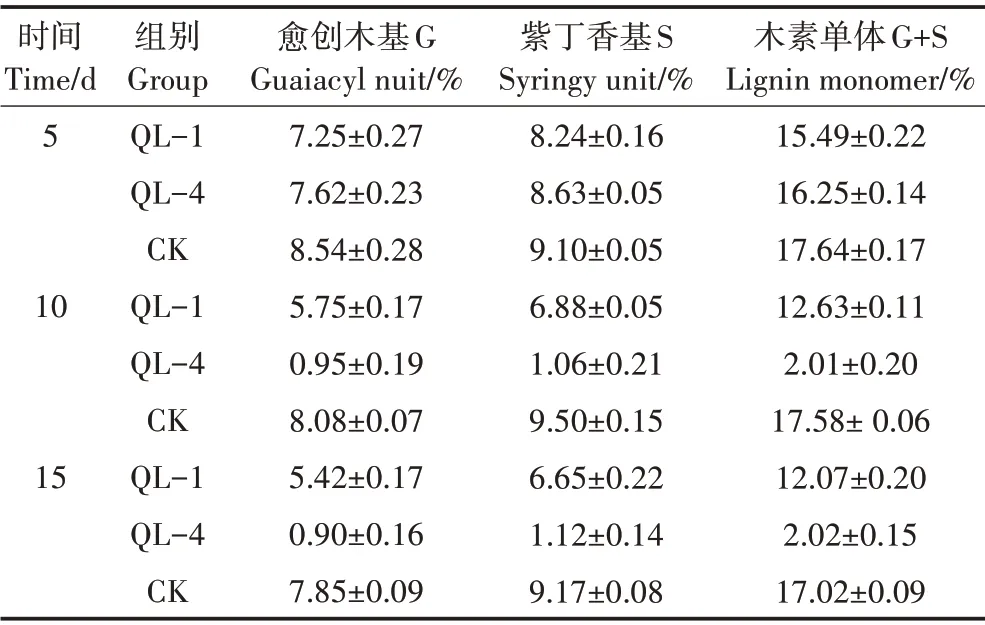
表2 降解剩余物中木质素单体含量占比Table 2 Lignin monomer content ratio in degradation residue
2.3.2 木质素单体含量变化
在木质素化学结构官能团中,酚羟基的多少可直接反映木质素的物理溶解性与化学键合能力,甲氧基是木质素苯酚基前体单元在辅酶因子作用下以醚键(C—O—C)结合而形成具化学稳定特性的基团[33]。相较于只含有3 位甲氧基的G 型木质素,S 型木质素(3、5位均含有甲氧基)结构更加稳定。
图3 木质素单体变化表明,降解第5 d 菌株QL−1、QL−4 对G 和S 单体的净降解率分别为1.29%、0.86%和0.92%、0.47%,均表现为G单体降解率高于S单体,而在5 d 后两株菌又表现为S 较G 单体降解得多。原因可能在于初始降解阶段酶解作用位点释放有限,菌株更易与G 型木质素的甲氧基酶解位点结合。当酶解条件最适宜时,菌株则快速发生代谢酶解活性,使得含量较高的S型单体被更多利用。
从菌株差异看,QL−1和QL−4均在第5~10 d时对G+S 单体降解速率最快,第10 d 达到净降解率最大值,分别为4.95%和15.57%。细菌QL−1 仅在酶解第5 d 时对G+S 单体的净降解率高于真菌QL−4,而在5 d后QL−4则持续呈现更高效的降解能力,直到第15 d时,QL−4 对G+S 的净降解率仍为QL−1 的3.03 倍。可能原因在于,细菌更具环境适应性,从而显现底物优先利用特性,而真菌则需要一定的代谢转化过程,通常在降解后期更具优势。
图4 为QL−4 在第5、10、15 d 时木质素单体降解变化示意图。由GC−MS 谱图变化直观看到,木质素G 型和S 型单体随降解时间延长均有显著变化,而H型单体因其微量存在,并未捕捉到分子离子峰。综上分析,单体含量变化与失重率结果呈一致性,此方法可用于综合评价菌株的降解能力。
3 讨论
3.1 酶活力与降解效果
降解木质纤维素的酶系主要包括纤维素酶(纤维素内切酶、外切酶和β−葡萄糖苷酶等)、半纤维素酶(β−1,4−内切木聚糖酶、β−木糖苷酶和α−L−阿拉伯糖苷酶等)和木质素氧化酶(木质素过氧化物酶、锰过氧化物酶和漆酶等)[34]。自然界中,木质纤维素的完全降解是真菌、细菌以及其他微生物等经复杂的酶系协同作用的结果。有报道发现,一种真菌的酶解反应有39种代谢物和123种调控基因参与其中,并通过胞内调控网络及级联反应实现酶解功能[35]。通常高纤维素酶活力的菌株具较强降解能力。刘孝文[36]筛选的烟曲霉L1,其CMC 和FPA 酶活力分别为62.15 U·mL−1和50.33 U·mL−1,降解棕榈丝的第5 d达到最高降解率为18.04%;接种烟曲霉Z−3 的玉米秸秆失重率在第30 d 达到了26.76%,该菌株的CMC 和FPA 酶活力也较高,在第96 h 分别达到27.35 U·mL−1和14.67 U·mL−1[37]。本文筛选所得烟曲霉QL−4酶活力低于细菌QL−1,但其在降解效果上则高于QL−1,龙悦[38]的研究也体现了类似结果,其筛选的烟曲霉LY1纤维素酶活力为1.40 U·mL−1,与粉碎稻草发酵后降解失重率仍达到18%。菌株的酶活力与其发酵底物的失重率并不全然一致,其为酶系多样性和酶间协同作用导致的结果。因此,酶活力仅可作为降解菌筛选指标之一,并不能完全用于表征其酶解特性,还应从多角度综合评价菌株的降解功能。
3.2 降解失重率与降解选择性
菌株QL−4降解失重率约为QL−1的1.75倍,而其木质素单体降解率则为QL−1 的3.03 倍,表明烟曲霉QL−4在降解过程中对木质素的酶解利用更具选择性。已知的对木质素降解具有高选择性的模式真菌——白腐菌(Phanerochaete chrysosporium),通过选择性降解木质素使得纤维素及半纤维素具更大的可及性,利于被降解。白腐菌桦褐孔菌(Inonotus obliquus)各酶活力的明显差异,体现出对木质素酶解的选择性,当CMC 酶活力为0.3 U·mL−1并随发酵时间趋于减弱时,木质素锰过氧化物酶活力持续升高,达到最大为317.9 U·mL−1[24];白腐菌多孔菌(Physisporinus vitreus)对毛竹的降解处理中,木质素含量的降解减少率最高达21.21%,是纤维素的3.10倍[39]。本文以木质素单体含量变化表征各菌株的降解效率和选择性,发现烟曲霉对木质素单体降解更具选择性,其G+S总单体净降解率在第10 d 便达到最高值15.57%。研究报道中能够选择性降解木质素的微生物多为白腐菌,而本文所述结果表明,此烟曲霉亦具木质素酶解选择性。
3.3 烟曲霉具降解优势
以往研究表明,烟曲霉在园林废弃物降解领域中具有显著应用潜力。欧阳蒲月等[40]在广州近郊筛选的烟曲霉OY−01,具有较强的纤维素降解能力,最适生长温度和pH 分别为35 ℃和6.0~7.0,培养时间为48 h,CMC 酶活力达到1.75 U·mL−1;李乐等[41]从腐烂秸秆中筛选的高产纤维素酶真菌QL06,在40 ℃培养84 h 时,所产CMC 酶活力最大为5.41 U·mL−1;有报道低温烟曲霉S7在25 ℃的最高CMC酶活力为0.128 U·mL−1[42],产耐热纤维素酶烟曲霉NR61 在65 ℃的CMC酶活力为2.41 U·mL−1[43]。本文筛选的烟曲霉QL−4产酶条件与目前报道的其他烟曲霉相近,而纤维素酶活力则高达8.15 U·mL−1,在类似酶解研究中更具优势。但是,以往关于烟曲霉酶解过程引起木质素单体含量变化的研究未见报道,而本研究工作则从木质素结构组成与单体含量角度,为烟曲霉酶解提供了数据支撑。与此同时,酶解引起木质素各单体发生差异性改变的机理仍存在诸多未知,其酶间协同作用和木质素单体含量变化机制还需进一步探究。
4 结论
(1)从祁连山腐殖质土层中筛选得到2 株产纤维素酶较好的菌株QL−1和QL−4,经鉴定分别为曼氏假单胞菌(Pseudomonas mandelii)和烟曲霉(Aspergillus fumigatus),经产酶优化后纤维素酶活力分别为14.10 U·mL−1和8.15 U·mL−1。
(2)菌株QL−1 和QL−4 的降解失重率在第10 d时达最高,QL−4 对应的木质素单体相对降解率和净降解率分别是QL−1 的4.75 倍和3.15 倍,表明烟曲霉更具降解优势和应用潜力。
(3)通过气相色谱−质谱法表征木质素单体含量变化,可为园林生物质酶解效率评价提供更为可靠的量化指标,以木质素单体结构位点差异为重点的酶解构效关系研究仍然是实现木质纤维素最大降解效率的关键所在。
