机械敏感性通道蛋白对膝骨关节炎滑膜巨噬细胞焦亡的调控效应分析
2021-08-05廖太阳王培民徐波张力李晓辰吴鹏邢润麟黄正泉张农山
廖太阳 王培民 徐波 张力 李晓辰 吴鹏 邢润麟 黄正泉 张农山△
《OARSI膝骨关节炎非手术治疗指南》认为异常机械应力是膝骨关节炎(KOA)发病的高危因素,力学干预被推荐为治疗的核心等级[1]。细胞焦亡与细胞膜上的多种离子通道的开闭密切相关[2],其中Piezo1离子通道能够感受多种力学刺激并迅速响应,介导多种2价阳离子内流,是完全意义上的力敏感离子通道及机械敏感性阳离子通道[3]。中医学“久行伤筋”经典理论与现代异常机械应力存在某些契合之处,笔者探究在异常机械拉伸应力的作用下,是否通过激活滑膜巨噬细胞表面Piezo1离子通道,介导细胞焦亡及推动KOA炎症反应。
1 材料与方法
1.1 实验动物
SPF级别雄性SD大鼠5只,体质量180~200 g,由南京市江宁区青龙山动物繁殖场提供,动物许可证号为SYXK(苏)2017-0001。
1.2 实验药物及试剂
Piezo1抑制剂GsMTx4(批号为B5762,美国APE分子生物公司);MitoSOXTM红色线粒体超氧物指示剂(批号为M36008,美国 Thermo 公司);乳酸脱氢酶(LDH)检测试剂盒(批号为C0016,碧云天);细胞凋亡Hoechst33342/PI 双染试剂盒(批号为CA1120,索莱宝公司);白介素-1β(Rat,IL-1β)、白介素-18(Rat,IL-18)、ELISA试剂盒(批号为F15810,F15950,上海西唐生物公司);活性氧(ROS)检测标准试剂盒(批号为S0033,上海Beyotime生物公司);Caspase-1 p10 抗体(批号为P29466,Bioworld 生物科技公司);Caspase-1一抗、GSDMD一抗、β-actin内参抗体(批号为ab1872,ab219800,ab8227,Abcam公司);胰蛋白酶消化液、培养基(美国Gibco公司)。
1.3 实验仪器
细胞牵张拉伸应力加载实验系统(型号为FX-5000T);BioFlex专用板(美国flexcell细胞力学公司);酶标仪(美国 Enspire 公司);蛋白电泳系统,电泳凝胶成像系统,超灵敏化学发光成像系统LAS-4000(美国GE公司);荧光倒置显微镜(型号为DMI-3000B,德国莱卡生物公司)。
1.4 方法
1.4.1细胞提取与培养 5只SD大鼠(6周,180~200 g),由江苏省青龙山动物场提供(许可证号SYXK(苏)2017-0001)提供,通过二氧化碳窒息法处死大鼠。消毒后,将大鼠轻放在一消毒过的硬板上,垫高腹部,从腹腔右侧偏下位置注射0.01 mmol/L PBS溶液30 mL,然后仰卧平放在冰上,轻柔按摩大鼠腹部3~5 min。在无菌条件下打开腹腔,可观察到腹腔内有淡黄色清亮液体即为腹腔液,用50 mL大注射器轻轻抽取液体约20~30 mL,注意避免戳到肠道组织造成污染。1 200 r/min离心5 min,接种于硅胶膜制成的Bioflex培养板中,在CO2细胞培养箱中培养24 h后常规换液,PBS清洗两遍未贴壁细胞[4]。
1.4.2细胞分组方法及干预过程 巨噬细胞被接种到BioFlex板,并生长融合到80%~90%。实验分组为空白对照组、应力拉伸组及应力拉伸+Piezo1抑制剂组。应力拉伸实验使用FX-5000T拉伸应力系统,以6个循环/min的周期性频率对BioFlex板内巨噬细胞进行表面干预,周期性牵张应力强度为20%,拉伸时间为24 h,频率0.5 Hz刺激,在拉伸24 h后收集细胞。此外,巨噬细胞先使用Piezo1抑制剂(GsMTx4)预处理后进行循环拉伸,空白对照组在相同条件下培养但未暴露于机械拉伸环境中。拉伸结束后收集细胞上清,提取细胞蛋白并进行荧光操作。
1.4.3Western Blot法检测Caspase-1,Caspase-1 p10,GSDMD蛋白表达 提取巨噬细胞总蛋白,BCA法450 nm检测蛋白含量,按照5∶1加入碧云天5倍蛋白上样缓冲液,99 ℃煮蛋白10 min。用BCA法检测蛋白,制备8%的分离胶及4%的分离胶,在各孔道加入蛋白Marker 3 μL标记,随后进行电泳分离及转膜,5%脱脂奶粉封闭,一抗(1∶1 000)过夜,4 ℃孵二抗(1∶5 000)2 h,最后每片PVDF膜使用200 μL ECL曝光显色,内参蛋白设置为 β-actin。
1.4.4巨噬细胞Hoechst33342/PI双染 根据说明书,吸除原培养上清,使用0.01 mmol/L PBS洗3次,每孔依次加入 5 μL Hoechst33342 染色液、5 μL碘化丙啶(PI)染色液和1 mL细胞染色缓冲液。混匀,4 ℃孵育 30 min。吸除染色液,无菌0.01 mmol/L PBS洗3次。用荧光倒置显微镜观察红色荧光和蓝色荧光的分布情况。
1.4.5巨噬细胞培养上清LDH含量检测 根据说明书操作指示,提前1 d准备好细胞含量不超过90%的96孔板,用PBS洗1次,换无血清培养基。设置分组,做好标记,应力拉伸+Piezo1抑制剂组加入Piezo1抑制剂,对照孔加入LDH释放试剂,各孔加入60 μL LDH检测工作液,在490 nm处测定吸光度值,根据说明书所写方法计算LDH酶活力单位。
1.4.6巨噬细胞ROS荧光检测 4 μmol/L的MitoSOX处理细胞15 min,并用无菌PBS洗涤2次,用荧光显微镜观察荧光强度。
1.4.7IL-1β、IL-18含量检测 收集巨噬细胞培养上清液,配置标准品液;每孔加入100 μL标准品或待测样品,轻轻混匀在37 ℃下孵育50 min;洗涤液洗涤4~6次;各孔加入蒸馏水及一抗工作液50 μL,混匀后孵育30 min,洗涤4~6次;后续添加酶标抗体工作液孵育30 min及终止液15 min,450 nm测定吸光度值。
1.5 统计学方法

2 结果
2.1 巨噬细胞各组Caspase-1、Caspase-1 p10及GSDMD蛋白表达量
Western Blot 检测巨噬细胞Caspase-1、Caspase-1 p10及GSDMD蛋白,蛋白条带及相对表达量见图1。应力拉伸组Caspase-1、Caspase-1 p10及GSDMD蛋白较空白对照组表达增加,差异有统计学意义(P<0.05),应力拉伸+Piezo1抑制剂组较应力拉伸组表达下调,差异有统计学意义(P<0.05)。

图1 巨噬细胞各组Caspase-1、Caspase-1 p10及GSDMD蛋白相对表达对比(*应力拉伸组与空白对照组相比,P<0.05;#应力拉伸+Piezo1抑制剂组与应力拉伸组相比,P<0.05)
2.2 巨噬细胞培养上清IL-1β、IL-18含量
ELISA 检测巨噬细胞促炎因子表达水平见图2。应力拉伸组细胞培养上清中IL-1β和IL-18含量显著上升,与空白对照组差异有统计学意义(P<0.05);应力拉伸+Piezo1抑制剂组中的IL-1β和IL-18含量显著下降,与应力拉伸组差异有统计学意义(P<0.05)。
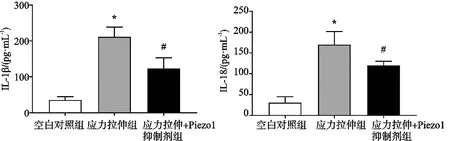
图2 巨噬细胞培养上清IL-1β、IL-18含量(*应力拉伸组与空白对照组相比,P<0.05;#应力拉伸+Piezo1抑制剂组与应力拉伸组相比,P<0.05)
2.3 滑膜巨噬细胞Hoechst33342/PI双染
正常细胞具有完整的细胞膜,PI不能穿过,故不能染色,没有红色荧光;坏死细胞(细胞膜破坏受损)PI可以染色,呈现红色荧光。Hoechst33342可以穿透细胞膜,对细胞核进行染色,呈现蓝色荧光。空白对照组为正常状态,PI不能染色,没有红色荧光;应力拉伸组细胞膜破坏,PI染色阳性,有红色荧光,说明焦亡模型构建成功;应力拉伸+Piezo1抑制剂组细胞膜较为完整,PI不能染色或者染色较少,说明Piezo1介导的细胞焦亡被抑制(见图3)。

图3 巨噬细胞Hoechst33342/PI双染(×100)(应力拉伸组PI染色阳性;应力拉伸+Piezo1抑制剂组PI不能染色或者染色较少)
2.4 巨噬细胞培养上清LDH含量检测
LDH的释放可以作为细胞膜完整性参考指标之一,应力拉伸组巨噬细胞20%机械牵张力干预后,上清中LDH含量显著上升,差异有统计学意义(P<0.05);应力拉伸+Piezo1抑制剂组LDH含量低于应力拉伸组,差异有统计学意义(P<0.05);这说明巨噬细胞在20%的周期性拉伸力作用下细胞破裂,释放大量LDH至细胞外(见图4)。
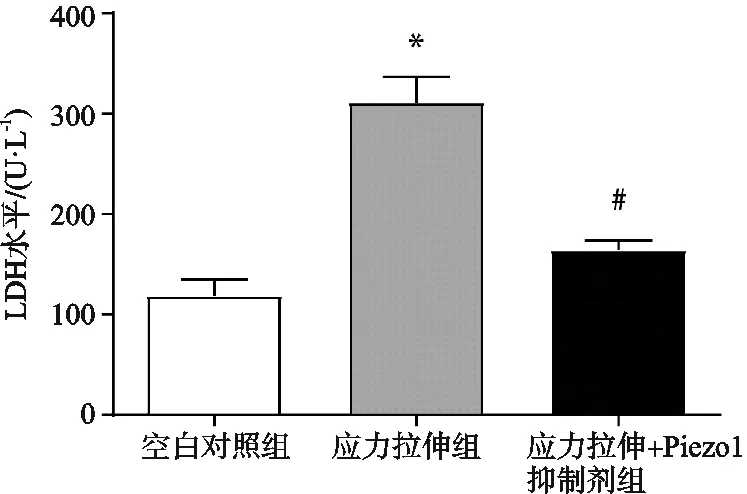
图4 巨噬细胞各组培养上清LDH含量检测(*应力拉伸组与空白对照组相比,P<0.05;#应力拉伸+Piezo1抑制剂组与应力拉伸组相比,P<0.05)
2.5 巨噬细胞ROS荧光采集
检测MitoSOXTM染色下的红色荧光分布可测定线粒体活性氧的水平。ROS的升高直接推动炎症小体活化,巨噬细胞在20%的周期性拉伸力下,活性氧大量产生,诱发Caspase-1活化,发生自我剪切,产生p10片段,GSDMD切割细胞膜,发生焦亡。应力拉伸组在机械牵张应力的作用下,ROS大量产生,呈现红色荧光;应力拉伸+Piezo1抑制剂组ROS产生的红色荧光很少,说明细胞内活性氧水平被抑制(见图5)。

图5 巨噬细胞内线粒体活性氧检测(×100)
3 讨论
KOA是一种常见的以累及软骨、软骨下骨和滑膜病变为特征的慢性致残性关节疾病,KOA最终致残率甚至可达到53%[5]。膝骨关节炎之“骨痹”之称源自《素问·痹论篇》“风寒湿三气杂至合而为痹也……痹在于骨则重,在于筋则屈不伸”[6]。“久行伤筋”理论与骨痹关系也十分密切,《素问·脉要精微论》提及“膝者筋之府,屈伸不能,行则偻附,筋将惫矣”就是对这一关系的深刻阐释。中医学认为“筋骨”之间彼此影响,倘若久行久动,则会导致筋骨皆疲。现代研究表明膝骨关节炎的发生发展与异常机械应力密切相关,是力学与生物学因素等多种因素作用下的结果。在机械拉伸应力作用下,机械敏感性离子通道可以感受细胞膜上力的变化,并快速作出反应,将细胞膜感受到的机械信号转化为电信号或化学信号,进而调控细胞的生命活动[7]。研究发现异常机械应力会对软骨及软骨细胞造成损伤,加重骨关节炎[8]。
众所周知,适当活动可推动气血运行、畅达气机,促进肝血对筋骨的滋养,有利于膝关节筋骨坚固有力;但若一个人保持长时间奔走或者跑步,会导致膝关节筋肉始终紧绷,进而发生劳损疼痛,屈伸不利,诱发KOA。这与力学与炎症微环境的关系是一致的,少量的应力可能使机体内抗炎成分大于促炎成分发挥保护作用,反之,异常的机械应力则使促炎因子异常分泌导致炎症损伤。近年来细胞焦亡已成为研究的热点,吸引了研究者极大的关注,它高度依赖于Caspase-1活化,经过GSDMD诱导,导致细胞破裂死亡,释放大量的炎症因子[9]。笔者之前的研究已经发现滑膜巨噬细胞存在焦亡现象,并且被沉默抑制后会导致NLRP3、ASC、GSDMD和 GSDMD-N 蛋白表达降低[10]。
Piezo1离子通道作为一种对机械敏感的离子通道,可分为Piezo1和Piezo2蛋白[11],研究表明细胞外机械刺激可以调节Piezo1的打开和关闭[12]。近来Piezo1与各种炎症之间的关系也逐渐受到大家的重视[13-14],而细胞焦亡由经典途径(Caspase-1)及非经典途径(Caspase-4、11、5)介导,然后切割底物GSDMD引发炎症级联扩大。GSDMD由2个结构域N-端片段(GSDMD-NT)及C-端片段(GSDMD-CT)组成,前者可诱导细胞焦亡,而后者需要与GSDMD-NT结合才能发挥抑制作用,阻止GSDMD-NT的活化[15]。即Caspase-1与寡聚的炎性小体结合,结合后的复合物活化后,一方面可以形成有活性的炎性介质(IL-1β和IL-18的前体),另一方面GSDMD也被切割,其N-端片段会作为焦亡的“执行者”,自身形成复杂的聚合物并在细胞膜上打孔,对细胞造成不可逆的损伤及崩解,细胞内促炎物质(白介素1β和18)大量释放,引起下游炎症扩大[16-17]。在另一项研究中发现在髓核细胞中机械拉伸应力激活Piezo1,进而激活炎症小体来促进IL-1β的产生和成熟,从而介导炎症[18]。故此,进一步探究异常机械应力、Piezo1、焦亡和炎症之间的作用关系成为亟需解决的问题。
在骨科相关疾病中,通过Piezo1蛋白的信号转导,包括破骨细胞、成骨细胞、软骨细胞等在内的多种细胞,可以受到细胞外环境的机械刺激,进而影响细胞生命活动,包括增殖、分化、迁移和凋亡[19]。在另一项研究中发现机械拉伸激活Piezo1,促进髓核细胞中NLRP3炎性小体的活化,上调Caspase-1,产生IL-1β,Piezo1的沉默减少了机械拉伸引起的髓核细胞炎症[20]。
本研究首先采取腹腔巨噬细胞替代滑膜巨噬细胞的方式,因为受限于现有的技术,即使使用磁珠分选提取膝关节内滑膜巨噬细胞也显得十分困难,幸运的是目前这种替代方法获得了国际公认[4,20-21]。但是替代也意味着不是对滑膜巨噬细胞的直接观察,这也是笔者以后仍需努力的方向。其次,笔者选取24 h拉伸时间,是因为之前的研究显示分别在2、12、24、48 h进行拉伸,Piezo1表达量不是呈现绝对时间依赖性的,最高表达量出现在24 h[17,22]。笔者的研究表明在20%的周期性机械应力拉伸24 h下,应力拉伸组IL-1β和IL-18表达上升,而加入Piezo1抑制剂后炎症因子表达受到抑制。与此同时,蛋白水平上也验证了Piezo1激活了焦亡信号通路,而巨噬细胞Hoechst33342/PI双染验证了机械牵张应力下发生焦亡致使巨噬细胞膜遭受破坏,Piezo1抑制剂阻止了这一进程。检测到因细胞破裂导致释放大量LDH,线粒体活性氧的大量产生更进一步加重了焦亡。当然本研究也有不足之处,未进行基因及在体层次的观察和研究,未对焦亡及Piezo1的机制进行更深入的研究,未来仍需要继续努力。
