高产蛋白酶菌株的分离、鉴定及酶学性质研究
2021-08-05权淑静王秋菊解复红
冯 菲,权淑静,刘 丽,王秋菊,胡 虹,解复红*
(河南省科学院生物研究所有限责任公司,河南 郑州 450008)
蛋白酶是一类能催化蛋白质肽键水解的酶,广泛存在于动植物和微生物中[1-2]。蛋白酶作为最重要的工业酶之一,在饲料工业、酿酒酿造、制药工业、化妆品、洗涤剂、毛皮软化等领域中被广泛使用,目前蛋白酶占据了工业酶市场60%以上的份额[3-5]。与动植物蛋白酶相比,微生物发酵生产的蛋白酶具有生长快、产量高、耗时少、产酶量大,易于控制发酵条件,方便大规模生产,并通过基因操作提高酶活性等特点,因此在世界工业酶市场上,约2/3的商业蛋白酶来源于微生物[6]。此外,微生物资源的巨大多样性可以产生具有不同性质的蛋白酶,这为寻找不同领域所需的新蛋白酶提供了基础。
芽孢杆菌属是一类能产生芽孢,细胞呈杆状,单生、对生,有些细胞在生长过程中首尾相连,呈链状的革兰氏阳性细菌[7]。芽孢杆菌细胞产生的内生孢子使菌体能抵抗很多不利的生长条件(如高温、低温、高盐等)。芽孢杆菌对环境的适应能力很强,因此它们分布广泛,目前已经从土壤、水环境、食物、堆肥等生境中都分离出了芽孢杆菌,因此普通的培养基也能使芽孢杆菌快速生长并向环境中分泌大量的胞外酶。芽孢杆菌的已被广泛开发用于各种商业用途,特别是用于制造各种外源酶(如α-淀粉酶、纤维素酶、角蛋白酶、漆酶、脂肪酶、植酸酶、蛋白酶和木聚糖酶等)[8-15]。据估计,芽孢杆菌属酶约占总酶市场的50%[16]。
贝莱斯芽孢杆菌(Bacillus velezensis)是2005年由RUIZGARCIA等发现并命名的一种新的芽孢杆菌,为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的后期异型体,已经从河水、农作物土壤、鱼类肠道、植物组织、野牦牛牛粪等不同的基物中被分离到[17-18]。很多研究证明了贝莱斯芽胞杆菌具有植物促生功能和抗植物病原菌功能,是一种能在农业生产中发挥重要作用的菌种。贝莱斯芽孢杆菌的抗菌作用机理主要包括以下几种:产抗菌蛋白、脂肽类抗生素、由非核糖体多肽合成酶(non-ribosomalpeptidesynthetase,NRPS)和聚酮化合物(polyketides,PKS)合成的抗生素、诱导系统抗性;贝莱斯芽孢杆菌的促生功能主要基于菌种具有1-氨基环丙烷-1-羧酸脱氨酶(1-aminocyclopropane-1-carboxylic acid deaminase,ACCD)活性,能够分泌吲哚-3-乙酸(indole-3-acetic acid,IAA),促进植物生长[19]。但是,到目前为止,对于贝莱斯芽孢杆菌,除了知道其有对植物具有促生和抗病作用之外,对菌种其他方面的研究较少。
磷矿是一种特殊生境,高盐、干燥和寡营养,生活在其中的微生物就会进化出多样的代谢策略以适应这样的环境。基于此,本研究旨在从磷矿中分离微生物菌株,并从这些菌株中分离筛选高产蛋白酶菌株,对筛选出的菌株进行了分子生物学和生理生化鉴定,并研究了胞外蛋白酶的酶学性质,以期对其进行工业化应用提供帮助。
1 材料与方法
1.1 材料与试剂
蛋白胨、酵母粉(均为生化试剂):美国赛默飞世尔科技公司;API ZYM、API 20E 和API 20NE微生物鉴定试纸条:法国梅里埃生物科技公司;细菌基因组提取试剂盒:美国Omega Biotek 公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)StarMix:北京康润诚业生物科技有限公司;酸水解酪蛋白:索莱宝生物科技有限公司;其他试剂均为国产分析纯。
土壤样品:采自于云南滇池磷矿(包括海口磷矿、尖山磷矿和昆阳磷矿)。
初筛培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,脱脂奶粉10 g/L,琼脂15 g/L,pH 7.2。
复筛培养基:麦芽糖5 g/L,酸水解酪蛋白10 g/L,酵母粉5g/L,(NH4)2HPO40.1 g/L,MgSO40.1g/L,柠檬酸钠0.1 g/L,CaC120.05 g/L,FeC130.05 g/L,pH 7.2。
DL-二硫苏糖醇(DL-dithiothreitol,DTT)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、十二烷基硫酸纳(sodium dodecyl sulfate,SDS):北京索莱宝科技有限公司。
1.2 仪器与设备
Varioskan Flash多功能酶标仪:美国赛默飞世尔科技公司;ATB自动细菌鉴定仪:法国梅里埃生物科技公司;Tpersonal 聚合酶链式反应(PCR)仪:德国Biometra公司。
1.3 方法
1.3.1 高产蛋白酶菌株的分离及筛选
称取1 g磷矿样品重悬于100 mL灭菌生理盐水中,用生理盐水梯度稀释后取上清液涂布于筛选培养基平板中,30 ℃倒置培养,观察筛选平板上生长的单菌落的蛋白酶透明水解圈,并比较透明水解圈和菌落直径比。挑取比值大的菌落进行复筛。
于250 mL三角瓶中装50 mL复筛培养基,接种初筛得到的水解圈和菌落直径比相对比较大的菌株,30 ℃、180 r/min摇瓶培养4 d后,测上清液中蛋白酶的活力。筛选出一株产蛋白酶活力最高的菌株,进行进一步产酶研究。
1.3.2 菌株的鉴定
菌株的生理生化特征检测按照《常见细菌系统鉴定手册》[20]以及从梅里埃公司购买的API ZYM、API 20E和API 20NE试纸条,按照说明书进行检测。
菌株的分子生物学鉴定参照参考文献[21]的方法。使用脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取菌体DNA,引物:正向引物27F(5'-AGAGTTTGATCCTGGCTCAG-3'),反向引物1492R(5'-TACGGTTACCTTGTTACGACTT-3')。30 μL PCR扩增体系为:上游引物与下游引物各0.5 μL,DNA模板0.5 μL,加入超纯水13.5 μL,按照2×TaqPCR StarMix 说明书,加入2×Mix 15 μL。PCR扩增参数为:94 ℃预变性4 min;94 ℃变性0.5 min,56 ℃退火0.5 min,72 ℃延伸1 min,30 个循环;72 ℃末端延伸10 min。将目的片段送至华大基因科技股份有限公司测序。测序结果在美国国家生物信息中心(national center for biotechnology information,NCBI)网站,作基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,根据比对结果,用MEGA X软件包制作系统发育树。
1.3.3 测定方法
蛋白酶活力:按照国标GB/T 28715—2012《饲料添加剂酸性、中性蛋白酶活力的测定分光光度法》进行测定[22]。
酶活定义:在40 ℃、pH7.2条件下,1 min内水解酪蛋白产生相当于1 μg酚基氨基酸(以酪氨酸等同物表示)的酶量,为一个酶活单位,U。
1.3.4 蛋白酶的酶学性质研究
pH对蛋白酶活力的影响:用不同pH的缓冲液稀释酶液[甘氨酸-盐酸缓冲液(pH 2.0,pH 3.0),乙酸-乙酸钠缓冲液(pH 4.0,pH 5.0),磷酸氢二钠-磷酸二氢钠缓冲液(pH 6.0,pH 7.0,pH 8.0),甘氨酸-氢氧化钠缓冲液(pH 9.0,pH 10.0),碳酸氢钠-氢氧化钠缓冲液(pH 11.0)],在测定酶活时,将反应体系中1%酪蛋白用相应pH值的缓冲溶液溶解,测蛋白酶活力。蛋白酶的pH稳定性:将用不同pH的缓冲液稀释酶液在40 ℃水浴保温1 h,然后在40 ℃条件下测剩余蛋白酶的活力。以同组实验中蛋白酶活力最高的酶活定义为100%,计算相对酶活。
温度对蛋白酶活力的影响:按照蛋白酶活力测定的方法,分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃和80 ℃条件下测蛋白酶的活力,测定温度对蛋白酶活力的影响;蛋白酶的温度稳定性:先将酶液分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃和80 ℃温度条件下保温1 h,然后在40 ℃条件下测剩余蛋白酶的活力。
金属离子和化合物对蛋白酶活力的影响:在酶液中分别加入终浓度为1 mmol/L和10 mmol/L的不同金属离子溶液和化合物(Na+、Fe2+、Co2+、Ca2+、Mg2+、Ag+、Ba2+、Zn2+、Mn2+、K+、EDTA、PMSF、Tween80、DTT、SDS),4 ℃条件下保温30 min,然后按常规方法测蛋白酶的活力,设置对照组酶活为100%。
2 结果与分析
2.1 高产蛋白酶菌种筛选
从磷矿样品中分离到了细菌纯培养菌株500株,其中能产生蛋白酶透明圈的菌株98株。挑选10株水解圈(D)和菌落直径(d)比值(D/d)相对比较大的菌株进行复筛。10株菌(编号为PB1~PB10)产蛋白酶酶活的结果如表1所示。

表1 筛选菌株蛋白酶活力测定结果Table 1 Determination results of protease activity produced by screening strains
从表1可以看出,所选的10株菌经过培养,有5株菌产蛋白酶酶活大于150 U/mL,其中菌株PB5产蛋白酶酶活最高,为562.3 U/mL,因此选择菌株PB5进行后续研究。
2.2 菌株PB5的鉴定
菌株PB5的菌落形态见图1,生理生化特征见表2。

图1 菌株PB5的菌落形态Fig.1 Colony morphology of strain PB5
由图1可知,菌株PB5在LB平板上划线培养24 h,菌落为乳白色,菌落表面比较光滑,但边缘不光滑,菌落直径为1~6 mm。倒置光学显微镜下,细胞呈杆状,单细胞,或多细胞首尾相连呈链状。
由表2可知,菌株PB5呈革兰氏阳性菌,其生理生化特征符合芽孢杆菌属(Bacillus)特征。

表2 菌株PB5的生理生化特征Table 2 Physiobiochemical characteristics of strain PB5
以菌株PB5的基因组DNA为模板,通过PCR扩增得到菌株约1.5 kbp的16S rRNA基因,结果见图2。
图2 菌株PB5的16S rRNA基因序列PCR扩增产物电泳图Fig.2 Electrophoregram of PCR amplification products of 16S rRNA gene sequence of strain PB5
将基因测序结果在GenBank进行BLAST比对分析,结果菌株PB5 16S rRNA基因与Bacillus velezensisstrain 2630、Bacillus velezensisstrain JC-K3和Bacillus velezensisstrain FJ17-4等菌株的16SrRNA基因具有100%的相似度。用MEGA X软件分析相关菌株和菌株PB5的16S rRNA基因,构建进化树,结果如图3所示。

图3 基于16S rRNA基因序列菌株PB5的系统发育树Fig.3 Phylogenetic tree of strain PB5 based on 16S rRNA gene sequences
由图3可知,菌株PB5与3株Bacillus velezensis菌株形成一个分枝。综合菌株的形态特征、生理生化特征,鉴定菌株PB5为贝莱斯芽孢杆菌(Bacillus velezensis)。
2.3 菌株PB5产蛋白酶粗酶液的酶学性质
2.3.1 pH值对蛋白酶活力的影响
pH值对菌株PB5蛋白酶活力的影响如图4所示。
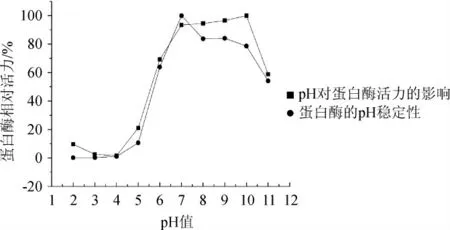
图4 pH值对菌株PB5产胞外蛋白酶活力的影响Fig.4 Effect of pH value on extracellular proteinase activity of strain PB5
由图4可知,pH值为10时,菌株PB5产胞外蛋白酶活力最高,当pH值<5时,相对酶活力<20%。因此,菌株PB5所分泌的胞外蛋白酶属于中性偏碱性蛋白酶。菌株PB5所产胞外蛋白酶在pH 7~10有比较好的pH稳定性,保持在78%以上,但当pH值<5时,相对酶活力<10%。可见菌株PB5所产蛋白酶对中性到碱性的环境下具有极好的耐受性,但对酸性环境,尤其是pH值低于4的酸性环境不耐受。
芽孢杆菌一般分泌两类胞外蛋白酶,一类是中性蛋白酶(neutral protease,NPR),一类是碱性蛋白酶(alkaline protease,APR)[23-25];可以预测,菌株在发酵过程中也会向胞外分泌这两类蛋白酶。
2.3.2 温度对蛋白酶活力的影响
温度对菌株PB5蛋白酶活力的影响如图5所示。
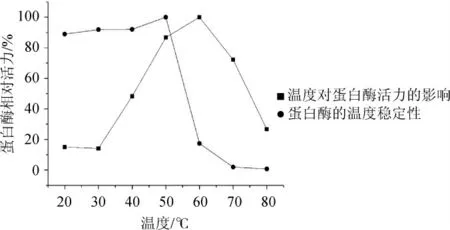
图5 温度对菌株PB5产胞外蛋白酶活力的影响Fig.5 Effect of temperature on extracellular proteinase activity of strain PB5
由图5可知,菌株PB5产胞外蛋白酶的最适反应温度为60 ℃,当温度低于30 ℃时,相对酶活<15%。当反应温度为20~50 ℃时,菌株的蛋白酶对温度的耐受性比较好,但当温度高于50 ℃时,酶活力下降很快。
2.3.3 金属离子和化合物对蛋白酶活力的影响
不同的金属离子和化合物对菌株PB5蛋白酶活力的影响如表3所示。

表3 金属离子和化合物对菌株PB5所产蛋白酶活力的影响Table 3 Effects of metal ions and compounds on the activity protease produced by strain PB5
由表3可知,Na+、Mg2+、Mn2+、K+对蛋白酶活力都有明显的促进作用;Co2+、Ca2+、Ba2+、Zn2+、DTT低浓度(1 mmol/L)时对蛋白酶活力有强烈的促进作用,但高浓度(10 mmol/L)时对蛋白酶活力有抑制作用;吐温80低浓度(1 mmol/L)时对蛋白酶活力有促进作用,但高浓度(10 mmol/L)时对蛋白酶活力作用效果不明显;Fe2+、Ag+、EDTA、PMSF、SDS对蛋白酶活力都有抑制作用。
3 结论
本研究从磷矿中分离筛选到一株高产蛋白酶菌株,经鉴定,该菌株为贝莱斯芽孢杆菌(Bacillus velezensis),该菌株产胞外蛋白酶活力为562.3 U/mL,胞外蛋白酶的最适pH值为10,在pH 7~10有较好的pH稳定性;最适温度为60 ℃,20~50 ℃时有较好的稳定性;Na+、Mg2+、Mn2+、K+对蛋白酶活力有明显的促进作用;Fe2+、Ag+、EDTA、PMSF、SDS对蛋白酶活力有明显抑制效果。
