新疆传统乳制品中产蛋白酶乳酸菌的筛选及产酶条件优化
2021-08-05金庭飞张凯莉
张 伟,金庭飞,黎 旭 *,张凯莉
(1.广东燕塘乳业股份有限公司,广东 广州 511356;2.广东益可维生物技术有限公司,广东 广州 510520;3.石河子大学 食品学院,新疆 石河子 832000)
乳酸菌(lactic acid bacteria)是一类可以发酵碳水化合物产生大量乳酸的无芽孢、革兰氏阳性菌的统称[1]。乳酸菌广泛存在于人体肠道中,并对人体具有重要的益生功能[2-3],包括维持肠道粘膜的屏障功能,调节免疫力,改善肠道炎症性疾病等。另外,乳酸菌被广泛应用于酸奶、奶酪、马奶酒[4]、果蔬汁及谷物发酵中[5]。乳酸菌含有丰富的蛋白水解酶系[6],是重要的蛋白酶生产来源之一,通过发酵所产生的蛋白酶可在食品加工中将蛋白质分解为功能多肽及游离氨基酸,起到提高食物消化效率、产生食品独特风味、生成功能性成分并进一步增加发酵底物附加值等作用[7]。另外,高产蛋白酶乳酸菌能够应用于皮革加工[8]、丝绸加工[9]、食品[10]、酿造[11]、医药[12]等方面。
产蛋白酶乳酸菌的筛选在国内外仍然有很高的研究价值;弹性蛋白酶可由动物胰脏提取或由微生物发酵制得,其可用于生产治疗高血脂症、防止动脉粥样硬化的药物[13],另外,弹性蛋白酶在肉的嫩化和动物蛋白质的水解等方面也有应用[14]。张兰等[15]采用酪蛋白平板法从鸡粪中筛选出一株短小芽孢杆菌,并对该菌所产蛋白酶酶学特性进行分析。于豪杰[16]采用发酵的方法对豆粕中大分子蛋白进行酶解处理,筛选出的产蛋白酶乳酸菌菌种有发酵乳杆菌、植物乳杆菌等。国外有研究表明[17],短乳杆菌产生的蛋白酶可以增强非洲山药豆的营养价值,并证明对白化病大鼠的生长和血液指标有改善作用。微生物生长中所需能量和构建细胞骨架所需原料主要由培养基中碳源提供,碳源不同,蛋白酶的活力也有所不同[18]。氮源主要为菌体的细胞结构以及菌体内的含氮代谢物(如核酸、氨基酸、蛋白质等)提供合成原料,氮源种类可以影响蛋白水解后的氨基酸回收率[19]。金属离子在蛋白酶生物催化过程中,可作为酶的辅因子或辅基产生作用,可以控制蛋白酶水解反应,有研究表明,不同金属离子对胰蛋白酶活性有影响[20]。磷酸盐能调节培养基的pH,培养环境的氢离子浓度可以影响蛋白酶的活性[21]。于宏伟等[22]筛选出了一株产中性蛋白酶的菌株,并对其产酶条件和酶学性质进行了初步研究,发现牛肉膏作为碳源时效果最好,其次是玉米粉和小麦淀粉,氮源的效果为玉米浆>豆饼粉>氯化铵>硝酸钾,金属离子中对酶有显著激活作用的为铁离子。方芳等[23]对产耐热蛋白酶乳酸菌的筛选和产酶特性进行了研究,发现乳酸菌在以葡萄糖为碳源,蛋白胨+牛肉膏+酵母粉为复合氮源,碳氮比为0.8,pH值为7.0的培养基下,筛选的乳酸菌具有最大产酶量,产酶量为13.13 U/mL,并指出K2HPO4、MgSO4有促进蛋白酶含量增加作用。
本研究采用福林-酚法与酪蛋白透明圈法对新疆传统乳制品中的乳酸菌进行分离筛选,结合菌株形态学观察及16S rDNA序列对菌株进行鉴定,并以蛋白酶活作为评价指标,以碳源、氮源、金属盐、磷酸盐的种类和添加量作为影响因素,通过单因素试验和正交试验优化高产蛋白酶乳酸菌的产酶条件。可为高产蛋白酶乳酸菌的应用提供参考与支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新疆少数民族传统乳制品(奶疙瘩、酸牛奶、非蒸馏型马奶酒)样品:奶疙瘩采自新疆伊犁地区;酸牛奶采自新疆石河子市南山牧场;马奶酒采自新疆塔城地区额敏县。
1.1.2 化学试剂
F8060福林酚(分析纯):北京索莱宝科技有限公司;三氯乙酸(分析纯):美国Sigma-Aldrich公司;酪蛋白标准品(纯度>98%):德国默克公司;DP302脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.1.3 培养基
菌种筛选固体培养基:南京信帆生物技术有限公司;MRS培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
5810R离心机:德国艾本德公司;Alpha1500紫外分光光度计:上海谱元仪器有限公司;ZXSD-1160全自动生化培养箱:上海智诚仪器有限公司;BX43显微镜:日本奥林巴斯公司;T-100型聚合酶链式反应(polymerase chain reaction,PCR)仪、Mini-SubCell核酸电泳仪:美国Bio Rad公司。
1.3 方法
1.3.1 乳酸菌的富集与分离
取约1 g奶疙瘩中部样品于生理盐水中37 ℃浸泡软化,移液器吹打均匀并进行100倍稀释,采用划线法蘸取稀释样品液进行划线分离培养;酸牛奶、马奶酒样本旋涡混匀后各取1 mL进行梯度稀释,取合适梯度,采用倾注法进行培养,获得单菌落。
培养完成后观察菌落形态,挑取形态学特征不同的单菌落进行多次培养划线,直至镜检视野下菌株形态一致,从而得到纯化的菌株。将纯化后的乳酸菌接种至液体MRS培养基中在37℃培养18h至对数生长期后,进行甘油管保藏。
1.3.2 产蛋白酶乳酸菌的复筛
取保藏的菌株甘油管,按2%接种量接种于MRS液体培养基,培养16~18 h,3 500×g、4 ℃离心10 min,得到菌泥后用生理盐水再次重悬获得菌悬液,将菌悬液按2%接种于50 mL发酵培养基,35 ℃诱导培养48 h后,取500 μL菌液(108CFU/mL)离心(3 500×g、4 ℃)10 min,取离心后的10 μL上清液加入牛津杯中,在脱脂牛乳琼脂培养基35 ℃培养24 h,当培养基中的酪蛋白被微生物分泌的蛋白酶分解后,在牛津杯的周围形成透明圈,挑选HE值较大的菌株进行后续试验,测定透明圈的HE值,其计算公式如下:
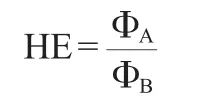
式中:ΦA为透明圈直径,mm;ΦB为菌落直径,mm。
1.3.3 目标菌株的筛选
采用福林-酚法测定蛋白酶活性。研究表明[24-25]透明圈直径大小以及透明圈与菌落直径的比值与蛋白酶活力高低无显著正相关,蛋白酶水解酪蛋白,其产物酪氨酸能在碱性条件下使福林-酚试剂还原,生成组蓝与钨蓝,以比色法在波长680 nm处测定OD680nm值,每个样品做3次平行。乳酸菌于35 ℃的温度下在液体发酵培养基上培养48 h后,将1 mL发酵液离心,所收集的上清液即为粗酶液,测定蛋白酶活性。
蛋白酶活力定义:1 g 酶粉或1 mL酶液,在40 ℃、pH=7.2条件下,每分钟水解酪蛋白产生1 μg酪氨酸所需酶量为1个酶活力单位(U/mL)。
1.3.4 菌株的形态学观察及分子生物学鉴定
将分离纯化获得的菌接种在MRS平板上充分培养,待菌落形态成型时,观察其单个菌落的形状、颜色、光滑度、透明度及边缘整齐度。从MRS培养基挑选出的过氧化氢阴性菌经革兰染色后,若细胞在显微镜下呈蓝紫色,则为乳酸菌,若呈红色,则将其排除。
乳酸菌DNA的提取:本试验采用试剂盒法对乳酸菌菌株中的DNA进行了提取,具体提取步骤按照生产商说明书进行。
PCR扩增:乳酸菌使用引物27F和1492R[26],PCR扩增体系均为50μL,先加入引物及菌株DNA各2.0μL,然后加入25μL的2×TaqMaster Mix(Dye Plus)和19 μL的双蒸水(ddH2O)摇匀后进行PCR扩增,扩增时步骤参考TARTORY等[27]的方法。
PCR产物检测:取5 μL的PCR扩增产物加入到1%的琼脂糖凝胶[28](含0.01%的goldview Ⅱ染料)孔中,将电泳仪的电压和电流分别设置为100 V和90 mA,在1×TAE 电泳缓冲液中电泳40 min,待条带跑至距胶孔另一端1/3处,即可将胶板取出用凝胶成像仪进行观察。
菌株序列比对及系统发育树的构建:在测序公司完成测序后,将所得的16Sr DNA序列提交到美国国家生物技术信息中心(national center of biotechnology information,NCBI)Gen Bank数据库中与标准菌序列进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,并构建系统发育树[29]。
1.3.5 乳酸菌产酶条件优化
(1)单因素试验
碳源及最佳碳源添加量对菌株产蛋白酶活力影响:在发酵培养基中添加1%[30]的碳源(葡萄糖、蔗糖、D-果糖、低聚半乳糖、可溶性淀粉),最佳碳源添加量(1.0%、2.0%、4.0%),将筛选出来的目标菌株在35 ℃培养24 h,测定蛋白酶活力。
氮源及最佳氮源添加量对菌株产蛋白酶活力影响:在发酵培养基中添加1%的氮源(蛋白胨、牛肉膏、硝酸钾、硫酸铵、柠檬酸三铵),最佳氮源添加量(1.0%、2.0%、4.0%),测定蛋白酶活力。
金属盐及最佳金属盐添加量对菌株产蛋白酶活力影响:在发酵培养基中添加0.01%的金属盐(NaCl、CuSO4·7H2O、BaCl2、MgSO4·7H2O、MnSO4),最佳金属盐添加量(0.01%、0.02%、0.04%),测定蛋白酶活力。
磷酸盐及最佳磷酸盐添加量对菌株产蛋白酶活力影响:在发酵培养基中添加0.5%的磷酸盐(K2HPO4、KH2PO4、Na2HPO4、NaH2PO4),最佳磷酸盐添加量(0.5%、0.7%、0.9%),同上条件培养,测定蛋白酶活力。
(2)正交试验
在单因素试验基础上,以蛋白酶酶活为评价指标,分别选取葡萄糖添加量(A)、牛肉膏添加量(B)、MgSO4·7H2O添加量(C)、K2HPO4添加量(D)添加量为影响因素,采用L9(34)正交试验设计,优化菌株产酶条件。正交试验因素与水平见表1。
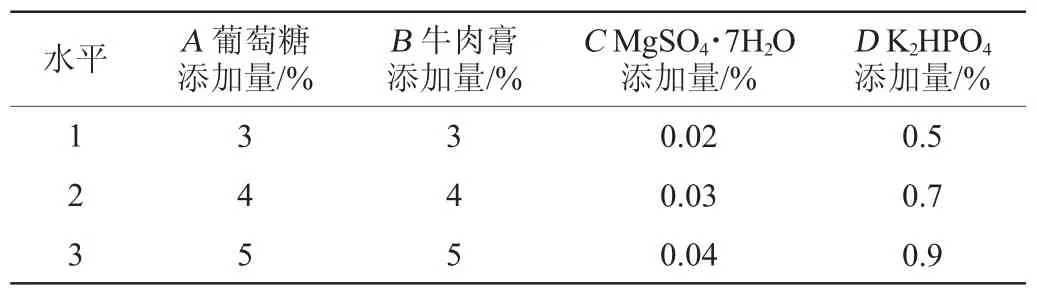
表1 产蛋白酶条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for proteaseproducing conditions optimization
1.3.6 数据处理
使用Origin 2017作图,利用SPSS 25.0进行差异性分析;实验数据均进行3次平行,以平均值±标准偏差表示。数据分析过程中,当P<0.05,表示具有显著性差异。
2 结果与分析
2.1 产蛋白酶乳酸菌的分离与初筛
以菌落透明圈直径作为依据对菌株进行初筛,筛选菌株的菌落形态及透明圈直径见表2。由表2可知,16株菌有10株菌产蛋白酶。
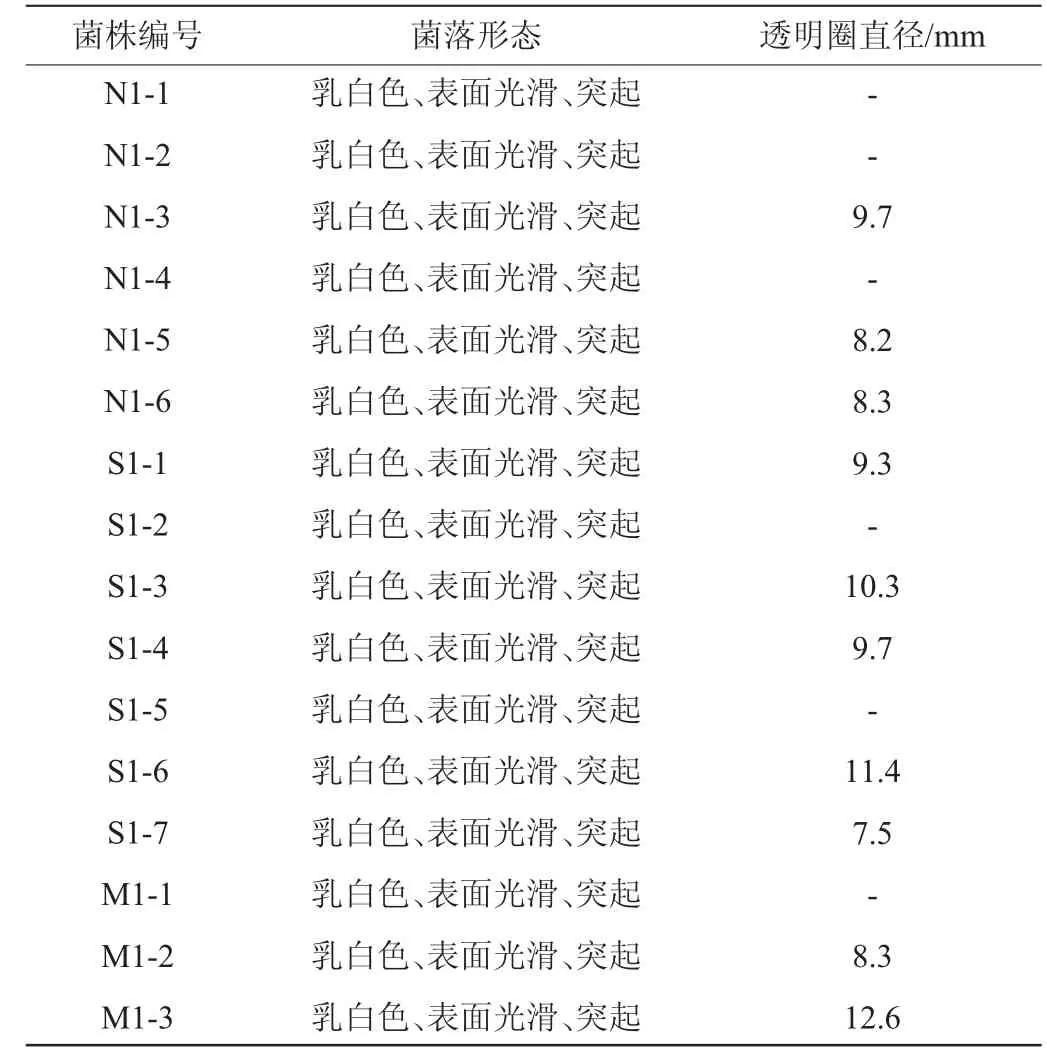
表2 产蛋白酶菌株的菌落形态及透明水解圈直径Table 2 Colony morphology and hydrolysis circle of protease-producing strains
将初筛的16株乳酸菌菌株接种于脱脂牛乳培养基后,测定其透明圈直径。将透明圈直径与菌落直径之比较大的菌株定义为目标菌株,最终得到4株菌株,编号为A1~A4,4株菌的脱脂牛乳平板培养基透明圈见图1。测量各菌株的HE值大小,依次排序为A2>A4>A3>A1。
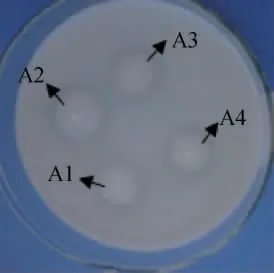
图1 脱脂牛乳平板培养基上筛选菌株的透明圈Fig.1 Transparent circle of screened strains on the skimmed milk plate medium
2.2 产蛋白酶乳酸菌的复筛
初筛获得的菌株产蛋白酶酶活力值结果见表3。不同菌株所产蛋白酶活性存在显著差异(P<0.05),其中菌株A2的蛋白酶活力最高,为14.85 U/mL。因此,挑选菌株A2进行后续试验。
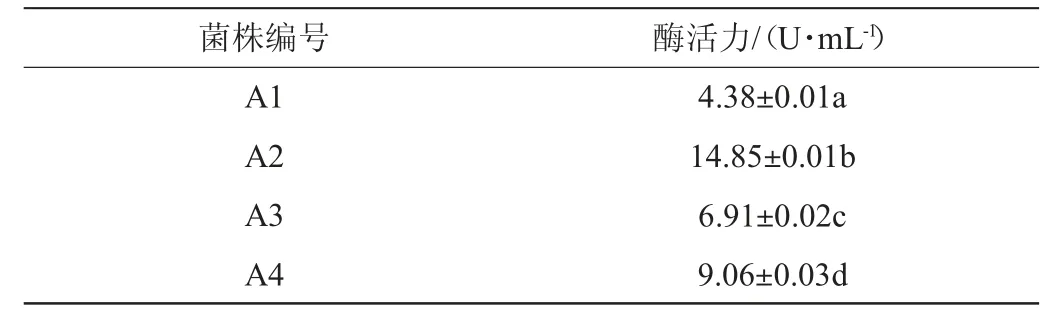
表3 筛选菌株产蛋白酶酶活测定结果Table 3 Determination results of enzyme activities of screened strains
2.3 产蛋白酶乳酸菌的菌种鉴定
2.3.1 菌株形态学观察结果
对初步筛选得到的4株菌进行划线培养,4株菌的菌落与菌体形态见图2。

图2 筛选菌株的菌落(A)与菌体形态(B)Fig.2 Colony (A) and cell (B) morphologies of screened strains
由图2A可知,菌落表面光滑,颜色为乳白色,表面光滑、突起。由图2B可知,4株菌的革兰氏染色均为阳性,菌株A1、A4细胞形态为球菌,菌株A2、A3细胞形态为杆状或短棒状。
2.3.2 分子生物学鉴定
对筛选出来的4株菌使用MEGA7软件构建系统发育树,结果见图3。

图3 基于16S rDNA序列筛选菌株的系统发育树Fig.3 Phylogenetic tree of screened strains based on 16S rDNA sequence
由图3可知,菌株A2与发酵乳杆菌(Lactobacillus fermentum),菌株A1、A3、A4分别与戊糖片球菌(Peciococcus pentosaceus)、短乳杆菌(Lactobacillxus brevis)、乳酸明串珠菌(Leuconostoc lactis)的同源性为100%。因此,菌株A1、A2、A3、A4分别被鉴定为戊糖片球菌(Peciococcus pentosaceus)、发酵乳杆菌(Lactobacillus fermentum)、短乳杆菌(Lactobacillxus brevis)、乳酸明串珠菌(Leuconostoc lactis)。
2.4 菌株A2产酶条件优化单因素试验
2.4.1 不同碳源对菌株A2产蛋白酶的影响
考察不同种类碳源在不同添加量下对A2菌株发酵产蛋白酶活力的影响,结果如表4所示,3个不同添加量下,葡萄糖均为最佳碳源,蛋白酶活力随添加量的增加而增加;以4%葡萄糖作为碳源时,蛋白酶活力最高,酶活力值达到16.25 U/mL。而乳酸菌对低聚半乳糖的利用率最低,蛋白酶活仅为6.17 U/mL。D-果糖和可溶性淀粉对蛋白酶活的影响较为相近。因此,选择最佳碳源添加量为4%葡萄糖。
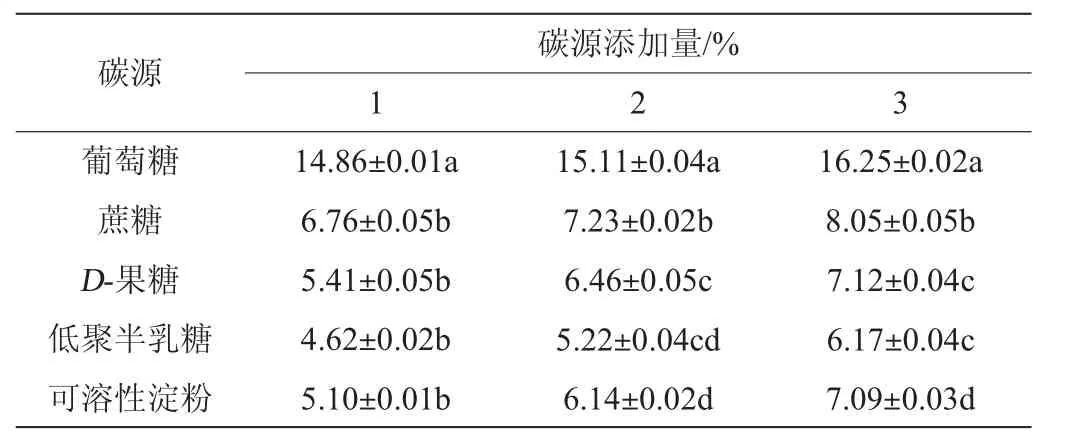
表4 不同碳源对乳酸菌A2产蛋白酶活力的影响Table 4 Effect of different carbon sources on protease activity produced by strain A2 U/mL
2.4.2 氮源对乳酸菌A2产蛋白酶的影响
以蔗糖作为碳源,测定菌株A2在1%氮源(牛肉膏、蛋白胨、柠檬酸三铵、硝酸钾、硫酸铵)下发酵产蛋白酶活力,结果见表5。由表5可知,牛肉膏在4%添加量条件下,菌株A2产生的蛋白酶活力最高,可达到16.98 U/mL,并且随着牛肉膏添加量的上升,酶活力不再上升。因此,最佳碳源添加量为4%牛肉膏。
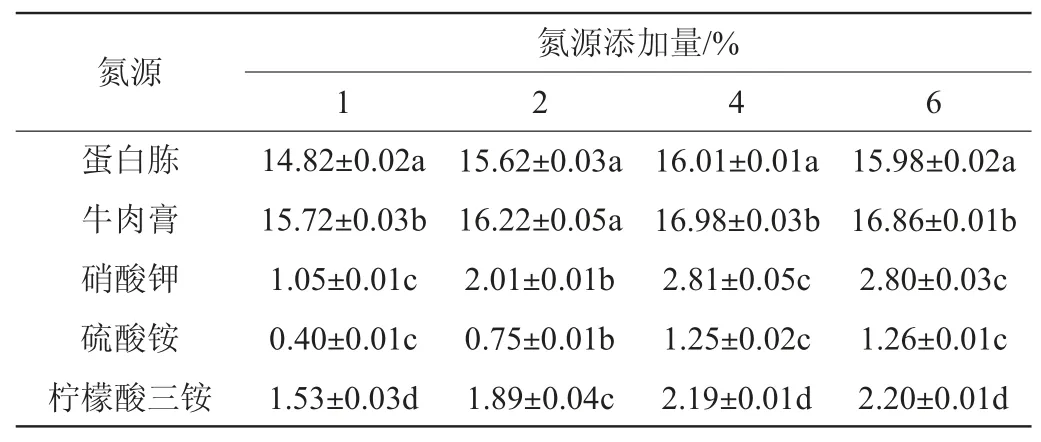
表5 不同氮源对菌株A2产蛋白酶活力的影响Table 5 Effect of different nitrogen sources on protease activity produced by strain A2 U/mL
2.4.3 金属盐对乳酸菌A2产蛋白酶的影响
以蔗糖为碳源,以蛋白胨为氮源,加入含量为0.01%的5种金属盐,考察对蛋白酶活力的影响,结果见表6。由表6可知,金属盐MgSO4·7H2O添加量为0.02%时,蛋白酶活力最大,为14.98 U/mL。且蛋白酶活力依次为MgSO4·7H2O>BaCl2>CuSO4·7H2O>MnSO4>NaCl,显示出镁离子在菌株A2代谢蛋白酶过程中起到关键作用。因此,最佳金属盐MgSO4·7H2O添加量为0.02%。
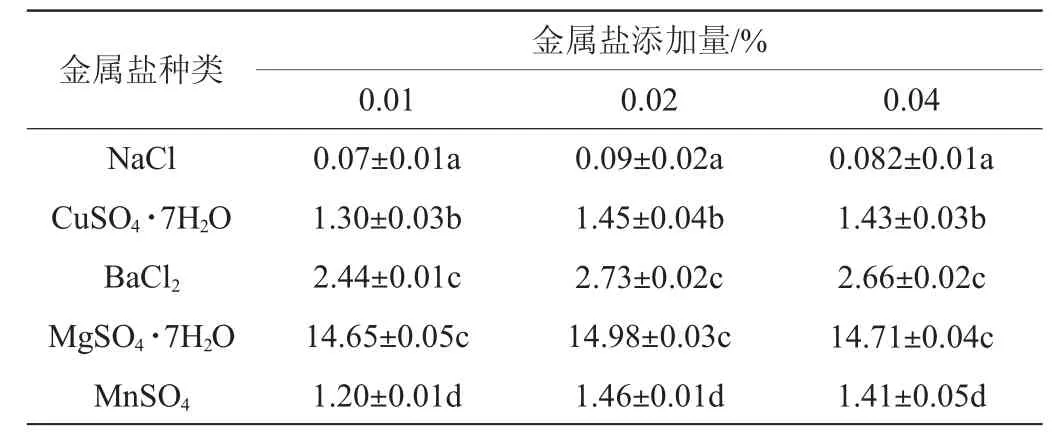
表6 不同金属盐对乳酸菌A2产蛋白酶活力的影响Table 6 Effect of different metal salts on protease activity produced by strain A2 U/mL
2.4.4 磷酸盐对乳酸菌A2产蛋白酶的影响
以蔗糖为碳源,以蛋白胨为氮源,MgSO4·7H2O为金属盐,结果见表7。由表7可知,添加K2HPO4时菌株A2产蛋白酶活力最大,不同添加量比较下,K2HPO4添加量为0.7%时所有组的蛋白酶活力最高,磷酸盐排序为:K2HPO4>Na2HPO4>KH2PO4>NaH2PO4。因此,最佳磷酸盐K2HPO4添加量为0.7%。
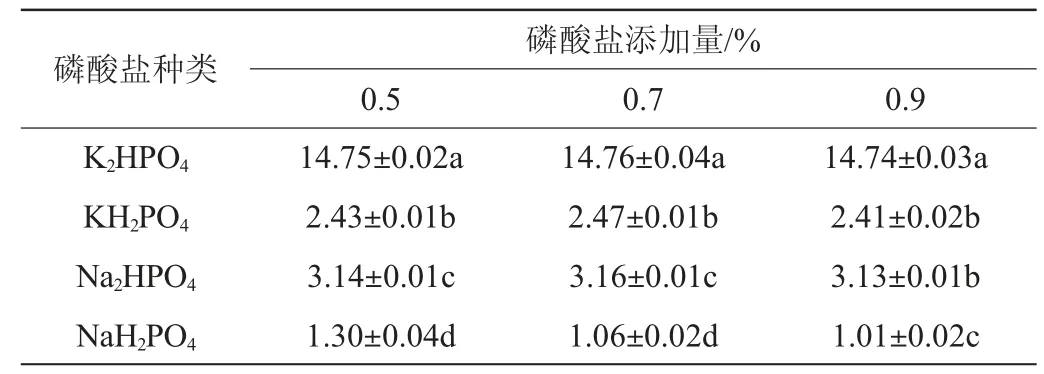
表7 不同磷酸盐对产蛋白酶活力的影响Table 7 Effect of different phosphates on protease activity produced by strain A2 U/mL
2.5 产酶条件优化正交试验
在单因素试验基础上,以蛋白酶酶活为评价指标,分别选取葡萄糖添加量(A)、牛肉膏添加量(B)、MgSO4·7H2O添加量(C)、K2HPO4添加量(D)为考察因素,采用L9(34)正交试验设计,优化菌株A2产酶条件。正交试验结果与分析见表8,方差分析结果见表9。
由表8可知,各因素对产蛋白酶影响顺序为B>A>D>C,即牛肉膏添加量>葡萄糖添加量>K2HPO4添加量>MgSO4·7H2O添加量,最优产酶条件组合为A2B2C1D2,即葡萄糖添加量4%、牛肉膏添加量4%、MgSO4·7H2O添加量0.02%、K2HPO4添加量0.7%。在此优化条件下进行3次平行验证试验,菌株A2产蛋白酶最高为65.92 U/mL。由表9可知,4种因素对蛋白酶活的影响均极显著(P<0.01)。
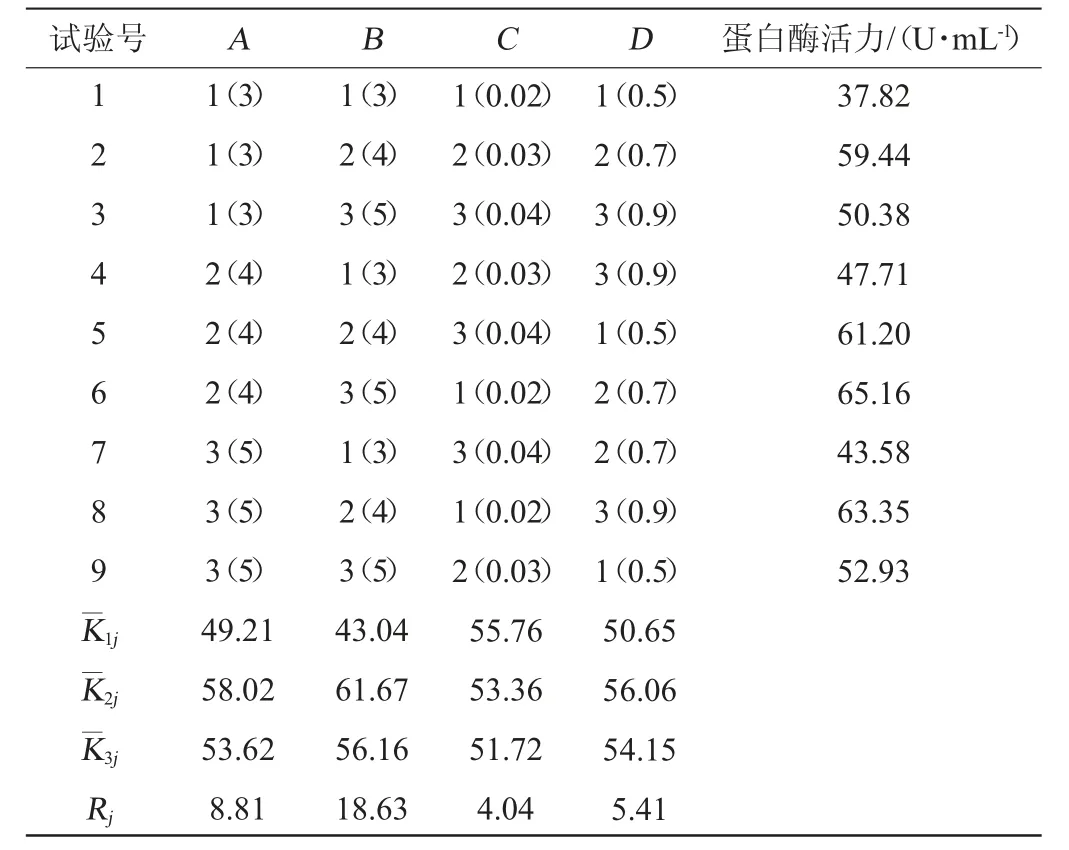
表8 产酶条件优化正交试验结果与分析Table 8 Results and analysis of orthogonal tests for enzymatic production conditions optimization
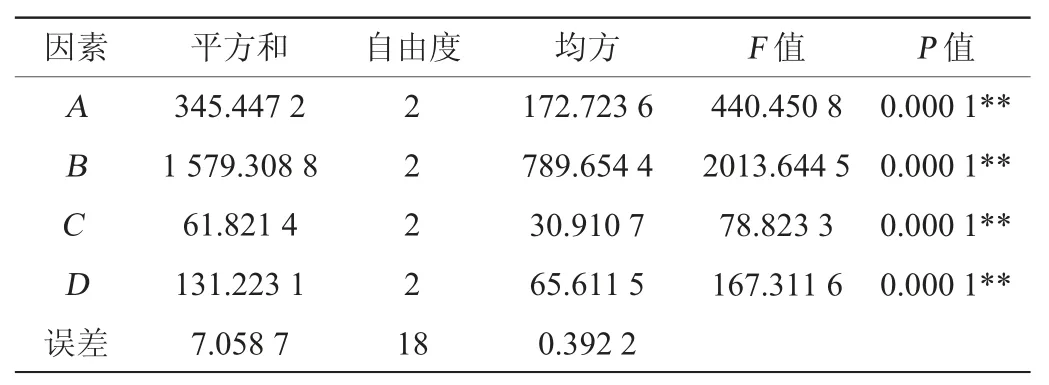
表9 正交试验结果方差分析Table 9 Variance analysis of orthogonal tests results
3 结论
本研究通过初筛与复筛,从传统乳制品中筛选出产蛋白酶活力好的菌株4株,(编号为A1~A4),分别被鉴定为戊糖片球菌(Peciococcus pentosaceus)、发酵乳杆菌(Lactobacillus fermentum)、短乳杆菌(Lactobacillxus brevis)、乳酸明串珠菌(Leuconostoc lactis)。在以4.0%葡萄糖为碳源、4.0%牛肉膏为氮源、0.02%的镁离子为金属盐、0.7%的K2HPO4为磷酸盐的条件下,菌株A2产蛋白酶活最高为65.92 U/mL。
