基于网络药理学的柴胡疏肝散治疗失眠作用机制探讨△
2021-08-05唐秀松陈静方刚黄安陈炜
唐秀松,陈静,方刚,黄安,陈炜
1.广西中医药大学 广西壮医应用基础研究重点应验室,广西 南宁 530200;2.广西中医药大学 第一附属医院,广西 南宁 530023
失眠(insomnia)是睡眠障碍中的一种常见类型,主要表现为入睡困难、睡眠维持障碍、早醒、睡眠质量下降和总睡眠时间减少,同时伴日间功能障碍。失眠具有高患病率、高复发率、病情反复难愈等特点[1]。长期失眠不仅会影响人们正常的工作和生活,还会增加罹患各种疾病的风险,甚至可能引发恶性意外事故。目前临床治疗失眠药物主要包括苯二氮卓类受体激动剂、褪黑素受体激动剂、食欲素受体拮抗剂和具有催眠效应的抗抑郁药物。其中以苯二氮卓类为主,该类药物起效快,能帮助患者快速入睡,但其具有成瘾性、撤药困难、不良反应大、远期效果不显著等不足。非药物治疗方法有睡眠教育、认知治疗、行为治疗、音乐治疗等[2]。自古以来,中医学对于失眠的治疗具有专方专药,如酸枣仁汤、黄连阿胶汤、交泰丸等。在结合辨证论治、三因制宜的基础上,开立的处方往往能取得不错的疗效,并且具有不良反应小、停药容易、疗效稳定的优点。
柴胡疏肝散记载于《景岳全书·古方八阵·散阵》[3],该方由柴胡、香附、川芎、陈皮、枳壳、白芍、甘草组成,具有奏疏肝行气、活血止痛之功,常用于治疗肝郁气滞的病症,如慢性肝炎和胃炎、肋间神经痛、失眠、焦虑抑郁症、斑秃、妇科和男科疾病等[4]。现代药理研究表明,柴胡疏肝散能上调围绝经期综合征肝郁证大鼠、阿尔茨海默病大鼠和抑郁模型大鼠海马组织的5-羟色胺、去甲肾上腺素和多巴胺水平,改善学习记忆能力和抑郁状态[5-7];上调脑源性神经营养因子及其受体酪氨酸激酶受体B mRNA水平[8];增加肝郁大鼠海马磷酸二酯酶-4及其亚型的mRNA的表达[9];调节内分泌[包括下丘脑-垂体-肾上腺(HPA)轴、下丘脑-垂体-甲状腺素(HPT)轴、下丘脑-垂体-卵巢(HPO)轴][10-12];提高免疫力[13-15];抗氧化[16-17]等。大量临床研究表明[18-24],单独的柴胡疏肝散或柴胡疏肝散联合其他药物治疗肝郁气滞型的失眠疗效显著,但未明确指出该方治疗失眠的作用机制。
网络药理学主要以“药物-靶点-疾病”相互作用网络为特征,其系统性的研究与中医学的“整体观念”一致[25]。本研究采用网络药理学方法,深入探讨该方治疗失眠的作用机制,以期为其临床应用及后续实验研究提供参考。
1 材料与方法
1.1 柴胡疏肝散药物有效成分的筛选及相关靶点的收集
通过中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)分别输入柴胡疏肝散中7味中药名称,即柴胡、香附、川芎、陈皮、枳壳、白芍、甘草,搜索7味中药有效成分,通过口服生物利用度(OB)≥30%、类药性(DL)≥0.18进行筛选。同时在TCMSP平台Relate Targets栏目中直接收集柴胡疏肝散中7味中药的相关靶点。
1.2 柴胡疏肝散靶点基因注释
应用UniProt蛋白数据库(https://www.uniprot. org/)和Perl 5.26.3软件(https://www.perl.org/get.html)对获取的柴胡疏肝散所有相关靶点进行注释,获得柴胡疏肝散对应的相关基因,以备后序分析。
1.3 失眠相关疾病靶点获取
以“insomnia”作为关键词,在GeneCards数据库(https://genealacart.genecards.org/)和OMIM数据库(https://www.omim.org/)进行检索,并下载失眠的疾病靶点,综合后去除其中的重复靶点,最终得到失眠疾病相关靶点。
1.4 绘制韦恩图
运用R 3.6.3软件(https://www.r-project.org/)中的VennDiagram程序包对获得的柴胡疏肝散药物靶点和失眠疾病靶点进行分析处理,最终得到药物与疾病之间的共同靶点,并绘制韦恩图。
1.5 成分-靶点网络构建
利用Cytoscape 3.7.2软件(https://cytoscape.org/)对所获得的柴胡疏肝散有效成分、交集靶点进行计算分析,构建柴胡疏肝散有效成分-失眠调控网络。
1.6 蛋白质-蛋白质相互作用(PPI)网络构建
将柴胡疏肝散与失眠的交集靶点导入STRING 11.0(https://string-db.org/)网站,限定研究物种为“Homo sapiens”,将网络中无关或游离蛋白去掉,余参数按照默认设定值,最终得到柴胡疏肝散治疗失眠的PPI网络。
1.7 PPI网络核心蛋白生物功能注释分析
将获得的PPI网络中的核心蛋白导入功能注释(functional annotation)工具DAVID(https://david. ncifcrf. gov/),限定研究物种为人类(Homo sapiens),选择基因本体(GO)分析下的分子功能(MF)、生物过程(BP)和细胞组成(CC)部分进行GO富集分析,选择Pathway分析中京都基因与基因组百科全书(KEGG)通路分析,设定P<0.01,进一步寻找有效成分靶点显著富集的主要功能与体内通路,最后利用Cytoscape 3.7.2软件clue GO插件绘制条形图展示富集结果。
1.8 KEGG-PPI网络核心蛋白关系网络构建
利用KEGG数据库中的KEGG Mapper工具,将前述方法所得的核心蛋白对应的UniProt ID导入其中,并限定研究物种为“Homo spiens”,获得柴胡疏肝散治疗失眠的作用通路,筛选与上述靶点有关的通路,整合得到最终的通路。并利用Cytoscape 3.7.2构建KEGG-PPI网络核心蛋白关系网络。
2 结果
2.1 柴胡疏肝散活性成分筛选结果
结果显示,共得到柴胡疏肝散157个有效成分,8488个潜在靶点,去除重复的靶点后共获得240个药物相关靶点。因柴胡疏肝散有效成分较多,只展示OB≥60%的活性成分(表1)。

表1 柴胡疏肝散活性成分(OB≥60%)

续表1
2.2 失眠疾病靶点及交集靶点筛选
在GeneCards数据库中搜集到失眠的疾病靶点有2280个,在OMIM中得到失眠的疾病靶点3个。通过R软件分析柴胡疏肝散药物靶点240个与失眠疾病靶点2283个,得到药物-疾病共同靶点91个,绘制韦恩图(图1)。
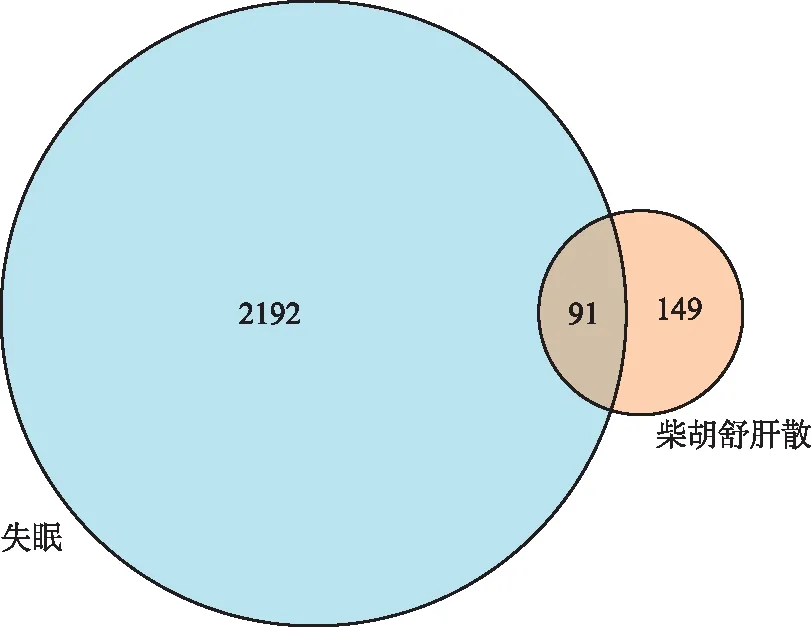
图1 柴胡疏肝散与失眠交集靶点韦恩图
2.3 成分-靶点网络构建
通过Cytoscape 3.7.2软件进行计算分析,得到柴胡疏肝散有效成分-失眠疾病靶点的调控网络图(图2)。

注:正方形代表药物有效成分,其中绿色为柴胡,灰色为陈皮,深紫色为甘草,深蓝色为白芍,浅绿色为香附,紫色为枳壳,黄色为共有的成分;棕色三角形代表柴胡疏肝散与失眠的91个交集基因。图2 柴胡疏肝散治疗失眠的成分-靶点网络
2.4 PPI网络构建
通过借助STRING在线网站,按照网站默认设置参数值,对柴胡疏肝散与失眠的交集靶点进行分析,得到PPI网络(图3)。其中作用强度排名前30位的核心靶点见图4,包括白细胞介素-6(IL-6)、蛋白激酶B1(Akt1)、血管内皮生长因子A(VEGFA)、Fos、过氧化氢酶(CAT)、环磷酸腺苷(cAMP)反应元件结合蛋白1(CREB1)等。

图3 柴胡疏肝散-失眠PPI网络

图4 柴胡疏肝散-失眠PPI网络核心靶点
2.5 GO富集分析
GO功能富集分析结果显示,BP、CC和MF相关条目分别为1624、62、97条。根据P值排序,每个模块展示前20位的条目(图5)。其中BP主要涉及对脂多糖的反应、对细菌来源分子的反应、对金属离子的响应、循环系统中的血管过程、应答辐射、对抗生素的反应等。CC主要包括突触后膜的组成成分、突触后膜固有成分、突触膜的组成成分、突触膜内成分、突触前膜的组成成分、脂筏、膜微区、膜区、突触前膜固有成分、突触前膜等。MF主要集中在肾上腺素能受体活性、儿茶酚胺结合、G蛋白偶联胺受体活性、铵离子结合、血红素结合、四吡咯结合、RNA聚合酶Ⅱ转录因子结合、神经递质受体活性、多巴胺结合、细胞因子活性等。

图5 柴胡疏肝散-失眠PPI网络核心蛋白GO功能分析
2.6 KEGG富集分析
KEGG通路富集分析得到103条通路,主要包括糖基化终产物及其受体(AGE-RAGE)信号通路、流体剪切应力与动脉粥样硬化、肿瘤坏死因子(TNF)信号通路、前列腺癌通路、卡波西肉瘤相关疱疹病毒感染通路、内分泌抵抗通路、多巴胺能突触、IL-17信号通路、催乳素信号通路等。根据P值大小,排列前20位的通路见图6。

图6 柴胡疏肝散-失眠PPI网络核心蛋白KEGG功能富集分析
2.7 KEGG-PPI网络核心蛋白关系
KEGG-PPI网络核心蛋白关系网络(图7、表2)中包括20条通路和富集在这些通路上的55个蛋白。从图中可知,与IL-6、Akt1、MAPK14、VEGFA、Fos等靶点相连的通路较多。hsa04933、hsa05418、hsa04668、hsa05167等通路上相关联的靶点较多。

注:紫色椭圆形表示通路;黄色三角形表示靶点;图形越大,说明邻接节点数目越多。图7 KEGG-PPI网络核心蛋白关系网络

表2 KEGG-PPI网络核心蛋白关系网络信息
3 讨论
失眠在中医属于“不寐”“不得眠”“目不瞑”“不得卧”等范畴,病位在心,与肝脾肾相关,基本病机为阳不入阴。失眠的病因很多,涉及肝阳扰动、思虑过度、内伤心脾、阳不交阴、阴虚火旺、心肾不交等[26]。医者常四诊合参,进行辨证施治。
柴胡疏肝散由柴胡、香附、川芎、陈皮、枳壳、白芍、甘草7味药组成。君药柴胡主要化学成分柴胡皂苷具有镇静、解热、提高免疫、抗炎、抗病毒、护肝、抗肿瘤等作用[27]。柴胡皂苷能够使猫的慢波睡眠Ⅱ期和快动眼睡眠期显著增加,睡眠时间延长[28-30]。白芍提取物白芍总苷可延长正常大鼠慢波睡眠的持续时间,使失眠大鼠的睡眠参数恢复正常[31]。文献报道,香附挥发油对促硝西泮、苯二氮类药物有明显的促透皮作用[32-33]。香附挥发油可能是通过平衡中枢胆碱能系统上调5-羟色胺水平,改善焦虑小鼠的症状[34]。枳壳提取物具有抗抑郁的作用[35-36]。炙甘草中含有较多的甘草总黄酮、甘草苷,常被用于抑郁症的治疗[37]。甘草黄酮提取物可通过抑制皮质醇升高、调节HPA轴起到预防和治疗抑郁症[38]。该方各药均对睡眠有一定的改善作用。
柴胡疏肝散治疗失眠的成分-靶点网络显示,IL-6、Akt1、VEGFA、Fos、CAT可能为柴胡疏肝散治疗失眠的核心靶点。研究表明,失眠与炎性因子表达上升密切相关,当人体睡眠被剥夺后,炎性反应因子水平直线增高[39]。增高的时间以下午至睡前明显,其中IL-6的水平与睡眠觉醒时间呈正比,与非快速眼动相睡眠和睡眠质量呈反比[40]。作为炎症反应根源的白细胞介素类细胞因子会造成越来越多的炎性介质释放,破坏正常的睡眠节律,最终出现失眠[41]。而且由细胞因子组成的神经递质免疫系统可通过扰乱血液、神经等的正常状态,进而影响睡眠质量[42]。睡眠障碍的治疗效果及预后的评估可通过监测血清IL-6、TNF-α和IL-1β水平,这些因子会通过不同途径影响睡眠进程[43]。应用疏肝解郁法治疗肝郁型围绝经期失眠女性患者,结果表明,治疗后患者的IL-6水平下调,睡眠质量提高[44]。肝郁分级与Akt蛋白及mRNA水平呈中度正相关,围绝经期妇女非器质性失眠可能是由磷脂酰肌醇3-激酶(PI3K)/Akt信号通路介导的,应用PI3K/Akt信号通路抑制剂治疗是该类疾病今后研究的方向[45]。VEGFA基因在致死性家族失眠症(FFI)患者脑组织基因表达谱中是上调的基因[46]。Fos又称c-Fos,是一种原癌基因,参与细胞生长、分化、信息传递及动物的学习和记忆和维持的清醒。褪黑素能有效调节大鼠的昼夜节律,改善睡眠质量[47-48]。哺乳动物视交叉上核中c-Fos基因的表达水平与年龄呈负相关,可反映睡眠质量和昼夜节律,是昼夜节律的关键基因,睡眠被剥夺后c-Fos基因表达会增加[49-52]。
PPI结果显示,柴胡疏肝散抗失眠的关键蛋白包括IL-6、Akt1、VEGFA、Fos、CAT、CREB1等,这些关键靶点参与脂多糖的反应、对细菌来源分子的反应、突触膜的组成成分、突触膜内成分、突触前膜的组成成分、脂筏、膜微区、膜区、肾上腺素能受体活性、儿茶酚胺结合、G蛋白偶联胺受体活性、铵离子结合、RNA聚合酶Ⅱ转录因子结合、神经递质受体活性、多巴胺结合、细胞因子活性等生物学过程,参与AGE-RAGE信号通路、流体剪切应力与动脉粥样硬化通路、TNF信号通路、前列腺癌通路、卡波西肉瘤相关疱疹病毒感染通路、内分泌抵抗通路、多巴胺能突触通路、IL-17信号通路、催乳素信号通路等的调控。
综上所述,本研究采用网络药理学方法探讨柴胡疏肝散治疗失眠的作用机制,从整体上分析柴胡疏肝散和失眠的关系,为柴胡疏肝散相关的分子生物学研究及更深入的药理学探索提供了参考。但本研究未能对各味中药的剂量加以考虑,这将是以后网络药理学及相关研究需要关注的问题。
