开心散含药血清对Aβ1-42损伤的神经干细胞增殖和分化能力的影响
2021-08-05邓艳时悦肖洪贺李妍陈吉聪李婉嫕杨静娴
邓艳,时悦,肖洪贺,李妍,陈吉聪,李婉嫕,杨静娴
辽宁中医药大学 药学院,辽宁 大连 116600
阿尔茨海默病(AD)是一种神经退行性疾病,以β淀粉样蛋白(Aβ)沉积形成的炎性老年斑(SP)和tau蛋白异常磷酸化形成的神经纤维缠结(NFTs)及脑内神经元丢失为主要病理特征。AD发病机制复杂,目前尚未完全阐明,主要有Aβ沉积、tau过度磷酸化、胆碱能突触功能损伤、氧化应激、炎症损伤和钙离子稳态失衡、神经元死亡等学说[1]。其中,以Aβ沉积学说最为公认。Aβ最主要的组成为Aβ1-40和Aβ1-42,而Aβ1-42更容易聚集成寡聚体,对神经细胞的毒性较强,能够直接导致神经元死亡[2]。AD病因的复杂性和多因素性为其治疗提出了挑战。目前,西医尚无法完全治愈AD,只能以缓解症状为主。因此,最紧要的问题是寻找从根本上治疗AD的新方法[3]。中医中药的应用从整体观念出发,将研究思路从单体成分及单个靶点治疗调整为整体探究、系统调节的方式[4],通过多靶点间的相互作用实现增效减毒的效果[5],这与AD发病的复杂病理生理机制相符合。
近年来,神经干细胞(NSCs)技术在多种疾病中得到应用,在AD的治疗中也有广阔的应用前景[6]。NSCs是一种具有自我更新能力的多潜能细胞,能够分化出各种类型的神经细胞,参与到神经再生过程中。神经再生过程主要包括4个阶段,即:1)NSCs存活、增殖和分化;2)新生神经元的成熟;3)突触形成;4)神经回路整合。AD患者随着年龄增长,脑中的神经再生能力逐渐下降,同时Aβ能显著抑制NSCs的增殖和迁移能力[7-8],所以在病理情况初期保护NSCs免受损伤、促进NSCs增殖及分化尤为重要。
开心散是治疗健忘的经典名方,在2018年4月被国家中医药管理局会同国家药品监督管理局制定的《古代经典名方目录(第一批)》收录。开心散由人参、远志、石菖蒲和茯苓4味药组成,具有益气补虚、安神定惊、益智、交通心肾的作用。现代药理研究证实,干细胞与“肾精”具有同一性,被认为是肾精在细胞层面的体现[9-10]。开心散补肾益精的功效可激发脏腑潜在的机能,即激活并促进NSCs增殖与分化,起到修复再生AD受损组织、恢复功能的作用。开心散可促进小鼠长时程增强效应(LTP)形成,调节突触后密度蛋白-95(PSD-95)的表达,增强突触可塑性[11];能够调控炎症因子Bcl-2及Bax的表达[12];可以通过激活环磷酸腺苷(cAMP)依赖的信号通路,使神经生长因子(NGF)和脑源性神经营养因子(BDNF)表达增加,进而上调突触素的表达[13];还作用于胆碱能系统,降低乙酰胆碱酯酶、活性氧、丙二醛的水平和活性[14]。利用Aβ造模的小鼠,在造模前7 d给予开心散后,能增加突触前膜Synapsin 1磷酸化,改善Aβ诱发的小鼠记忆障碍[15]。所以,开心散治疗神经退行性疾病具有广阔的临床应用前景。本研究采用Aβ1-42寡聚体孵育NSCs制备AD细胞模型,模拟AD患者脑内NSCs,探讨开心散含药血清对病理状态下NSCs增殖和分化能力的影响,为开心散治疗AD提供参考。
1 材料
1.1 实验动物
SPF级C57BL/6小鼠购于辽宁长生生物有限公司,实验动物生产许可证号为SCXK(辽)2017-0001。小鼠一雄一雌合笼,饲养于20~25 ℃环境,自由饮食和饮水,每日光照12 h。将孕鼠单独一笼饲养直至生产,取48 h内新生乳鼠用于实验。研究中所有实验动物相关操作都经过辽宁中医药大学伦理审查委员会批准并严格按照国际实验伦理行为准则实行,实验动物使用许可证编号为SYXK(辽)2019-0004。
1.2 试药
人参PanaxginsengC.A.Meyer(江西樟树天齐堂中药饮片公司);远志PolygalatenuifoliaWilld(安徽石田中药饮片有限公司);茯苓Poriacocos(Schw.)Wolf(安国市安兴中药饮片有限公司);石菖蒲AcortwtatarinowiiSchott(安国市辉发中药饮片加工有限公司)均由辽宁中医药大学药学院杨静娴教授鉴定为正品。DMEM、DMEM/F12培养基,胎牛血清(FBS),25%胰蛋白酶,青-链双抗(Gbico公司);4′,6-二脒基-2-苯基吲哚(DAPI,Sigma公司);CyTM3标记羊抗鼠二抗(Jackson公司);表皮生长因子(EGF)、成纤维细胞生长因子(bFGF)购自PeproTech公司;硫酸软骨素蛋白多糖2(NG2)抗体(Upstate公司);胶质纤维酸性蛋白(GFAP)、Ki67抗体(北京博奥森生物技术有限公司);中分子量神经丝蛋白(NF-M)抗体(StemCell公司);巢蛋白(Nestin)抗体(Millipore公司);Aβ1-42(南京肽业生物科技有限公司);CCK-8试剂盒(沈阳万类生物科技有限公司)。
1.3 仪器
Ti-S型荧光倒置显微镜(日本尼康公司);TGL-20M型台式高速冷冻离心机(湖南湘仪实验室仪器公司);UV-5600型紫外-可见光分光光度计(上海元析公司)。
2 方法
2.1 开心散含药血清的制备
《千金要方》中记载开心散组成为“远志、人参各四分,茯苓二两,菖蒲一两”[16]。取人参、远志、茯苓、石菖蒲饮片,粉碎,过60目筛,按1∶1∶50∶25(共200 g)制备开心散[17],加入10倍量纯净水,浸泡过夜,回流提取2 h,滤过;再加入8倍量纯净水,继续回流提取2 h,滤过;合并2次滤液,减压浓缩至生药质量浓度为4.8 g·mL-1,于-20 ℃冻存,备用。
依据体表面积换算法[18],将成人每日所需生药量换算成小鼠所需药量。60 kg的成人每日需开心散114.88 g,换算成20 g小鼠每日所需生药量为0.480 5 g,作为开心散中剂量组。将6月龄SPF级C57BL/6小鼠随机分为4组,每组10只,分别灌胃给予0.9%氯化钠溶液和开心散48、24、12 g·kg-1(以生药量计),每天1次,连续7 d[19]。末次给药2 h后,小鼠眼眶采血,室温静置30 min,3000 r·min-1离心15 min(离心半径为3.5 cm),取上层血清,56 ℃灭活30 min,0.22 μm微孔滤膜滤过,分装,制得高、中、低剂量开心散含药血清,置-20 ℃保存备用。
2.2 Aβ1-42寡聚体的制备
Aβ1-42粉末加入六氟异丙醇,溶解,挥干,加入含有1%二甲基亚砜(DMSO)的DMEM/F12,使其浓度为200 μmol·L-1,4 ℃下孵育24 h,制得终浓度为200 μmol·L-1的Aβ1-42寡聚体,24 h内使用[20]。
2.3 NSCs的体外培养与鉴定
取48 h内新生乳鼠海马,剪碎,加入0.125%胰酶,消化15 min,反复吹打后,过70 μm筛网,得到含有NSCs的单细胞混悬液,离心后,加入增殖培养基复悬,以2×106个/mL密度接种于24孔板内,每孔1 mL,置于37 ℃、5% CO2培养箱内培养,2~3 d半量换液,培养7~10 d传代[21]。取第3代的NSCs以2×105个/mL的密度重新接种于96孔板内,采用免疫荧光法(IF)鉴定培养NSCs的Nestin表达情况。
2.4 CCK-8法检测NSCs的存活
将机械性吹打后的NSCs以2×106个/mL的密度接种于96孔板,每孔100 μL,分为对照组、模型组及开心散含药血清高(KXS-H)、中(KXS-M)、低(KXS-L)剂量组,置于37 ℃、5% CO2培养箱中培养24 h。对照组和模型组给予10%空白血清,各给药组分别对应给予10%的开心散含药血清[22]。给药24 h后,加入Aβ1-42使其终浓度为20 μmol·L-1,孵育24 h,参照CCK-8试剂盒说明书,设立只含培养液的空白组,各组培养孔内加入10 μL的CCK-8溶液,孵育4 h后,用酶标仪检测450 nm处吸光度(A)值,根据公式(1)计算细胞存活率。
细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×
100%
(1)
2.5 NSCs增殖能力检测
2.5.1NSCs直径测量 细胞随机分为对照组、模型组、KXS(给予10%开心散含药血清中剂量)组,给药及Aβ1-42孵育同2.4项下。孵育24 h后,将各组NSCs机械性吹打为单个细胞,并在增殖培养基内连续培养7 d,分别在第三、五、七天拍照记录,采用Image J软件进行神经球计数和直径测量。每组进行6次平行实验,每组取10个神经球测量直径。
2.5.2IF检测Ki67蛋白表达 细胞分组及处理同2.5.1项下,选用培养至第三天的神经干细胞,用IF法检测Ki67蛋白表达情况。将培养于96孔板中的各组细胞用4%多聚甲醛常温固定,磷酸盐缓冲液(PBS)洗3次;1%Triton X-100透化10 min,PBS清洗3次;加5%BSA溶液封闭后PBS洗涤;每孔滴加用1%BSA稀释的Ki67一抗(1∶150)4 ℃孵育过夜,次晨用PBS清洗;加入CyTM3标记的羊抗鼠二抗(1∶200)室温避光孵育1 h,PBS缓冲液洗3次;DAPI染色液复染,PBS清洗,滴加少量防荧光淬灭剂,使用荧光倒置显微镜下观察并拍照记录,采用Image J对阳性细胞进行计数。
2.6 IF检测NSCs的分化能力
取第3代NSCs,细胞分组及处理同2.5.1项下。细胞打散后接种于分化培养基(含有10% FBS和1% P/S的DMEM/F12)中诱导分化,培养14 d,用IF法检测其分化情况。4%多聚甲醛固定20 min,PBS清洗,0.5%Triton X-100透化15 min,PBS清洗,5%FBS封闭30 min,分别加入用1%BSA稀释的NF-M(1∶100)、GFAP(1∶100)、NG2(1∶100)和Nestin(1∶100)一抗,4 ℃过夜,PBS清洗,加入CyTM3标记的羊抗兔二抗(1∶200),室温孵育1.5 h,DAPI染液复染5 min,滴加少量防荧光淬灭剂,荧光倒置显微镜下(200×)观察。每组进行6次平行实验,每孔随机取3个视野,进行采用Image J统计细胞数量。
2.7 统计学分析

3 结果
3.1 NSCs的体外培养与鉴定
原代培养的NSCs呈悬浮细胞球,折光性强,单个存在。经IF鉴定神经球表达Nestin蛋白,且阳性率达90%以上,证明其具有良好的NSCs特性(图1)。

图1 NSCs的培养与IF鉴定
3.2 开心散含药血清对NSCs存活率的影响
CCK-8结果显示,与对照组比较,模型组NSCs存活率显著降低[(52.23±4.84)%,P<0.01]。KXS-H、KXS-M、KXS-L组细胞存活率分别为(85.2±9.61)%、(83.47±9.05)%、(80.17±4.09)%,与模型组比较,细胞存活率均显著增高(P<0.01)。说明开心散含药血清可以提高NSCs存活率,其中KXS-H组效果最好。但KXS-M组与KXS-H组比较差异无统计学意义,所以最终选择开心散中剂量含药血清用于后续实验研究(图2)。

注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。图2 开心散不同剂量含药血清对AD模型的NSCs存活能力的影响
3.3 开心散含药血清对NSCs增殖的影响
如图3A~B所示,与对照组比较,模型组神经球直径较小。与模型组比较,KXS组神经球直径显著增加[(93.25±2.92)μm,P<0.01]。如图3C~D所示,与对照组比较,模型组细胞Ki67蛋白阳性率显著降低[(32.87±4.01)%,P<0.01];与模型组比较,KXS组细胞的Ki67蛋白阳性率明显升高[(48.55±1.94)%,P<0.01]。2种检测方法说明,在增殖培养基中,开心散含药血清能明显促进NSCs的增殖能力。
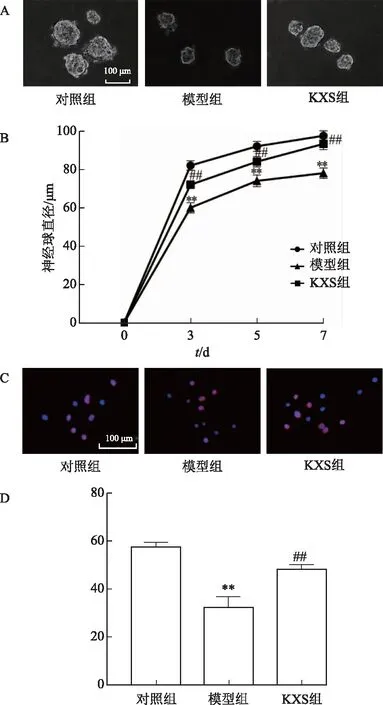
注:A.第七天各组细胞神经球光镜图;B.各组细胞在第三、五、七天的神经球直径;C.第三天各组细胞Ki67蛋白阳性表达;D.各组细胞Ki67蛋白阳性率;与对照组比较,**P<0.01;与模型组比较,##P<0.01。图3 开心散含药血清对AD模型的NSCs增殖能力的影响
3.4 开心散含药血清对NSCs分化的影响
IF结果显示,与对照组比较,模型组NSCs向神经元[(24.38±2.00)%,P<0.05]和少突胶质细胞[(20.26±1.06)%,P<0.01]分化比例降低。与模型组比较,KXS组NSCs分化为神经元[(31.95±0.58)%,P<0.05]的比例升高,分化为星形胶质细胞[(31.32±3.04)%,P<0.05]的比例降低,而对少突胶质细胞无显著影响。3组细胞仍有少部分保持未分化状态,差异无统计学意义。说明在分化培养基中,开心散含药血清能够拮抗Aβ诱导的NSCs向神经元分化减少、向胶质细胞分化增多的异常行为(图4)。

注:A.第十四天NSCs分化不同类型神经细胞,NF-M+神经元、GFAP+星形胶质细胞、NG2+少突胶质细胞和Nestin+未分化NSCs均为红色,DAPI染细胞核为蓝色;B.NSCs分化成各个类型细胞的定量分析;C.第十四天各组NSCs向神经元分化;D.各组NSCs分化为神经元阳性细胞率;与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05。图4 开心散含药血清对AD模型的NSCs分化能力的影响
4 讨论
Aβ作为极强的神经毒性物质,代谢异常会大量累积于神经系统,可能是AD发生和发展的始动因素[23]。研究表明,Aβ1-42可致海马区NSCs增殖水平降低,损伤后引起明显认知功能障碍[24];Aβ积聚会抑制神经干/祖细胞的增殖和神经元分化,从而影响体外和体内成年海马的神经发生[25];Aβ通过破坏NSCs自我更新的线粒体信号,使NSCs的活性及增殖能力受到损害,并间接阻断了神经源性分化[26]。目前针对AD的治疗策略都不能从根本上补充AD发病过程中丢失的神经元。
NSCs在AD的治疗中有广泛的应用前景,NSCs与其他成体细胞的区别在于其具有分化成多种不同类型细胞的能力,其可经历对称或不对称分裂成为2个子细胞。对称分裂产生2个NSCs,而不对称分裂产生1个NSCs和1个走向分化方向的细胞,分化的方向主要是神经元、星形及少突胶质细胞[27]。所以NSCs可以在生长过程中分化成不同的神经细胞,并且可以源源不断的产生新的NSCs,且不会使之耗竭。
研究发现,开心散含药血清可以保护PC12细胞[28];通过维持线粒体正常功能抑制神经细胞凋亡[29]。目前已有的对于开心散的研究大多是从改善AD小鼠记忆、激活通路改善突触、炎症因子的调节等角度进行,但未见开心散含药血清能否促进NSCs的增殖和分化继而从根源上解决AD大量损伤及丢失的神经细胞的研究。
本实验首先在增殖培养基中培养NSCs,检测NSCs的存活及增殖能力,然后在分化培养基中诱导NSCs分化。Aβ1-42造模后,通过CCK-8法检测显示,与对照组比较,Aβ1-42损伤的NSCs存活率降低,说明符合AD细胞模型特征。与模型组比较,开心散高、中、低剂量含药血清组细胞存活率都提高。说明开心散含药血清可以提高AD神经干细胞存活率,发挥神经保护作用。
通过Image J测量神经球直径可知,与模型组比较,开心散含药血清能够使神经球直径显著增加。IF检测结果显示,开心散含药血清使NSCs的Ki67阳性率升高。说明开心散含药血清能够促进AD神经干细胞的增殖能力。
在分化培养基中,与模型组比较,开心散含药血清促神经干细胞分化为更多的神经元和更少的星形胶质细胞,而对少突胶质细胞无影响。说明开心散含药血清能够拮抗Aβ1-42诱导的NSCs神经元分化较少而胶质细胞分化增强的异常行为。
本研究结果表明,开心散含药血清能提高Aβ1-42损伤的NSCs存活率,促进其增殖,并拮抗Aβ1-42导致的NSCs神经元分化较少而胶质细胞分化增强,提示开心散具有使NSCs向有利于机体神经修复的方向发展的作用。开心散对AD模型NSCs保护作用的作用机制将在后续实验中继续研究。
