肺部超声诊断腹腔镜肝脏切除术中气胸1例*
2021-08-04蔡腊梅姜春玲
徐 艳,刘 馨,蔡腊梅,姜春玲
(四川大学华西医院麻醉科,成都 610041)
随着腹腔镜技术的发展和手术技术的提高,腹腔镜下肝脏切除已成为肝癌治疗的重要术式[1]。然而,由于肝脏的解剖位置靠近膈肌,手术操作稍不慎即有损伤胸膜、膈肌,导致患者发生气胸的可能,重者可影响呼吸、循环系统,威胁患者的生命安全。既往气胸诊断主要依靠临床表现及胸部CT或X线片,但术中行胸部CT或X线检查不仅有辐射,还耗时,可能因此延误诊治。近年来,肺部超声以其简便快捷、可靠、无辐射、低成本等优点,在床旁及术中气胸患者的诊断应用逐渐增多。作者总结分析本院1例借助肺部超声诊断腹腔镜下肝脏切除术中并发气胸的患者资料,现报道如下。
1 临床资料
患者,男,73岁,身高162 cm,体重74 kg,因“体检发现肝占位1+个月”入院。既往有高血压病史10年,平时规律服用硝苯地平缓释片,血压在135~150/70~95 mm Hg,否认吸烟史。心肺及专科查体无特殊。辅助检查:血常规、肝肾功能、凝血功能等均未见明显异常。心电图:窦性心律,完全性右束支传导阻滞。超声心动图提示:主动脉增宽,室间隔基底段增厚,主动脉瓣反流(轻度),左心室收缩功能检测值正常,射血分数70%。胸腹部CT提示:双肺散在斑片条索影,心脏未见增大;肝左叶见8.6 cm×7.8 cm混杂密度肿块影。入院诊断:(1)左肝肝癌;(2)肝硬化;(3)高血压2级(中危)。入院完善相关检查,拟在全身麻醉下行“腹腔镜下左肝切除+胆囊切除术”。美国麻醉医师协会(ASA)分级Ⅲ级,常规术前准备。
患者入手术室后,建立外周静脉通道,常规心电监护:心率(HR)80次/min,血压131/82 mm Hg,血氧饱和度(SpO2)98%。常规静脉麻醉诱导后,于可视喉镜下顺利插入ID 7.5 mm普通型气管导管,听诊双肺呼吸音清晰对称,采用容量控制模式,设置呼吸频率12次/min,潮气量480 mL,此时气道峰压为15 cm H2O。行右侧桡动脉穿刺置管,监测有创动脉血压(ABP)。手术采用头高脚低仰卧位,顺利建立人工气腹,CO2气腹压力为14 mm Hg,此时气道峰压上升至25 cm H2O,调整呼吸机参数,呼吸频率14次/min,潮气量375 mL,气道峰压降至22 cm H2O,ABP 100/74 mm Hg。麻醉维持用2%七氟醚吸入及0.12 μg·kg-1·min-1瑞芬太尼静脉泵注维持,间断追加舒芬太尼和顺式阿曲库铵。手术开始后5 h,气道峰压突然增至35 cm H2O,SpO2下降至89%,ABP 87/56 mm Hg,排除气管导管打折、气道内分泌物堵塞及肌松不足3种可能之后,查体:颈胸部无皮下气肿;听诊发现右肺呼吸音消失,左肺呼吸音清晰。立即关闭气腹暂停手术,气道峰压下降至24 cm H2O,高度怀疑气胸。此时血压波动在75~80/45~65 mm Hg,HR 95次/min,给予加快补液并间断推注间羟胺,循环改善效果不明显,遂给予去甲肾上腺素0.05~0.1 μg·kg-1·min-1持续泵注,血压波动在85~90/55~67 mm Hg。为进一步明确诊断,行床旁肺部超声(图1)扫查右肺1区见:胸膜滑动征不明显,A线可见,B线消失,M超下表现为“条码征”,即胸膜线及以下部位无任何移动。行床旁经胸心脏超声(图2)提示:心脏收缩功能可,循环血容量严重不足,下腔静脉呼吸变异度超过50%。查血气分析提示:血红蛋白(Hb)65 g/L,动脉血氧分压(PaO2)55 mm Hg,遂给予红细胞悬液输注,考虑手术出血较多且并发气胸,与外科医生沟通后决定中转开腹继续手术,确定气胸后调整呼吸机参数:使用压力控制模式,吸气压力14 cm H2O,呼吸频率18次/min,此时潮气量为300 mL,10 min后打开腹腔,检查发现右侧膈肌有0.5 cm×0.7 cm大小的破口,立即给予修补。5 min后,SpO2升至98%,再次听诊双肺呼吸音,右侧呼吸音较前有所好转。后血压逐渐回升稳定在95~100/60~76 mm Hg,此时去甲肾上腺素泵速减至0.05 μg·kg-1·min-1。复查血气:pH 7.21,PaO2182 mm Hg,动脉血二氧化碳分压(PaCO2)52 mm Hg,Hb 80 g/L,乳酸(Lac)4.9 mmol/L,碱剩余(BE)-7.9 mmol/L。2 h后,手术结束,复查肺部超声,胸腔仍有部分积气,予床旁安置右侧胸腔闭式引流,引流瓶中可见气泡溢出及水柱波动,术毕送至重症监护室(ICU)继续治疗。术后患者复查胸部X线片(图3)提示:右侧胸腔少许积气待排。后患者病情趋于稳定,术后第1天顺利拔管,无呼吸困难、胸闷、胸痛等症状,术后第2天转回普通病房,1周后顺利出院。
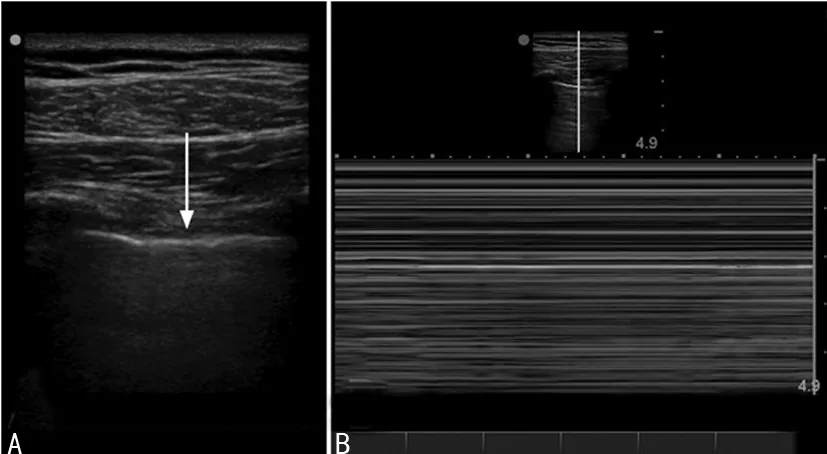
A:胸膜滑动征不明显,B线消失;B:M超下表现为“条码征”。

A:左心室收缩期末;B:左心室舒张期末。
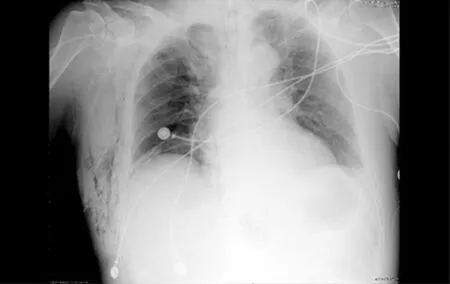
图3 术后第1天胸部X线片
2 讨 论
近年来,腹腔镜手术因创伤小、全身反应小、疼痛轻、术后恢复快等优点,在临床上得到广泛应用[2-3]。但腹腔镜手术仍存在一些特定的风险和相关并发症,包括高碳酸血症、低氧血症、皮下气肿、气胸、纵隔气肿、气体栓塞等[4]。其中,气胸虽少见,但若不及时干预,可能导致严重后果[4-5]。
结合本例患者,围术期引起气胸的原因可从以下几方面考虑。(1)患者自身因素:患者既往无吸烟史,无肺部疾病史,术前胸部CT未发现阻塞性肺气肿、肺大泡、支气管扩张等征象,发生自发性气胸的可能性较小。(2)麻醉相关操作:麻醉插管过程顺利,而气胸相关体征是在手术开始5 h后出现的,遂可以排除麻醉操作损伤引起气胸的可能。(3)手术因素:腹腔镜手术需要建立人工气腹,腹腔充入大量CO2气体,可造成腹腔内压显著增高、腹腔容积增大、横膈面积增大、膈肌张力增高、膈肌变薄。而肝脏的位置临近横膈,且本例患者肝脏占位距离膈肌较近,腹腔镜手术操作稍不慎便可损伤膈肌,腹腔内的高压气体迅速经膈肌破损处进入胸腔,使得胸腔内压力增加、肺组织压缩,形成张力性气胸,进而可能压迫纵隔移位,挤压健侧肺,甚至可导致腔静脉扭曲,静脉回心血量减少,重者可引起呼吸循环功能的严重障碍,在机体循环血容量不足时表现更明显。本例患者在外科医生改变手术方式,开腹解除腹腔压力后,SpO2改善明显,且开腹后找到了膈肌损伤破口,确定了引起气胸的主要原因是膈肌损伤。
既往气胸的诊断主要依靠临床表现及胸部CT或胸部X线片。胸部CT是诊断气胸的“金标准”[6],但由于条件限制,手术室内突发状况下难以及时实现。胸部X线片准确率虽接近100%,但漏诊率却高达50%以上,尤其是少量气胸的患者。而肺部超声因具有简便快捷、可靠、无辐射、低成本等优点,近年来已逐渐成为围术期诊断气胸的首选方法。最新肺超声国际专家共识指出,气胸的超声征象包括:存在肺点、无胸膜滑动征、无B线、无肺搏动征[7],其灵敏度为92%,特异度大于99%[8]。研究发现,肺部超声诊断及排除气胸的准确性比卧位胸部X线片更高,因此,推荐使用肺部超声来鉴别诊断气胸[9-10]。本例患者出现单侧呼吸音消失、通气阻力高、通气困难、SpO2下降、PaO2下降,排除气道梗阻及其他因素后怀疑气胸,而由于围术期患者被手术铺巾所覆盖及手术室条件的限制,肺部超声为气胸的诊断提供了可靠的依据。
围术期气胸的处理原则是适当排气,以解除胸腹腔积气对呼吸循环的影响,使肺尽早复张,恢复功能,同时积极治疗原发病和并发症。比如对于膈肌破裂,CO2漏入胸腔引起的气胸可采用补片或钛夹等封闭裂孔后再进行手术操作,因胸膜吸收CO2的速度很快,在停止充气后,漏入胸腔内的CO2在30~60 min大部分会被自行吸收,一般情况下不需安置胸腔闭式引流。而肺大泡破裂导致的气胸(气压伤或医源性因素等),因胸腔内气体为呼吸的气体,不易被吸收,且因肺泡破裂口的存在,会有气体持续进入胸腔,常需安置胸腔闭式引流[11]。但本例患者因手术结束时仍存在较多残余气体,为安全起见给予安置胸腔闭式引流管。
通过分析本例患者相关情况,作者有以下体会:(1)在围术期气胸的诊断中,肺部超声因价格便宜、无辐射、便于实施,且灵敏度高等特点,可作为首选方法。(2)明确气胸诊断后,应及时对症处理,同时排查病因和纠正祛除原发病,及时排气、引流,解除压迫,避免病情进一步进展,引起严重后果。(3)气胸发生后,应及时调整呼吸机参数,宜使用小压力(<15 cm H2O)、小潮气量(<6 mL/kg)、快频率(15~20次/min),避免机械通气不当,进一步加重病情。(4)对既往有肺大泡、肺气肿、支气管扩张等气胸危险因素的患者,应积极预防气胸的发生,在麻醉过程中选择适当的肺保护性通气策略,采用小潮气量(5~7 mL/kg)通气,低平台压(25~30 cm H2O),允许性高碳酸血症,谨慎使用呼气末正压通气;在进行麻醉及手术相关穿刺操作时应准确定位、谨慎规范操作。
