TSLP siRNA干预对哮喘模型大鼠气道重塑的作用及对ERK信号通路的影响*
2021-08-04黄武锋余常辉赵海金刘爱华蔡绍曦
黄武锋,余常辉,赵海金,刘爱华,蔡绍曦
(南方医科大学南方医院呼吸与危重症医学科,广州 510515)
支气管哮喘(简称哮喘)是由炎性细胞参与进而产生气道慢性炎症的过程,这个过程会使患者出现喘息、气急、咳嗽和胸闷的症状[1];若不及时的治疗会使患者产生气道不可逆性的缩窄和气道重塑,严重危害患者的生命健康[2-3]。气道炎症是气道重塑形成的基础,它会在这个基础上出现大量黏膜、杯状细胞增生、平滑肌细胞增生、黏膜下血管增生、细胞外基质沉淀,气道重塑会使患者的气道顺行性下降、平滑肌增厚、气道壁弹性减退,进而使患者的管腔变得狭窄,肺功能持续下降,病情加重[4-5]。细胞外信号调节激酶(ERK)是一种丝氨酸蛋白激酶,是MAPK家族中的成员之一,磷酸化的ERK具有修复损伤上皮细胞的功能[6]。胸腺基质淋巴细胞生成素(TSLP)是一种由气道上皮分泌的细胞因子,在哮喘患者中呈高表达。小干扰RNA(siRNA)可以通过干扰靶mRNA抑制相关基因的表达来控制疾病的发生[7]。因此,本文主要研究TSLP siRNA干预对哮喘模型大鼠气道重塑的作用及对ERK信号通路的影响。
1 资料与方法
1.1 研究动物
选取清洁及健康的雄性大鼠56只,鼠龄为6~12周,平均周龄为(9.47±1.39)周;体重210~260 g,平均(247.37±0.37)g。选取的大鼠是由本校动物所提供的,大鼠的饲养标准为:25 ℃的环境,60%的湿度,每小时通风10次,及时添加水和饲料。
1.2 方法
1.2.1哮喘模型的建立
选取清洁及健康的雄性大鼠56只,14只分为正常组,剩余42只建立哮喘模型。参考文献[8]建立哮喘模型,将新鲜配制的1 mg的卵蛋白和100 mg的氢氧化铝混合,在第1、8天将其注射在大鼠的腹部致敏,从第9天开始,将1%的卵蛋白和10 mL生理盐水混合液进行雾化,诱导大鼠哮喘发作,当大鼠表现为呼吸加快、喘息、皮毛无光泽、打喷嚏时代表哮喘模型建立成功。
1.2.2气道高反应性测量
建模成功后测量大鼠的气道高反应性,使用1%戊巴比妥钠腹腔注射麻醉大鼠,然后进行气管插管处理,将其置于密闭体扫描箱中并将气管插管连接至呼吸机上,呼吸机的参数设置为:呼吸频率140~150次/min,流量调定以大鼠潮气量达到0.13~0.15 mL时为准,然后分别给予浓度为3.125、6.250、12.500、25.000、50.000 mg/mL的醋甲胆碱,每次需要雾化0.5 min,反应记录时间为3.0 min,恢复至基线时间为4.0 min,使用气道阻力指数评价气道高反应性。
1.2.3分组
将42只哮喘模型大鼠随机分为模型组、空白对照组和TSLP siRNA干预组,各14只。TSLP siRNA干预组给予注射125 μL TSLP siRNA进行干预,模型组给予等体积的无菌生理盐水进行干预,空白对照组给予siRNA-control工作液干预,所有大鼠连续干预3周。
1.2.4白细胞、嗜酸性粒细胞(EOS)/白细胞检测
白细胞计数用移液枪抽取1 040 μL的血液,放入EP管中,另外取出40 μL的血液放入新的EP管中,用浓度为75%的乙醇将细胞计数板清洗3次,然后用滤纸将计数板周围的水吸干,将盖玻片平铺在细胞计数板上,在显微镜下数4个方格白细胞数,得出白细胞数量。EOS计数将剩余的1 000 μL血液与100 μL PBS充分混匀,抽取50 μL放在载玻片上,用吸管滴入3滴无水乙醇并固定,让瑞士蓝液覆盖在涂片上,放置2.0 min,玻片晾干以后再滴入无水乙醇进行脱水,然后滴加一滴中性树胶,封片,晾干,在显微镜下得出EOS的数量,最后计算EOS/白细胞的值。
1.2.5病理学观察
大鼠在干预3周后断头处死,将取出的右侧支气管组织固定以后用石蜡包埋,然后制成厚度为4 μm的切片,将切片放置在70 ℃的烤箱中,待30 min后取出,用二甲苯进行脱蜡,分别用无水乙醇,95%的乙醇、80%的乙醇清洗1 min,最后用蒸馏水清洗2 min,用HE染色6 min,着色以后再用自来水清洗2 min,然后再用1%的稀氨水返蓝2 min,脱水、封片、晾干、中性树脂封闭,在显微镜下观察组织的病理学状态。
1.2.6气道重塑参数、肺顺应性、肺弹性阻力的测量
取出经过染色的大鼠右侧支气管组织切片,用Image-Pro Plus软件计算出大鼠的小气道支气管壁总管壁面积、小气道支气管壁内管壁面积和支气管壁平滑肌的面积。称取大鼠体重后,将3.5 mL/kg浓度为10%的水合氯醛注射在大鼠的腹腔中,进行麻醉处理,然后使大鼠仰卧在木板上,暴露出胸部,剥离大鼠的支气管皮下组织,清除心脏和周围的血管,将气管和食管切开以后插入插管并固定,然后连接生理记录仪,记录大鼠的肺顺应性和肺弹性阻力。
1.2.7ERK1、C-FOS、PDGF通路蛋白检测
将采集到的大鼠支气管组织提取液,通过1 000 r/min离心处理后提取沉淀,滴加裂解液,反复冰融后,12 000 r/min离心处理,提取上清液,采用酶标仪检测ERK1、C-FOS、PDGF蛋白浓度,保存。滴加10%的分离胶,封闭,吸干水分,给予5%的浓缩胶灌注,凝固后,将其在电泳槽中固定,加5 μL Marker,变性蛋白样品,电泳干预30 min,待蛋白分离胶底,结束电泳;转膜成功后将硝酸纤维素膜(NC)在5%的脱脂奶粉中封闭固定1 h,加一抗(ERK1、C-FOS、PDGF 1∶1 000)孵育,经过振荡洗膜后加二抗(ERK1、C-FOS、PDGF 1∶10 000)孵育,再次振荡洗膜,使用红外荧光成像系统对结果给予分析。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参蛋白。
1.3 统计学处理
2 结 果
2.1 TSLP siRNA干预对哮喘模型大鼠气道重塑指标的影响
与正常组相比,模型组、空白对照组、TSLP siRNA干预组小气道支气管壁总管壁面积、小气道支气管壁内壁面积、支气管壁平滑肌面积均较大,差异有统计学意义(P<0.05);与模型组相比,空白对照组TSLP siRNA干预组小气道支气管壁总管壁面积、小气道支气管壁内壁面积、支气管壁平滑肌面积均减小,差异有统计学意义(P<0.05);与空白对照组相比,TSLP siRNA干预组小气道支气管壁总管壁面积、小气道支气管壁内壁面积、支气管壁平滑肌面积均减小,差异有统计学意义(P<0.05),见表1。
正常组大鼠右侧支气管组织形态完整,右侧支气管纤维排列整齐,间隙分布均匀;模型组大鼠右侧支气管组织有明显的吸收陷窝,纤维排列紊乱;空白对照组右侧支气管组织伴有吸收陷窝的现象,且组织破坏明显;TSLP siRNA干预组大鼠右侧支气管组织形态、纤维排列逐渐恢复,见图1。

表1 TSLP siRNA干预对哮喘模型大鼠气道重塑指标的影响
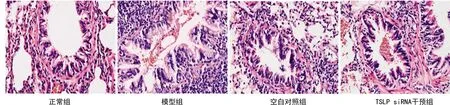
图1 4组大鼠病理学观察(HE染色,×200)
2.2 TSLP siRNA干预对哮喘模型大鼠肺顺应性、肺弹性阻力的影响
与正常组相比,模型组、空白对照组、TSLP siRNA干预组肺顺应性均降低,肺弹性阻力均升高,差异有统计学意义(P<0.05);与模型组相比,空白对照组、TSLP siRNA干预组肺顺应性均升高,肺弹性阻力均降低,差异有统计学意义(P<0.05);与空白对照组相比,TSLP siRNA干预组肺顺应性升高,肺弹性阻力降低,差异有统计学意义(P<0.05),见表2。
2.3 TSLP siRNA干预对哮喘模型大鼠白细胞、EOS/白细胞的影响
与正常对照组相比,模型组、空白对照组、TSLP siRNA干预组白细胞、EOS/白细胞均升高,差异有统计学意义(P<0.05);与模型组相比,空白对照组、TSLP siRNA干预组白细胞、EOS/白细胞均降低,差异有统计学意义(P<0.05);与空白对照组相比,TSLP siRNA干预组白细胞、EOS/白细胞均降低,差异有统计学意义(P<0.05),见表3。

表2 TSLP siRNA干预对哮喘模型大鼠肺顺应性、肺弹性阻力的影响

表3 TSLP siRNA干预对哮喘模型大鼠白细胞、EOS/ 白细胞的影响
2.4 TSLP siRNA干预对哮喘模型大鼠ERK1、C-FOS、PDGF通路蛋白的影响
与正常组相比,模型组、空白对照组、TSLP siRNA干预组ERK1、C-FOS、PDGF通路蛋白均升高,差异有统计学意义(P<0.05);与模型组相比,空白对照组、TSLP siRNA干预组ERK1、C-FOS、PDGF通路蛋白均降低,差异有统计学意义(P<0.05);与空白对照组相比,TSLP siRNA干预组ERK1、C-FOS、PDGF通路蛋白均降低,差异有统计学意义(P<0.05),见表4、图2。

表4 TSLP siRNA干预对哮喘模型大鼠ERK1、C- FOS、PDGF通路蛋白的影响

图2 4组大鼠ERK1、C-FOS、PDGF通路蛋白Western blot检测
3 讨 论
哮喘患病率在全球范围内有逐年增加的趋势,严重危害人类健康。随着哮喘病情反复发作,会出现不可逆的气流阻塞[8],导致肺功能下降,目前认为气道重塑是造成不可逆性气流阻塞和肺功能下降的主要原因,也被认为是引发哮喘发展为顽固性、难治性疾病的主要因素。气道重塑是一种炎性反应的结果。在哮喘发生过程中,多种细胞会通过释放炎症因子而促使患者的气道平滑肌细胞增生,支气管上皮细胞增殖倒伏,炎症细胞浸润,进而导致基底膜增厚和上皮下胶原纤维沉积[9-10]。有研究表明,气道重塑是由于长期的气道慢性炎症及支气管痉挛发生的损伤-修复循环所导致的气道结构改变[11]。在哮喘发病早期会出现成纤细胞增殖和上皮下胶原沉积等一系列气道重塑的现象,进而促进哮喘的发生和发展[12]。本研究结果显示,TSLP siRNA干预可改善哮喘模型大鼠的气道重塑指标,因此,进一步明确气道重塑的机制和寻找有效的治疗方法是哮喘防治的焦点。
TSLP具有调节上皮细胞功能、诱导免疫应答的作用,可通过激活髓系树突状细胞来促进炎性细胞因子的释放,进而加重哮喘的病情[13-14]。进一步研究显示:TSLP可以活化平滑肌细胞及成纤维细胞,加重气道重塑。已有相关研究表明,靶向上皮来源因子如TSLP可减少难治性哮喘患者急性加重。Tezepelumab是一种抗TSLP单克隆抗体,可明显减轻哮喘症状,防止病情的进一步恶化。已有相关研究证明,Tezepelumab在3期实验中成功,与其他抗体干预相比,Tezepelumab效果更好[15]。本研究结果显示,siRNA干预TSLP基因表达可有效降低哮喘大鼠气道上皮TSLP水平,提示TSLP siRNA干预可改善大鼠气道炎症,控制哮喘进一步发展。
肺顺应性可以反映出胸腔压力改变时对肺容积的改变[16-17]。肺弹性阻力与肺的顺应性呈负相关,在外力作用下当肺的弹性组织扩张时,肺顺应性越小,肺弹性阻力越大[18]。本研究结果中,TSLP siRNA干预可改善哮喘模型大鼠的肺顺应性和肺弹性阻力,控制大鼠病情的进一步发展。EOS是白细胞的组成部分之一,可损伤机体气道上皮细胞,加重气道炎性反应,当白细胞数量和EOS数量减少时,可降低大鼠气道炎性反应[19-20]。本研究结果表明,TSLP siRNA干预可减少哮喘模型大鼠白细胞数量和EOS数量,进而降低EOS/白细胞的值。
ERK是丝裂原活化蛋白激酶的信号传导途径,外界的抗原成分可以激活支气管上皮细胞上的ERK信号通路,其在哮喘的发病机制中发挥着重要作用,但活化的ERK可增强哮喘患者气道平滑肌细胞上的细胞周期素D1的表达,进而调节患者气道平滑肌的增殖[21]。C-FOS属于转录因子家族中的成员,C-FOS基因功能的实现是通过核蛋白FOS来完成的,ERK信号通路可以通过酶联反应增加上皮组织中C-FOS基因的表达,进而产生气道重塑导致哮喘的发生,当C-FOS基因表达增高时会调节炎性反应,损伤支气管上皮细胞,阻止糖皮质激素对某些基因转录的诱导,继而导致哮喘的发生和加重[22]。机体中的多种细胞都可以产生PDGF,当PDGF增多时,会促进胶原蛋白的合成。有研究表明,当PDGF与靶细胞膜上的受体结合时,会立刻激活受体上的酪氨酸激酶,继而参与哮喘气道的重构[23]。本研究结果显示,TSLP siRNA干预可通过激活ERK信号通路调控ERK1、C-FOS、PDGF通路蛋白的水平来缓解病情的发展。
综上所述,TSLP siRNA干预通过调控ERK信号通路相关蛋白,可改善大鼠的气道重塑指标,提高大鼠的肺顺应性,降低大鼠的肺弹性阻力,抑制炎性反应,为临床上治疗哮喘提供了新的方向。
