异体真皮基质与自体耳屏软骨-软骨膜在鼓膜修补中临床研究分析
2021-08-04王博琛刘彩鹏陈炯垣
王博琛,刘彩鹏,陈炯垣,刘 振
(1.佛山市第一人民医院耳鼻咽喉科∕∕广东省听觉与平衡医学工程技术研究开发中心,广东佛山 528000;2.广州市红十字会医院耳鼻咽喉科,广东广州 510220;3.佛山市第一人民医院病理科,广东佛山 528000)
鼓膜穿孔是一种常见的由于炎症或者外伤引起的耳科疾病,长期鼓膜穿孔易反复中耳炎,残余鼓膜钙化,鼓室硬化以及听力进行性下降[1]。目前,对于长期的鼓膜穿孔手术修补是其唯一的治疗方法,由于自体材料具有生物相容性好、易获得、疗效好等优优势,所以临床鼓膜修补材料多为自体材料,其中较常用的有:耳屏软骨-软骨膜复合物、颞肌筋膜、乳突骨膜等[2-5]。其中耳屏软骨膜与颞肌筋膜修补效果最佳,由于耳内镜微创手术理念,自体材料存在取材后易导致供区的疼痛、提高了供区感染的发生率、二次修补时供区取材困难和取材量受限等缺点。为解决以上缺点与适应目前的微创手术理念,生物工程鼓膜材料逐渐应用于临床[6-8]。脱细胞真皮基质作为生物工程材料,广泛应用于临床,主要用于伤口的修复以及重建[9-10],已证明其安全性及有效性。本研究旨在从病理生理学角度分析脱细胞真皮基质作为鼓膜修补材料的临床效果,找出一种符合耳微创外科要求的鼓膜修补材料。
1 材料与方法
1.1 病例资料
选2020 年1 月至2020 年6 月在佛山市第一人民医院耳鼻咽喉科行鼓膜成形术的慢性化脓性中耳炎患者74 例回顾性分析,其中23 例使用脱细胞真皮基质作为鼓膜修补材料,为A 组,年龄23~52岁;51 例使用耳屏软骨-软骨膜复合物作为鼓膜修补材料,为B 组,年龄17~61 岁。入组标准:①中耳炎干耳控制2 月以上;②紧张部穿孔穿孔,穿孔大小小于6 mm 的非边缘穿孔;③术前CT 未见鼓室以及乳突异常,听力学检查:气骨导差小于15 dB HL的单纯鼓室成形术1型;④随访期至少3个月,并行耳内镜检查。鼓膜修补术中取患者修剪后多余的耳屏软骨膜、脱细胞真皮基质送病理科切片检查。本研究资料以及方法均经伦理委员会审核,且对参与病理研究的患者,均在手术前已签署了相关的之情同意书与个人信息保密协议。
1.2 研究方法
1.2.1 手术方法 所有入组患者均采用全麻下全耳内镜下内置法修补鼓膜的手术方式,由同一名经验丰富的手术者完成。脱细胞真皮为江苏优创生物医学科技有限责任公司生产提供。耳内镜下外耳道骨膜下局部浸润后,在外耳道峡部做半环形切口,分离外耳道鼓膜皮瓣至纤维鼓环,由纤维鼓环内侧进入鼓室后,剥离外耳道皮瓣-鼓膜复合物至外耳道前壁,将鼓膜从锤骨柄上分离。A 组内置法将脱细胞真皮基质植入,其中真皮面朝向鼓室,鼓室内放置适当明胶海绵支撑,复位外耳道鼓膜瓣,耳内镜检查鼓膜是否还有裂隙,适当调整移植物位置直到检查无裂隙后,复位外耳道鼓膜瓣,局部填塞明胶海绵。B 组:在耳屏游离缘内侧少许行纵行切口,分离耳屏软骨,将耳屏软骨凸面软骨膜去除,保留凹面的软骨膜,软骨凸面朝鼓室面植入鼓室,余手术步骤与A组相同。
1.2.2 术后处理 两组均安尔碘明胶海绵填塞外耳道两周。2 组手术后均给与静脉抗感染2 天以上,出院后继续口服抗感染2 周。术后2 周取外耳道填塞物。之后1 周最少观察1 次鼓膜愈合情况,并记录患者鼓膜表面出现血管生长的时间以及情况以及修补鼓膜完全上皮化时间(以手术时间为起始时间,周为统计单位)。
1.2.3 病理分析 鼓膜修补术中取患者修剪后多余的耳屏软骨膜、脱细胞真皮基质送病理科切片检查。送检组织10%甲醛固定,24 h后,脱钙处理,包埋在石蜡块里,用切片机切成薄片,再用苏木精-伊红(HE)染色以及行免疫组化CD31 标记染色,用显微镜进一步检查对比两者之间差异。
1.3 统计学分析
采用SPSS 21.0对研究数据分析,研究指标有患者年龄、性别等基本资料,以及鼓膜愈合与否,鼓膜血管在耳内镜下爬生地时间以及鼓膜上皮化时间等。所有计量数据资料(年龄,听力情况,鼓膜愈合时间)符合正态分布的,以(均值±标准差)表示,采用独立样本t检验。而对于计数资料(性别、侧别等)采用卡方检验,以P<0.05 为有显著统计学意义。
2 结果
2.1 两组患者临床基本资料
两组患者年龄有统计学意义,A 组平均年龄39.87 岁(S=12.08),B组平均年龄46.59岁(S=11.77),A 组相对年龄小些。术后2 组鼓膜愈合率均为100%,且术后均无感染等并发症出现,两组之间性别、侧别术前气导平均听阈,术前气骨导差值,差异无统计学意义(P>0.05,表1)。但真皮基质组颜色较耳屏软骨-软骨膜复合物组术后鼓膜苍白,血管分布较少,见图1、2。两组鼓膜愈合时间,可见鼓膜表面开始血管爬生时间真皮基质组(3.74±1.05)周,耳屏软骨-软骨膜复合物组(2.22±0.42)周,耳屏软骨-软骨膜复合物组血管爬生更快,且两组之间差异有统计学意义(t=6.70,P<0.01);鼓膜表面完全上皮化时间真皮基质组(5.35±0.98)周;耳屏软骨-软骨膜复合物组(4.00±0.53)周,耳屏软骨-软骨膜复合物组上皮化更快,且两组之间存在统计学意义(t=6.19,P<0.01,图3)。术后两组气导平均阈值(dB HL):22.35±5.44 和23.41±5.33,较术前各组气导听阈均有统计学差异(P<0.01)。两组听力提高值(dB HL):8.04±2.16 和8.76±1.87,两组间差异无统计学意义(P>0.05,表2)。
表2 两组手术前后听力情况Table 2 Two groups of hearing before and after operation (,dB HL)
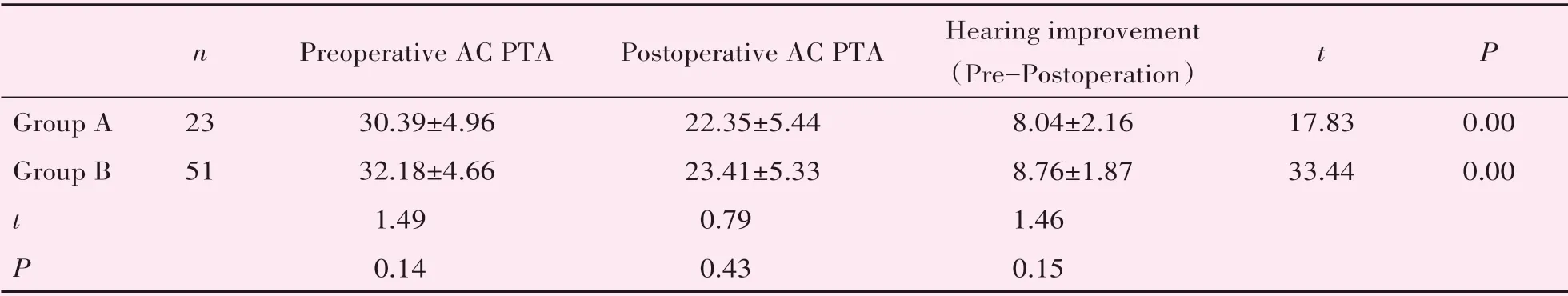
表2 两组手术前后听力情况Table 2 Two groups of hearing before and after operation (,dB HL)
AC:air conduction;PTA:Puretone threshold average.There wasstatistical significance in air conduction thresholds before and after operation in Group A and Group B.There was no statistical significance in air conduction thresholds between the two groups before and after operation.There was no statistical significance in hearing improvement between the two groups.
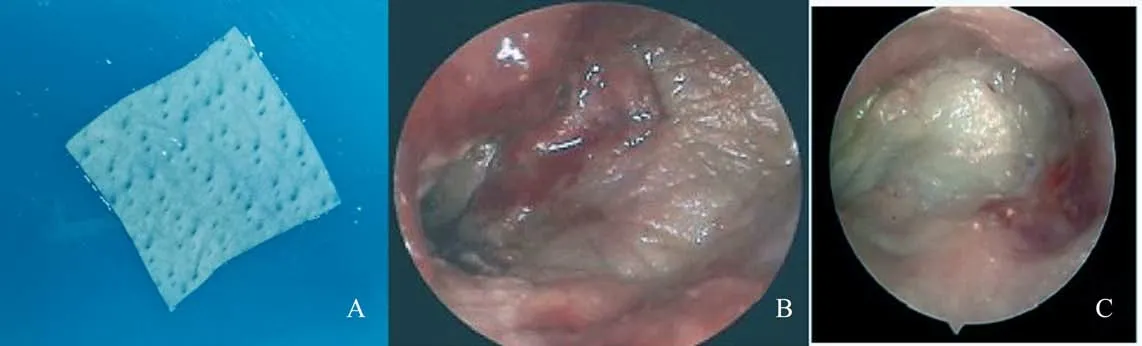
图1 真皮基质组Fig.1 Allogeneic dermal matrix group
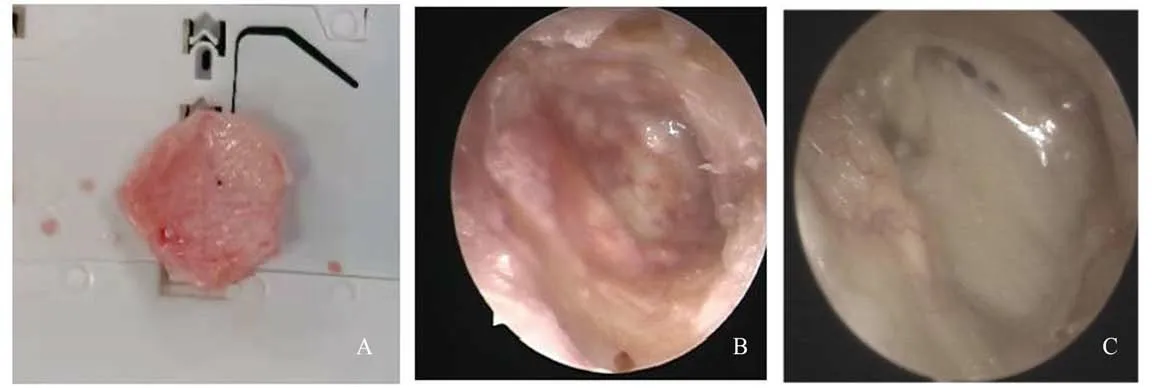
图2 耳屏软骨-软骨膜复合物组Fig.2 Traguscomplex cartilage-Perichondrium group
表1 两组患者临床基本资料Table 1 Basic clinical data of the two groups()
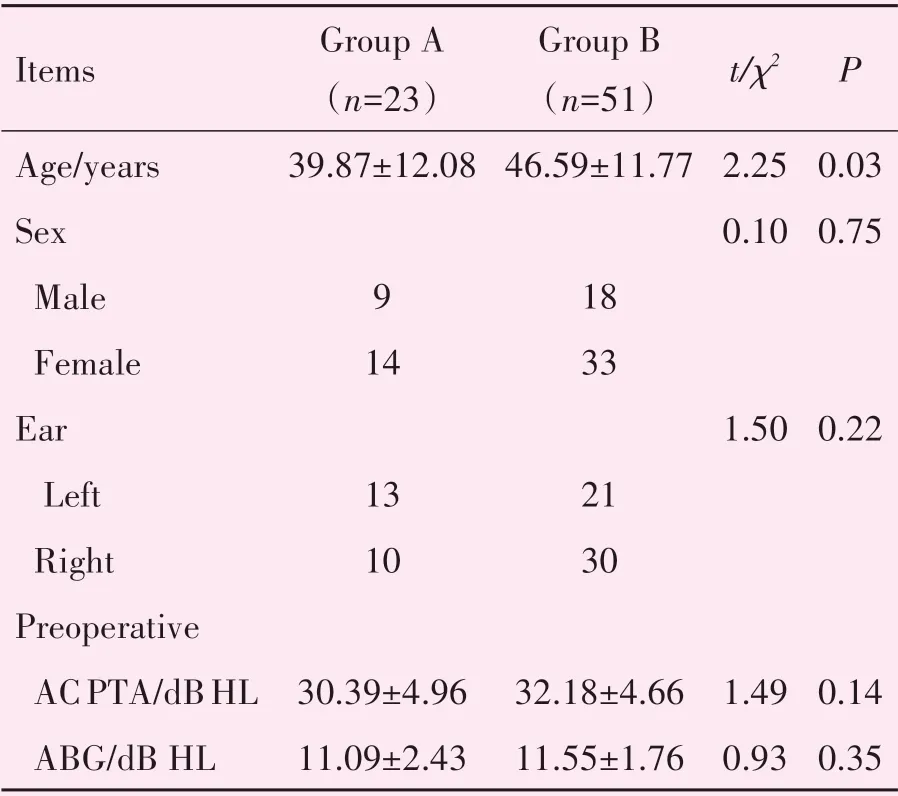
表1 两组患者临床基本资料Table 1 Basic clinical data of the two groups()
AC:air conduction;PTA:Puretone threshold average;ABG:Air-bone gap.
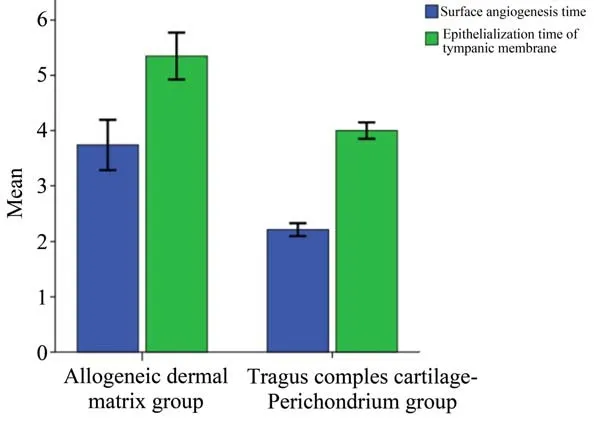
图3 两组鼓膜术后鼓膜血管生长时间和上皮化时间均值比较Fig.3 Comparison of the mean values of time-costing of angiogenesis and epithelization the two groups after tym⁃panoplasty
2.2 组织病理学染色观察
病理组织形态(HE染色)结果可见脱细胞真皮基质仅为胶原纤维,无血管以及细胞等活性成分,见图4A;耳屏软骨膜中含有胶原纤维血管、细胞等活性成分(图4B);耳屏软骨-软骨膜复合物可见致密软骨膜与软骨组织,其中大量存在血管,细胞活性组织以及成骨细胞等(图4C)。并行免疫组化CD31 后同样可见脱细胞真皮基质中,无细胞血管等活性成分,仅有纤维组织;耳屏软骨膜中可见除纤维组织外,可见散在的血管以及细胞核存在(图5A、B)。
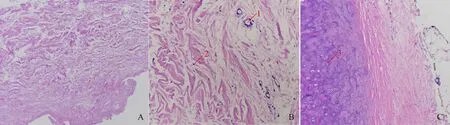
图4 组织病理学观察Fig.4 Histopathological observation
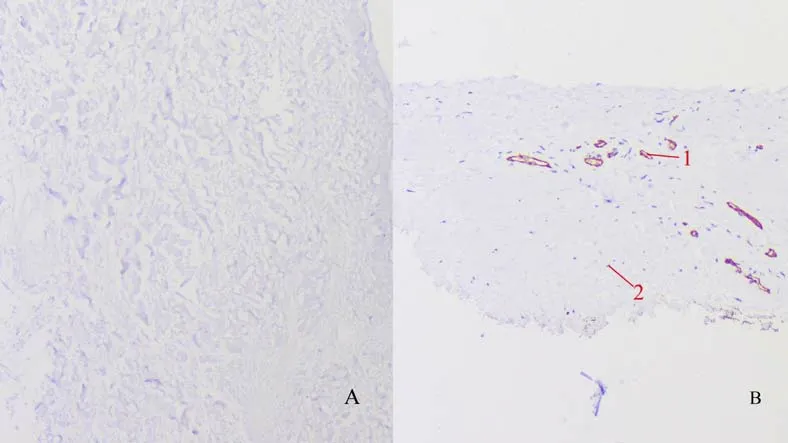
图5 组织病理学免疫组化CD31Fig.5 Histopathology and immunohistochemical staining of CD31
3 讨论
鼓膜成形术,即鼓室成形术I型,其主要目的是修补鼓膜穿孔,防止中耳炎反复发生,提高患者听力。目前鼓膜成形术成功率较高,且术后并发症较低,总体成功率高达81.5%[11]。但是移植物不同,其成功率有较大差别。耳屏软骨-软骨膜复合物是自体移植物中成活率最高的,可达到92%~100%[12-13],是目前鼓膜成形术应用较多的移植物。并且由于取材方便隐蔽,符合目前的耳内镜下微创手术的理想,其应用广泛。自体材料组织相容性好,抗感染性高,并且耳屏软骨-软骨膜复合物修补鼓膜后鼓膜抗压性良好,对于粘连性中耳炎具有良好的支撑效果。但自体移植材料也有不足之处,如:供区新的切口,过大的取材易致取材区域外观变形,提高取材伤口感染的风险[14];并且二次手术相对取材困难,增加了患者痛苦,并且软骨-软骨膜复合物修补的鼓膜透光性差,不易于术后鼓室积液或胆脂瘤复发的早期发现。而组织工程鼓膜可有效的解决以上不足,且更符合目前微创手术的要求。其具有材料充足,创伤小,操作简单无须取材,缩短手术时间等优势。目前已广泛的应用于临床创面的保护等方面。有学者研究指出单纯的鼓膜成形术,使用耳屏软骨-软骨膜或脱细胞真皮基质术后手术成功率与改善听力上无明显差异[8,15]。
脱细胞真皮基质主要分两个类型:人工合成脱细胞真皮基质和天然脱细胞真皮基质。本组研究使用的是后者。脱细胞真皮基质指应用物理和化学方式,去除原皮中的表皮层和真皮细胞成分,仅保留胶原蛋白、弹力蛋白等细胞外基质的无细胞真皮支架材料。由于无组织相容性复合物,所以避免了机体排斥反应[15],有基底膜、真皮两个面。由于缺少细胞活性成分,这势必影响了脱细胞真皮基质鼓膜的促愈合性和抗感染性。
本研究可见自体耳屏软骨-软骨膜复合物愈合速度明显快于脱细胞真皮基质,这可能与细胞活性因子介入的创面修复功能有关[16]。鼓膜穿孔愈合是一个复杂的多因素影响的病理过程,是由细胞、细胞外基质和生物活性分子(如生长因子)之间相互作用和介导地过程[17-18]。在慢性鼓膜穿孔的研究中,不同的生物活性分子均扮演着促进或延迟鼓膜愈合的角色。生长因子可广义上分为5 种主要的家族:表皮生长因子、成纤维细胞生长因子、血小板源性生长因子、转化生长因子和胰岛素样生长因子。各种生长因子在鼓膜穿孔修复过程中起决定性作用,通常在鼓膜损伤时就已出现,其可以刺激穿孔周围组织的内皮细胞和成纤维细胞增殖,增强血管通透性,诱导纤维和新血管的生成等,从而促进鼓膜的修复。这包含了:上皮再生,上皮迁移,成纤维细胞再生,纤维合成及疤痕形成等过程。并且生长因子还可诱发蛋白酶及胶原酶的生成。进一步促进新血管生成。组织病理切片可见,由于脱细胞真皮主要为胶原组织,为防止自身免疫排除,已充分洗脱灭活,所以其内无促进鼓膜愈合的生长因子,这可能会导致愈合时间较自体组织材料愈合长的原因之一[19]。同时可见自体材料CD31 阳性,而白细胞的迁移、血管生成和整合素的激活需要CD31 的参与,其多见于血小板、中性粒细胞、单核细胞和某些类型的T 细胞表面,以及内皮细胞间紧密连接处。这更加验证了自体耳屏软骨膜组织存在活性细胞组织与血管等,且手术会造成细胞破坏释放炎症介质以及各种生长因子,而这些炎症介质以及各种生长因子,又将参与到调节、诱导、促进周围组织增殖,诱导纤维细胞增生、新生血管和上皮形成等作用。有利于鼓膜的愈合。
两组研究组间临床基本资料的研究中,A 组的患者相对比B 组年龄小,研究可见在成人的鼓室成形术手术中年龄对于鼓室成形的影响无统计学意义,甚至鼓膜穿孔的患者自然愈合中,甚至年龄较小的患者中愈合相对更快,所以年龄差异不影响本研究结果可靠性[20]。同时本研究可见脱细胞真皮基质修补后鼓膜颜色较耳屏软骨膜组织苍白这也可能与其新生血管爬生慢,血运相对较差有关。目前,关于组织工程鼓膜的研究国内外仍较少,随着微创外科理念的深入发展其必将是材料工程学的一个研究热点,从而促进组织工程鼓膜的不断创新和发展,最终寻求出一种完美鼓膜修补材料。
